夏季大连湾溶解氧分布变化特征及其与营养盐的关系
吴金浩 ,王年斌 ,张玉凤 ,李爱
(1.辽宁省海洋水产科学研究院,辽宁 大连 116023;2.辽宁省海洋环境监测总站,辽宁 大连 116023)
海水中存在的分子态氧称为溶解氧。一般来说,海水中溶解氧含量主要受到两种作用的影响:一种是海面空气中氧气的溶解及海洋植物的光合作用使得溶解氧含量增加,另一种是海水有机物降解,海洋生物的呼吸等耗氧作用使得溶解氧降低(张正斌等,2004)。若海水中有机物含量较多,其耗氧速度超过氧的补给速度,则水中溶解氧量将不断减少,当水体受到有机物污染时,水中溶解氧量降低甚至可接近于零,这时有机物在缺氧条件下分解就发生腐败发酵现象,使水质恶化,原有的生态平衡被破坏。因此,海水中溶解氧含量是海洋生态环境中的重要指标,它可以直接反映水体污染的程度(Riley et al,1985),也是海洋初级生产力高低的一个重要标志(Harvey,1963),对研究海洋中各种物理和生物化学过程起着重要的作用。近海海域中溶解氧含量受温度、盐度、气压、河流径流、降雨、海水水动力及浮游生物等多方面因素影响,这些因素的共同作用,使海水中溶解氧含量呈现出一定时空变化。海洋中存在着大量的好氧微生物,它们可以将海洋中的有机物作为营养源进行好氧代谢,该过程有助于海水的自净化和保持海洋生态系统的稳定,在海洋各种有机物质氧化分解与浮游植物光合作用的过程中,营养盐不断被消耗和再生,海水中营养盐与溶解氧含量必然存在一定规律性和相关性。大连湾位于辽东半岛南部,是一个三面环陆的天然海湾,同时又是我国水产养殖业的主要基地之一,其沿岸集中了大连市主要的工业企业,接纳了大连市大部分的生活污水和工业废水,近年来大连湾富营养化严重(李震等,2000;杨新梅等,2001;邱春霞等,2005),赤潮也多有发生(郭玉洁,1994;王惠卿等,2000),但针对溶解氧与营养盐相互关系的研究却少有报道。本文在2006年7月大连湾海域溶解氧及相关资料现场调查的基础上,着重讨论大连湾海水中溶解氧含量的分布变化及其与营养盐的关系,为大连湾海域水产养殖与污染治理提供科学依据。
1 调查与分析
2006年7月25日至27日,在大连湾海域开展海洋综合调查,调查站位设置如图l所示。调查中使用颠倒采水器采集表层和底层的水样;其中表层是海面下1 m处,底层是海底以上2 m处。检测方法依据《海洋化学调查技术规程》进行(国家海洋局科技司,2006),溶解氧测定采用碘量法,亚硝酸盐(NO2-N)测定采用萘乙二胺分光光度法,硝酸盐(NO3-N)测定采用锌镉还原法,铵盐(NH4-N)测定采用次溴酸盐氧化法,活性磷酸盐(PO4-P)测定采用磷钼蓝分光光度法,样品用UV2100型分光光度计进行测定。无机氮(DIN)含量为NO2-N、NO3-N与NH4-N的浓度之和。

图1 调查站位及水深平面分布图
2 结果与讨论
2.1 溶解氧的含量分布及影响因素
此次调查期间(7月25日早07∶00至下午16∶00)大连湾表层海水溶解氧含量为 5.66~8.59 mg/L,均值为7.66 mg/L,底层海水溶解氧含量为4.58~8.25 mg/L,均值为7.12 mg/L。表底层溶解氧含量分布趋势较一致,最小值均出现在最靠近湾里甜水套附近的DL013站位,靠近岸边的DL014、DL021等站位溶解氧含量也相对较低,湾中心位置的DL017、湾口处中间的DL020及三山岛附近的DL160号站溶解氧含量相近且明显高于湾里近岸的站位,湾口处DL018、DL023站位溶解氧含量较高,总体而言,大连湾表底层溶解氧含量平面分布趋势均表现为湾里和近岸低,自湾里向湾口外逐渐增大的趋势(图2)。
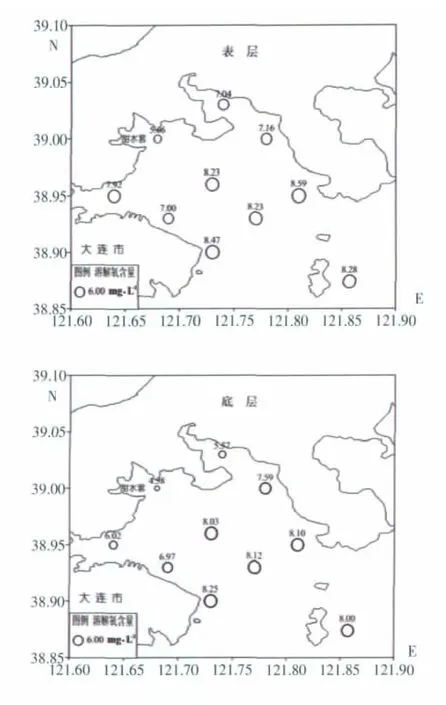
(图中圆圈大小表示溶解氧含量的高低,其上方数字为溶解氧浓度值,单位为:mg·L-1)
通常来说,气体在海水中溶解度受温度影响较为明显,温度越高,氧在水中的溶解度越低,二者一般呈现负相关关系。而本次调查海域表层溶解氧含量和温度线性回归拟合结果表明,表层溶解氧与温度几乎不存在相关性(r=-0.44,n=10,P=0.20),即温度对表层水体溶解氧含量的影响作用不显著,底层溶解氧含量与温度表现为较弱的负相关性(r=-0.64,n=10,P<0.05),即溶解氧含量随着温度的升高表现出弱的降低的趋势。由此可见,就本次调查而言,温度对大连湾海域溶解氧的影响不同于一般规律,其对溶解氧含量的影响作用不显著,温度不是该海域溶解氧分布变化的主要影响因素,尤其是表层水体。这可能是由于一方面夏季水体温度较高且分布比较均匀不同区域差异不大;另一方面调查海域属于近岸海域,相对于远海来说,水体与大气的氧气交换比较充分,同时近岸海域营养丰富,表层水体浮游植物生长旺盛光合作用强烈,部分站位溶解氧处于接近饱和或者过饱和状态,温度的影响作用不显著。
盐度是影响海水溶解氧含量的另一重要因素。调查海域表层水体溶解氧与盐度的相关性分析表明,两者呈现正相关(r=0.56,n=10,P=0.09),底层溶解氧含量与盐度呈现较为显著的正相关(r=0.61,n=10,P<0.05),即盐度越高,溶解氧含量越高。本次调查期间大连湾为大潮、活汛,采样时间大部分为涨潮或满潮时(高潮为14∶00左右),结合以上相关性分析,说明本次调查海域水体溶解氧含量还一定程度上受到外海水入侵的影响。
结合潮流场的资料分析,靠近大连湾湾口处的站位基本呈现往复流型(中国海湾志编纂委员会,1991),DL018基本呈现东南-西北流向,大孤山海域附近的DL023则呈现东-西流向的往复流,两者均朝向DL017站位,因此这几个站位溶解氧受外海影响较大,含量较高。同时靠近臭水套里的DL010站位表层溶解氧含量却明显高于其他靠近岸边的站位,这也主要是受到该区域西南-东北流向的往复流影响造成的,而其他湾里近岸的海域主要为旋转流型,溶解氧含量受外海影响较小。
综上所述,可见大连湾调查海域溶解氧含量湾里和近岸低、自湾里向湾口外逐渐增大分布趋势是两方面作用的综合结果:一方面大连湾近岸湾里有大量生活污水排入,随着夏季水温的升高,生物的呼吸作用及有机物的氧化作用加剧,消耗大量溶解氧,又与外海水交换不够充分,使得湾里近岸海域溶解氧含量相对较低;另一方面,大连湾潮流场的分布使得含有较高溶解氧的外海水入侵,湾口外水体溶解氧含量呈现高值。
2.2 溶解氧的周日变化
7月26日至27日针对调查海域DL017站位的连续观测发现,表底层溶解氧24 h内具有各自不同的变化特征。表层溶解氧含量日变幅为0.37 mg/L,白天(特别是午后至傍晚)测值高,最大值出现在16∶00时分左右,然后逐渐降低,晚上(特别是午夜至清晨)测值较低,22∶00时分左右出现最小值,从溶解氧与叶绿素a含量的周日变化曲线上可以明显看出(图3),白天日光充足,叶绿素a含量较高,光合作用明显,溶解氧含量较高,晚上浮游植物以呼吸作用为主,溶解氧含量降低,因此可见大连湾表层溶解氧含量的日变化受水体浮游植物活动的影响显著。同时从表层溶解氧与盐度的周日变化曲线上来看(图3),尤其是晚上表层溶解氧与盐度变化趋势较为一致,因此还表现出一定潮汐性,即盐度高时溶解氧含量也高,如凌晨1∶30时的数值所示,与2.1节中所述的外海溶解氧含量高的现象相吻合。底层溶解氧含量日变幅为0.32mg/L,且周日变化趋势与盐度相一致,但时间滞后(图3)。这应该是由于涨潮时随着高溶解氧的外海水的入侵水体溶解氧随盐度增高而增大,落潮开始时原表层含有较高溶解氧的海水逐渐下降到底层,使得底层溶解氧持续升高,随着高盐水的进一步后退,溶解氧含量才开始呈现降低趋势;落潮到最低点时情况亦如此,故底层溶解氧含量的周日变化滞后于盐度。因此,夏季大连湾表底层溶解氧周日变化影响因素各不相同,表层海水溶解氧白天受浮游植物活动影响显著,夜晚表现出一定潮汐性,而底层溶解氧则呈现出较显著的潮汐性。
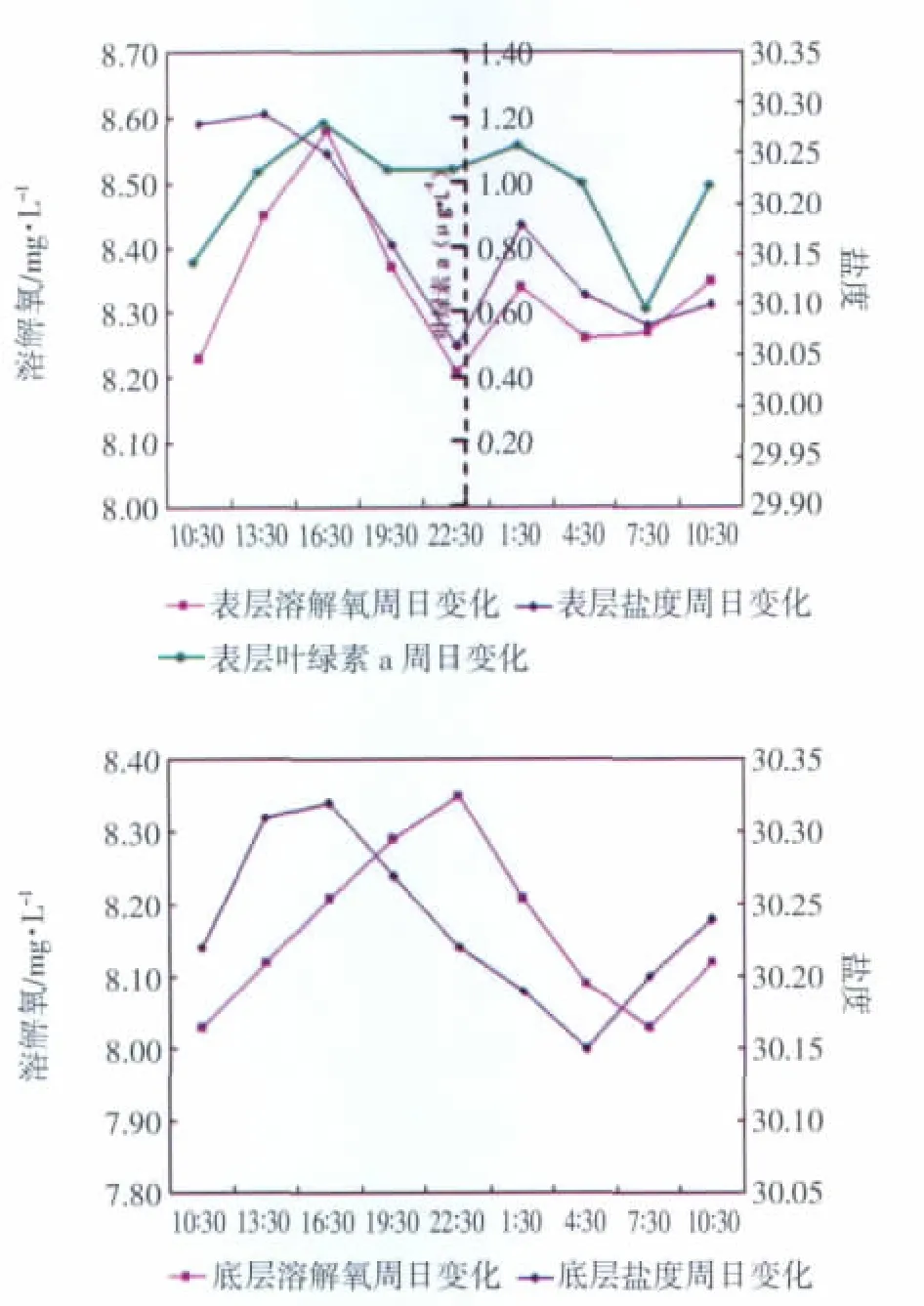
图3 大连湾表底层溶解氧含量周日变化曲线
2.3 溶解氧与营养盐的关系
一定温度、盐度下,海水中实测的溶解氧含量与该条件下计算得到的溶解氧饱和含量之间的差异,一般认为是由光合作用或有机物质的氧化造成的。因此海水中溶解氧含量变化与伴随这些过程所发生的营养盐再生有着密切的关系。为了研究溶解氧含量变化与营养要素再生的关系,还需要引入表观耗氧量(AOU)的定义(Pytkouicz,1971),计算式为:

其中CO2′表示现场温度、盐度下的氧饱和含量;CO2表示在现场测定的溶解氧含量。
在真光层以上,如果浮游植物产氧的量大于有机物降解消耗氧的量,则AOU呈现负值,此时为“产氧”水体;如果浮游植物产氧的量减少,而有机物降解耗氧较多,则会使得水体AOU呈现正值,此时为“耗氧”水体。如果将大连湾调查海域作为一个水体来分析,基于所有采集到的表底层溶解氧含量数据结果分析,该海域33.3%为“产氧”水体,主要位于大连湾湾口溶解氧含量较高的区域;66.7%为“耗氧”水体,主要位于湾里和近岸溶解氧含量较低的区域。可见大连湾较大部分调查区域水体耗氧速度超过氧的补给速度,水中溶解氧量降低可能会一定程度上影响到该区域海洋生态系统的健康。
本文着重讨论该海域“耗氧”水体中营养盐与消耗氧之间的关系。由表1可以看出,“耗氧”水体中表观耗氧量与4种营养盐均表现为较为显著的正相关性,也就是说随着溶解氧的消耗,AOU增大,各种营养盐含量亦增大,该海域营养盐的再生与溶解氧有着密切的关系,尤其是NH4-N、PO4-P与AOU呈现非常好的正相关。同时NH4-N、PO4-P与盐度均不存在较显著的相关性,即大连湾周边降水、径流、生活用水的排放等没有明显导致这两种营养盐的增加,并且由于港口改扩建工程已基本清除了区域内的海水养殖业,因此,在没有其他明显外源性输入的情况下,NH4-N、PO4-P应该是主要来源于大量有机物的氧化。
有研究指出(Glibert et al,1982),在真光层中再循环的N主要是NH4-N,并且浮游植物首先吸收NH4-N,在有机物分解矿化过程中,蛋白质降解为氨基酸,然后氨基酸被氧化而释放出NH4-N。本次调查发现该海域N/P比值平均为9.8,小于Redfield比值 16(Redfield et al,1963),N 明显相对不足,新生成的NH4-N更可能优先被浮游植物吸收,这就一定程度上减少了NH4-N被氧化成NO2-N和NO3-N的可能。多位学者曾提出有机物的再矿化过程如下式所示(Riley et al,1975):

表1 该海域“耗氧”水体中各种营养盐与表观耗氧量及盐度的相关系数(n=18,n为样品数)
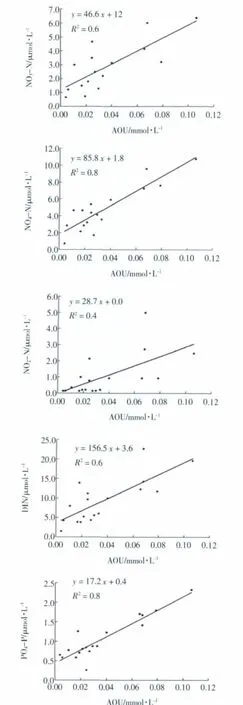
图4 该海域“耗氧”水体中各种营养盐与表观耗氧量的线性关系

但在不同的氧化还原环境中,随着氧化还原电位的变化,有机物氧化的产物也不太一致,溶解氧充足的水层一般分两个阶段,第一个阶段是含碳有机物的氧化,第二个阶段是以硝化作用为主。本次调查大连湾海域样品大都处于真光层,其中NH4-N含量占DIN含量的比例近60%,离岸较远的站位甚至达到90%,夏季海洋浮游植物生长旺盛期,大量分解代谢产生的NH4-N来不及被氧化为NO3-N,因此,推断NH4-N可能是该海域有机物氧化的主要产物,同时PO4-P也会被释放出来。按照以上分析该海域有机物的耗氧分解过程更可能发生以下反应:

然后NH4-N再可能被氧化成NO2-N或NO3-N,也就是说有机物的分解过程以上两种都可能存在,从化学方程式上看,△CAOU/△CNO3=138/16=8.6,而△CAOU/△CNH3=106/16=6.6,理论上,本海域的△CAOU/△CDIN应该介于两者之间,也就是说有机物分解每生成1 mol的DIN应该消耗6.6~8.6 mol的O2,而由图4斜率推算可知,△CAOU/△CDIN=6.4,更接近6.6,这也进一步验证该海域有机物的氧化主要产物为NH4-N,而不是NO2-N或NO3-N。通过三种营养盐与AOU的曲线斜率算出,每消耗一定量溶解氧生成NO2-N、NO3-N和NH4-N的比值约为2∶3∶6,NH4-N占到近60%,NH4-N是有机物的氧化的主要产物,有机物氧化也应该是该海域NH4-N的一个重要来源,至于其贡献率还需进一步研究。另外,△CAOU/△CDIN=6.4小于理论值可能是由于陆源输入的NO2-N和NO3-N含量增加,使得△CDIN增大造成的,同时也与浮游植物光合作用产氧较多有关。
按照上面的分析,△CAOU/△CP理论上应该为106~138,而由图4可知实际△CAOU/△CP=58.1小于理论值,可能的原因为:一方面夏季调查海域浮游植物光合作用较强,产氧较高,使得△CAOU降低;另一方面,浮游植物生长快速,PO4-P消耗比较快,该海域存在一定量PO4-P的陆源输入,底质沉积物中的PO4-P也向海水中扩散,通常不能被藻类细胞直接利用得溶解有机磷,也通过水解转化为PO4-P,导致△CP增大,使得△CAOU/△CP小于理论值。
进一步分析AOU与DIN,PO4-P的关系,每消耗一定量溶解氧生成的N、P比值约为9∶1,而海洋浮游生物和大洋中的△CN/△CP比值一般恒定在16∶1,偏离过或过低的话,其中含量相对低的元素将形成浮游植物生长的控制因素。因此,本海域N,P营养元素中,N是初级生产力的主要控制因素,△CN/△CP比值偏低并不是N的含量低,而是因为P的含量相对比较高,本次调查仅PO4-P平均含量就高达0.027 mg/L,由于长期P的增加导致了该海域N、P比值的失衡。
3 结论
(1)大连湾表层海水溶解氧含量为 5.66~8.59 mg/L,均值为7.66 mg/L,底层海水溶解氧含量为4.58~8.25 mg/L,均值为7.12 mg/L,表底层溶解氧含量平面分布趋势一致,均表现为湾里和近岸低,自湾里向湾口外逐渐增大的趋势
(2)夏季大连湾表底层溶解氧周日变化影响因素各不相同,表层溶解氧白天受浮游植物影响显著,夜晚表现出一定潮汐性,而底层溶解氧周日变化趋势与盐度相一致,但时间滞后,呈现出较显著的潮汐性。
(3)该海域营养盐的再生与溶解氧有着密切的关系,尤其是NH4-N、PO4-P与AOU呈现非常好的相关性。DIN中NH4-N是有机物氧化的主要产物。△CAOU/△CDIN和△CAOU/△CP的比值均小于理论值。本海域N,P营养元素中,N是初级生产力的主要控制因素,△CN/△CP比值偏低并不是N的含量低,而是因为P的含量相对比较高导致了该海域N、P比值的失衡。
Glibert P M,Lipschultz F,McCarthy J J,et al,1982.Isotope dilution models of uptake and remineralization of ammonium by marine phytoplankton.Limnol.Oceanogr,27:639-650.
Harvey H W,1963.The Chemistry and Fertility of Sea Waters.Cambridge University,London,95-99,183-185.
Pytkouicz R M,1971.On the apparent oxygen utilization and the preformed phosphate in the oceans.Limnol.Oceanogr,16:39-42.
Redfield A C,Ketchum B H.Richards F A,1963.The influence of organisms on the composition seawater.The Sea,(02):26-77.
Riley J P,Skirrow G,1985.化学海洋学(第二卷).崔清晨译.北京:海洋出版社,267-320.
国家海洋局科技司,2006.海洋化学调查技术规程.北京:海洋出版社,25-34.
郭玉洁,1994.大连湾赤潮生物—潮异弯藻.海洋与湖沼,25(2):211-215.
李震,刘景泰,2000.大连湾海域水体富营养状况分析.中国环境监测,16(1):38-41.
邱春霞,邵秘华,李玉娜,等,2005.大连湾海域生态环境现状的评估.大连海事大学学报,31(1):77-80.
王惠卿,杜广玉,2000.大连市近岸海域赤潮状况、预测及防治对策.中国环境监测,16(6):42-46.
杨新梅,陈志宏,焦亦平,等,2001.大连湾海水环境质量状况分析.海洋环境科学,20(4):18-20.
中国海湾志编纂委员会,1991.中国海湾志(第二分册).北京:海洋出版社,258-267.
张正斌,2004.海洋化学.青岛:中国海洋大学出版社,106-111.

