干酪乳杆菌LC2W原生质体的制备与再生
黄 茜,杜昭平,马成杰,潘能庆,刘 蕾,马爱民,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.乳业生物技术国家重点实验室,光明乳业股份有限公司技术中心,上海 200436)
乳酸菌作为基因工程菌表达外源蛋白时不会产生内毒素[1],而且经改造后去除质粒的乳酸菌菌株基本不表达本源蛋白[2],这些优点使其非常适合作为外源基因表达的宿主菌,所以乳酸菌食品级表达系统的构建和应用受到了研究者的重视。随着研究的深入,糖诱导表达系统、pH值诱导表达系统、温度敏感表达系统、乳链球菌素诱导表达系统、噬菌体φ3l爆发式诱导表达系统等乳酸菌表达系统被逐步建立[3-6],并成功表达了人干扰素β、HPV-16 E7蛋白以及白细胞介素等多种外源物质[7-9]。
乳酸菌属于革兰氏阳性菌,具有厚且致密的细胞壁,载体DNA转化并进入受体细胞难度较大。相对于常规化学方法和电转化法,原生质体转化法设备条件要求较低、方法简单、结果可靠,具有明显的技术优势。原生质体的制备与再生是实现乳酸菌原生质体转化的技术关键[10],近年来,已有关于保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌及瑞士乳杆菌等乳酸菌原生质体制备、再生及融合方面的研究报道[11-14]。
作为一种被公认为安全的(generally regarded as safe,GRAS)食品级微生物,干酪乳杆菌(Lactobacillus casei)及其微生态制品日益受到国内外的重视,不但应用于益生菌发酵乳制品的生产,而且成为食品级基因克隆和高效外源表达系统研究与开发的热点[15-17]。L. casei LC2W(CGMCC No.0828)在模拟人体消化环境中具有较强的耐受性和优异的存活性能,降高血压等益生功能明显,具备较强的应用开发潜力[18]。本实验通过对影响L. casei LC2W原生质体制备的因素以及原生质体再生的条件进行研究,以期为L. casei LC2W食品级表达系统的构建和菌种改良提供前期的参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
L. casei LC2W(冷冻干燥菌粉) 光明乳业股份有限公司;MRS培养基 德国Merck公司。
原生质体制备液:0.2mol/L pH6.0磷酸盐缓冲液(PBS),含0.8mol/L甘露醇[19];原生质体再生培养基:MRS培养基(不含吐温-80)中添加以下物质(g/L):明胶25.0、蔗糖171.2、氯化钙2.8、氯化镁5.0、胎牛血清(BSA)5.0、琼脂15.0~18.0[20]。
1.1.2 酶与试剂
溶菌酶(用PBS配制成所需的不同质量浓度梯度的酶液,经0.22μm滤膜过滤除菌,现配现用) 韩国Biosharp公司;其他化学试剂(分析纯) 上海国药集团化学试剂有限公司。
1.2 仪器与设备
Centrifuge 5415R台式离心机 德国Eppendorf公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司;SA-300VF高压蒸汽灭菌器 德国Sturdy Industrial公司;Specteumlab22可见分光光度计 上海棱光技术有限公司;Bactron-Ⅰ厌氧培养箱 美国Shellab公司。
1.3 方法
1.3.1 菌种活化
将适量L. casei LC2W冷冻干燥菌粉接种于MRS液体培养基中,转接活化2~3次后于4℃保存备用。
1.3.2 L. casei LC2W生长曲线测定[10]
以1%的接种量向新鲜MRS液体培养基中接种L. casei LC2W活化菌液,于37℃静置培养,每隔2h取样一次,以未接种的MRS液体培养基为参比,测定样品在600nm波长处的光密度(OD)值。
1.3.3 L. casei LC2W原生质体制备[20]
取对数生长期的菌液,用无菌生理盐水梯度稀释至合适稀释度,取0.1mL涂布于MRS固体培养基上,37℃倒置厌氧培养(48±2)h,计菌落数(A)。
取同时期菌液1mL于无菌离心管中,4000r/min离心5min,用原生质体制备液洗涤2次,收集菌体,加入1mL一定浓度的酶液,保温一定时间,4000r/min离心5min,用PBS洗涤1次,然后再用1mL的灭菌的去离子水重悬菌体并静置10min,得到原生质体悬液。
取上述原生质体悬液1mL,经无菌PBS缓冲液梯度稀释至合适梯度后,取0.1mL涂布于MRS固体培养基上,37℃倒置厌氧培养(48±2)h,计菌落数为未形成原生质体菌落数(B)。
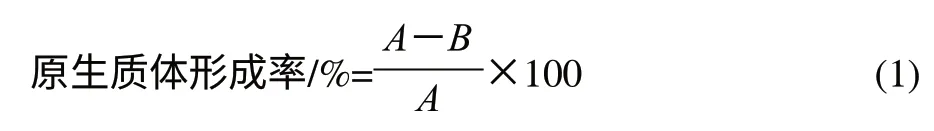
1.3.4 L. casei LC2W原生质体再生[20]
取上述原生质体悬液1mL,用无菌PBS缓冲液稀释至合适稀释度后,取0.1mL涂布于再生培养基上,37℃倒置培养(48±2)h,计菌落数为酶解后再生菌落数(C)。
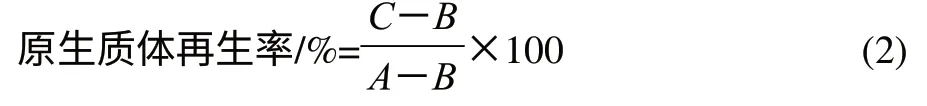
1.3.5 单因素试验确定影响原生质体形成率的因素
菌龄:分别取在液体培养基中培养6、8、10、12、14h的菌体,在溶菌酶质量浓度10mg/mL、酶解温度37℃、酶解时间30min的条件下制备原生质体,计算原生质体形成率。
溶菌酶质量浓度:收集在液体培养基中培养8h的菌体,分别用1、5、10、15、20mg/mL的酶液,在酶解温度37℃、酶解30min的条件下制备原生质体,计算原生质体形成率。
酶解时间:收集在液体培养基中培养8h的菌体,在溶菌酶质量浓度10mg/mL、酶解温度37℃的条件下制备原生质体,分别在酶解15、30、45、60、75、90min时取样,计算原生质体形成率。
酶解温度:收集在液体培养基中培养8h的菌体,在溶菌酶质量浓度10mg/mL,分别在20、28、37、42、50℃的酶解温度下,酶解30min,制备原生质体,计算原生质体形成率。
1.3.6 正交试验设计
根据单因素试验结果,采用不同菌龄、溶菌酶质量浓度、酶解时间和酶解温度设计四因素三水平正交试验,以此来优化干酪乳杆菌原生质体的制备条件。
2 结果与分析
2.1 L. casei LC2W的生长曲线
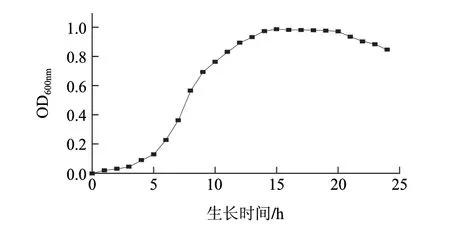
图 1 L. casei LC2W在MRS液体培养基中的生长曲线Fig.1 Growth curve of L. casei LC2W in MRS broth
由图1可知,L. casei LC2W在MRS液体培养基中生长时,5h后进入对数生长期,OD600nm值上升较快;15h左右进入稳定期,OD600nm值达到最大并基本维持稳定;20h后进入衰亡期,菌液OD600nm值开始下降。
2.2 菌龄对原生质体形成率的影响
制备原生质体时,一般选择对数生长期的菌体,这主要是由于对数生长期细菌代谢旺盛,细胞壁肽聚糖含量最低,细胞壁对酶的作用最敏感,但处于对数生长早期的菌体细胞相对脆弱,受酶的过度作用会影响原生质体的再生率[20]。因此,本实验选取处于对数生长中后期的菌体细胞进行原生质体制备与再生,各菌龄下的原生质体形成率如图2所示。当菌龄低于10h时,原生质体形成率随菌龄增加而升高,菌龄为10h时原生质体形成率最高,达到95.24%;随着菌龄的增加,对数生长后期的细胞代谢水平与活力下降,对酶的敏感性逐渐降低,原生质体形成率也就随之下降。
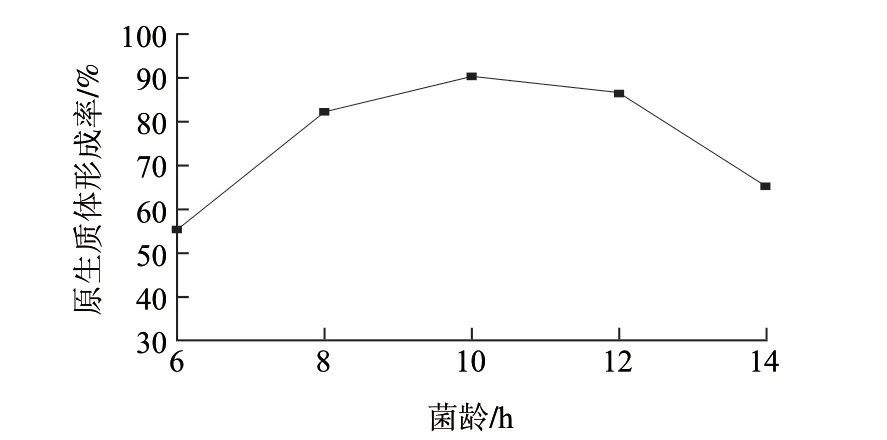
图 2 菌龄对L. casei LC2W原生质体制备的影响Fig.2 Effect of cell age on protoplast preparation of L. casei LC2W
由于处于不同生长时期的菌体生理状态不同,因此各时期的细胞壁的结构、菌体的代谢水平及菌体的活力也都不同。L. casei LC2W菌株对数生长中期的菌体细胞对溶菌酶的敏感性最高,孙磊等[21]的研究结果表明,具有最高转化效率的细胞处于对数生长中期,韩璞等[10]的结果也验证了此观点,因此选取该时期菌龄(8~12h)的细胞进行后续研究。
2.3 溶菌酶质量浓度对原生质体形成率的影响
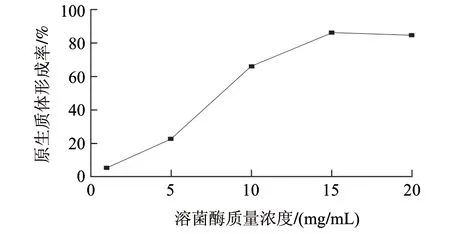
图 3 不同溶菌酶质量浓度对L. casei LC2W原生质体制备的影响Fig.3 Effect of lysozyme concentration on protoplast preparation of L. casei LC2W
溶菌酶质量浓度对L. casei LC2W菌体原生质体形成率的影响见图3,当酶质量浓度为1mg/mL时,原生质体的形成率仅为5.21%;随着酶质量浓度的升高,L. casei LC2W原生质体形成率也不断增加,当酶质量浓度为15mg/mL时,形成率达到最大值85.08%;当酶质量浓度进一步升高时,原生质体形成率略有降低,该结果与韩璞等[10]对罗伊氏乳杆菌原生质体及张莉滟等[11]对保加利亚乳杆菌原生质体的制备和再生结果一致。
分析认为,溶菌酶质量浓度较低时,对L. casei LC2W菌体细胞壁作用不完全,原生质体形成率不高;酶质量浓度的升高增加了酶分子与细胞壁接触的机会,使得细胞壁被水解的几率增大;当溶菌酶质量浓度超过最佳处理质量浓度时,酶已处理完全,不再形成原生质体;而酶质量浓度过高时,在细胞壁水解完全后,可能会进一步水解细胞膜上的部分蛋白成分引起细胞失活,甚至破裂,从而导致原生质体形成率降低[22-23]。因此,适宜的溶菌酶质量浓度是影响原生质体制备的重要因素之一,本研究采用10、15、20mg/mL溶菌酶质量浓度进行正交试验。
2.4 酶解时间对原生质体形成率的影响
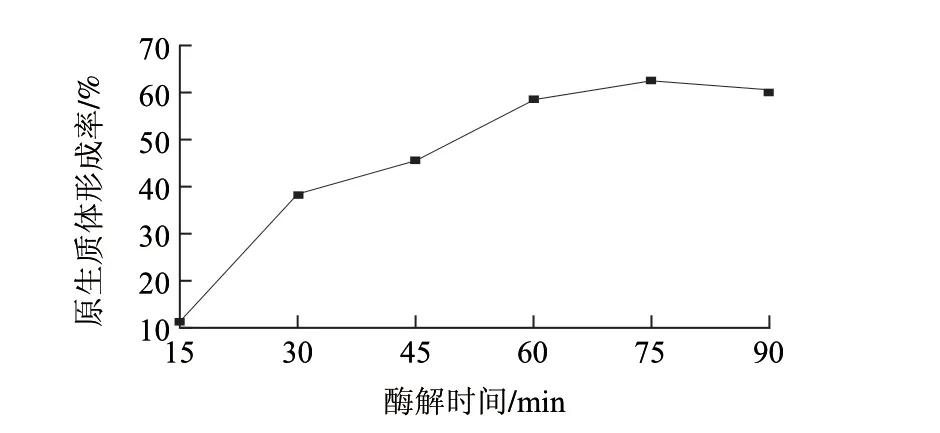
图 4 不同酶解时间对L. casei LC2W原生质体制备的影响Fig.4 Effect of enzymolysis time on protoplast preparation of L. casei LC2W
溶菌酶酶解时间对L. casei LC2W菌体原生质体形成率的影响如图4所示。随着酶解时间的延长,L. casei LC2W原生质体形成率随之升高;当酶解时间达到75min时,原生质体形成率最高为62.47%;但当酶解时间延长至90min时,原生质体形成率反而有所降低,仅为60.38%。
适宜的酶解时间是制备原生质体的重要条件。不同的微生物的最适酶解时间差异很大,仲松等[24]制备干酪乳杆菌ZZ-L原生质体的最佳酶解时间为110min,王玉华等[12]制备嗜酸乳杆菌的最佳酶解时间为90min。酶解时间过短,酶对细胞壁作用不彻底,原生质体制备率不高;酶解时间过长将导致原生质体皱缩,容易造成原生质体活性降低,甚至会损害细胞质膜导致再生率急剧下降[22]。本研究选取60、75、90min 3个酶解时间进行正交试验。
2.5 酶解温度对原生质体形成率的影响
溶菌酶酶解温度对L. casei LC2W菌体原生质体形成率的影响如图5所示。当酶解温度从20℃升至42℃时,L. casei LC2W原生质体形成率逐渐增加;当酶解温度达到42℃时,原生质体形成率最高达85.71%;而酶解温度继续升高时,原生质体形成率反而迅速下降。
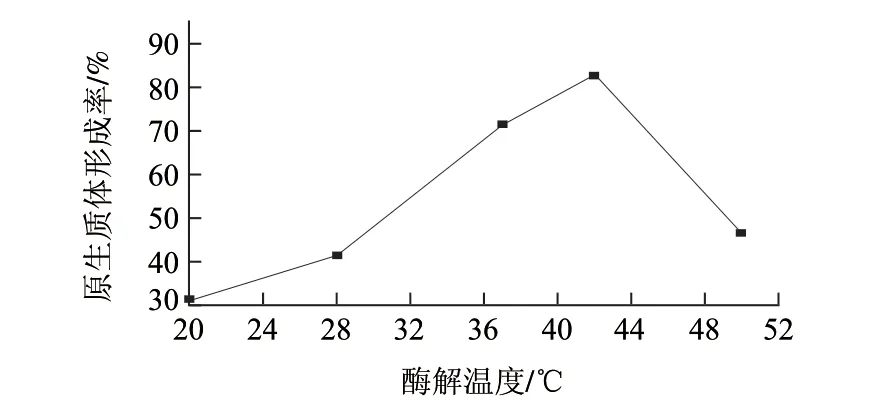
图 5 不同酶解温度对L. casei LC2W原生质体制备的影响Fig.5 Effect of enzymolysis temperature on protoplast preparation of L. casei LC2W
研究表明[25],最适酶解温度都要略高于微生物的最适生长温度。在低于最适酶解温度时,随着温度的升高,原生质体制备率不断提高;高于最适酶解温度时,由于细胞活性和酶活性都会受到高温的影响,原生质体的制备率也必然会受到影响。根据单因素试验结果,选取37、42、50℃ 3个酶解温度进行正交试验。
2.6 正交试验优化
根据单因素试验确定的菌龄、溶菌酶质量浓度、酶解时间和酶解温度梯度,进行L9(34)正交试验,结果如表1所示。
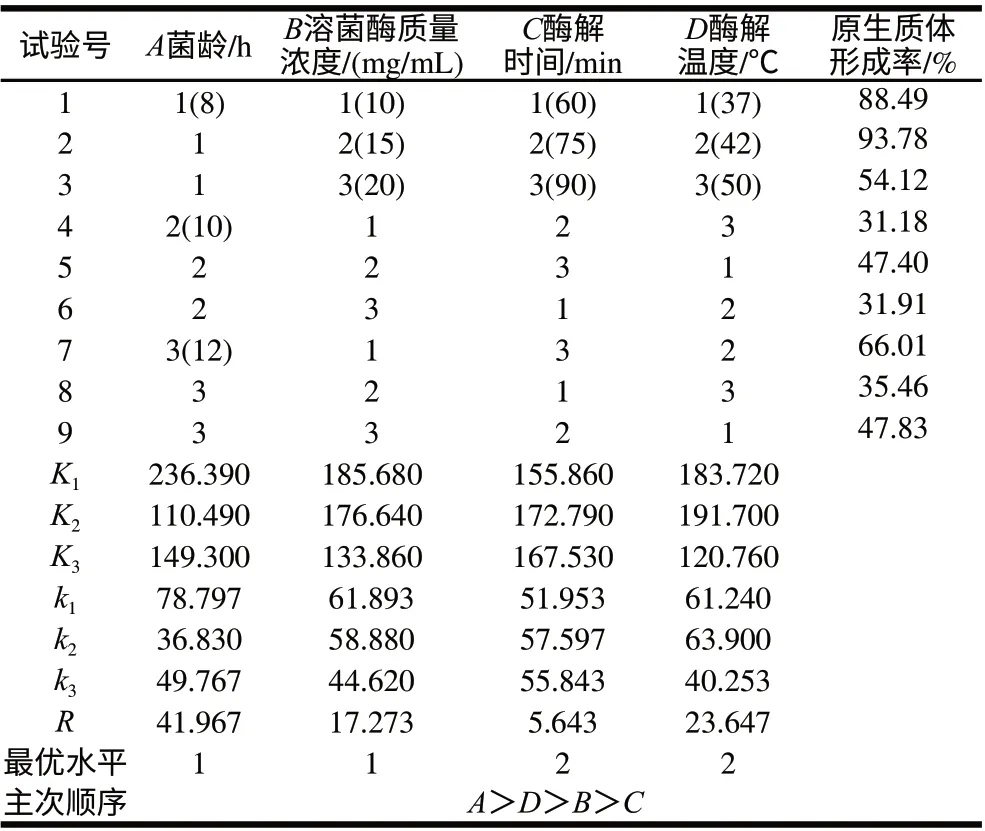
表 1 正交试验优化原生质体制备条件Table 1 Results of orthogonal tests for optimizing protoplast formation of L. casei
由表1可知,极差分析结果表明,影响L. casei LC2W原生质体形成的4因素主次顺序为:A>D>B>C,即菌龄>酶解温度>溶菌酶质量浓度>酶解时间。L. casei LC2W原生质体制备最佳条件为A1B1C2D2,即菌龄8h、溶菌酶质量浓度10mg/mL、酶解时间75min、酶解温度42℃,按此优化条件进行验证实验,重复3次,取平均值,得原生质体形成率为97.15%。
2.7 L.casei LC2W原生质体的再生
经优化条件制备的L.casei LC2W原生质体在再生培养基中生长状态良好,菌落形态如图6所示,呈圆形,表面湿润光滑,乳白色,不透明。在此优化条件下,L.casei LC2W原生质体再生率为31.25%。
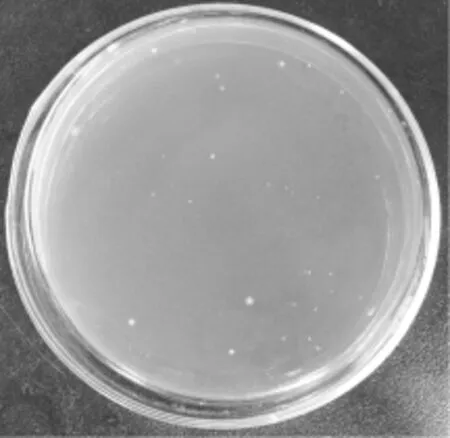
图 6 L. casei LC2W原生质体在再生培养基上的菌落形态Fig.6 Colony morphology of L. casei LC2W protoplast in regeneration medium
3 结 论
作为我国卫生部2010年公布的可用于食品的益生菌菌种之一,干酪乳杆菌的安全性优势越来越受到研究者的青睐,成为食品级外源蛋白表达系统的研究热点。干酪乳杆菌细胞壁中肽聚糖含量较高,不利于进行各种分子生物学操作,而使用去除细胞壁的原生质体作为实验材料,可以提高基因工程操作的工作效率[26]。L. casei LC2W具备良好的益生功能和开发潜力,开展L. casei LC2W的原生质体制备与再生条件的研究可以为L. casei LC2W的食品级外源表达系统的研究提供相关基础,具有一定的实际意义和基础应用价值。
本实验对影响L. casei LC2W原生质体制备的因素进行了分析和优化,并确定最佳制备条件为:菌龄8h、溶菌酶质量浓度10mg/mL、酶解时间75min、酶解温度42℃,在此条件下,原生质体的形成率达到97.15%,再生率为31.25%。
[1] 阮孟斌, 朱明月, 周鹏. 外源基因在乳酸菌中的表达[J]. 应用与环境生物学报, 2004, 10(4): 526-529.
[2] JOHANSEN E. Challenges when transferring technology from Lactococcus laboratory strains to industrial strains[J]. Genetics and Molecular Research, 2003, 2(1): 112-116.
[3] HO P S, KWANG J, LEE Y K. Intragastric administration of Lactobacillus casei expression transmissible gastroenteritis coronavirus spike glycoprotein induced specific antibody production[J]. Vaccine, 2005, 23(11): 1335-1342.
[4] El DEMERDASH H A, HELLER K, GEIS A. Application of the shsp gene, encoding a small heat shock protein, as a food grade selection marker for lactic acid bacteria[J]. Applied and Environmental Microbiology, 2003, 69(8): 4408-4412.
[5] NEU T, HENRICH B. New thermosensitive delivery vector and its use to enable nisin controlled gene expression in Lactobacillus gasseri[J]. Applied and Environmental Microbiology, 2003, 69(3): 1377-1382.
[6] ZHOU Xuxia, LI Weifn, MA Guoxia. The nisin-controlled gene expression system: construction, application and improvements[J]. Biotechnology Advances, 2006, 24(3): 285-295.
[7] 王莹, 胡桂学. 食品级乳酸菌表达系统的研究进展[J]. 中国畜牧兽医, 2010, 37(7): 80-82.
[8] ZHUANG Zhong, WU Zhigang, CHEN Min, et al. Secretion of human interferon-β 1b by recombinant Lactococcus lactis[J]. Biotechnology Letters, 2008, 30(10): 1819-1823.
[9] CORTES-PEREZ N G, BERMÚDEZ-HUMÁRAN L G, Le LOIR Y, et al. Mice immunization with live lactococci displaying a surface anchored HPV-16 E7 oncoprotein[J]. FEMS Microbiology Letter, 2003, 229(1): 37-42.
[10] 韩璞, 田洪涛, 苑社强, 等. 罗伊氏乳杆菌原生质体的制备与再生条件的研究[J]. 中国食品学报, 2010, 10(1): 10-18.
[11] 张莉滟, 陈林, 张德纯. 保加利亚乳杆菌原生质体的制备与回复研究[J]. 中国微生态学杂志, 2004, 16(2): 73-74.
[12] 王玉华, 张桂荣, 刘景圣. 原生质体融合提高嗜酸乳杆菌耐酸及耐胆盐能力[J]. 食品科学, 2006, 27(3): 96-99.
[13] 贾建波, 陈军, 时号. 乳酸菌融合菌株的构建及其特性研究[J]. 食品科学, 2009, 30(21): 309-311.
[14] 罗红霞, 陈志刚, 黄彦芳, 等. 原生质体融合技术选育弱后酸化乳酸菌菌株的研究[J]. 中国乳品工业, 2010, 38(1): 8-11.
[15] 魏春华, 刘建奎, 侯喜林, 等. 重组ETEC k88ac-LTB干酪乳杆菌在人工消化液中的生存性能[J]. 生物工程学报, 2009, 25(1): 43-48.
[16] XU Yigang, LI Yijing. Construction of recombinant Lactobacillus casei efficiently surface displayed and secreted porcine parvovirus VP2 protein and comparison of the immune responses induced by oral immunization[J]. Immunology, 2008, 124(1): 68-75.
[17] CHEN H L, LAI Yiwen, CHEN Chuashun. Probiotic Lactobacillus casei expressing human lactoferrin elevates antibacterial activity in the gastrointestinal tract[J]. Biometals, 2010, 23(3): 543-554.
[18] 吴正钧. 干酪乳杆菌LC2W菌体的抗高血压作用[J]. 天然产物研究与开发, 2011, 23(2): 228-231.
[19] PATNAIK R, LOUIE S, GAVRILOVIC V, et al. Genome shuffling of Lactobacillus for improved acid tolerance[J]. Nature Biotechnology, 2002, 20(7): 707-712.
[20] 曾献春, 孟冬丽. 乳酸菌原生质体制备与再生研究[J]. 食品科学, 2006, 27(10): 269-272.
[21] 孙磊, 孔文涛, 孔健. 乳酸乳球菌电转化条件的研究[J]. 山东大学学报: 理学版, 2005, 40(3): 121-124.
[22] 仝千秋. 保加利亚乳杆菌生物学特性及原生质体制备的研究[D]. 郑州: 河南农业大学, 2006.
[23] 邱静, 罗水忠, 姜绍通, 等. 高产L-乳酸米根霉的原生质体制备与再生条件研究[J]. 食品科学, 2011, 32(9): 174-178.
[24] 仲松, 张庆庆, 孙平平. 紫外诱变原生质体选育高产L-乳酸菌株的研究[J]. 安徽工程大学学报, 2011, 26(1): 28-30.
[25] 李秀珍, 杨平平, 王燕. 黑曲霉原生质体诱变育种技术研究进展[J]. 中国酿造, 2007(12): 1-5.
[26] 谷伟, 钱方. 乳酸菌的生物工程育种[J]. 食品科技, 2007, 32(1): 4-7.

