清酒乳杆菌素LSJ618的抑菌方式
柯芳芳,李 蕾
(安徽农业大学 生命科学学院,安徽 合肥 230036)
乳酸菌细菌素不仅种类多、来源广而且生物学特性优良,是目前研究得最深入广泛的细菌素,而这其中乳酸链球菌产生的Nisin是最早深入研究的代表,并依此建立多个研究模型,对其他细菌素的研究也有很大帮助,Nisin已被公认为安全高效的食品防腐剂[1].其他类乳酸菌素的研究也有很多,仅报道的清酒乳杆菌素Sakacin有30多种[2],这些细菌素作为防腐剂均具有高安全性,无毒副作用等特点.目前,研究发现细菌素的生物活性的表现有多种作用机制,一般来说,细菌素在易感细菌细胞膜上形成孔道是最常见的作用机制,目前孔道形成的模型有桶板模型、地毯模型(The Carpet Model)以及环形孔模型(The Toroidal Model)三种[3],准确了解这些作用机制对研究细菌素的毒性和合理应用细菌素具有重要意义.由于Nisin仅能抑制革兰氏阳性细菌而对革兰氏阴性细菌无抑制作用,故而迫切需要寻找新的高效广谱细菌素,Sakacin LSJ618可对革兰氏阳性细菌及阴性细菌都有一定的抑制作用,研究其作用方式有助于更好地将Sakacin LSJ618,甚至其它新型细菌素应用于食品行业.
1 材料与方法
1.1 材料与试剂
1.1.1 菌种及培养基
清酒乳杆菌(Lactobacillus sakei)LSJ618,本实验室分离得到,MRS培养基培养;鸡白痢沙门氏菌(Salmonella pullorum)(实验室保存菌株),藤黄微球菌(Micrococcus luteus)(实验室保存菌株),LB培养基培养.
1.1.2 主要试剂及仪器
SephadexTM G-50,紫外分光光度计,电导仪,AvantiTMJ-20XP高速冷冻离心机.
1.2 实验方法
1.2.1 清酒乳杆菌素LSJ618的提纯制备
清酒乳杆菌37℃恒温静置培养24h后,4℃,8000rpm,离心20min,取上清液并经0.22μm滤膜过滤;用截留分子量500Da的透析袋过夜透析除盐,之后将透析袋置于PEG6000中包埋20min以浓缩样品体积至上清液原体积.样品最后经Sephadex G-50凝胶层析分离,收集活性组分,冻干备用.
1.2.2 清酒乳杆菌素LSJ618的效价及蛋白浓度的测定
采用二倍稀释法分别测定清酒乳杆菌素LSJ618对藤黄微球菌及鸡白痢沙门氏菌的抑菌效价(AU/mL),同时经Lowry法[4]测定了相应的蛋白浓度(mg/mL),计算其比活(AU/mg).
1.2.3 清酒乳杆菌素LSJ618的抑菌率测定
接种藤黄微球菌以及鸡白痢沙门氏菌于液体LB培养基中,30℃摇床培养12h后,8000rpm离心20min,收集菌体,再以新鲜LB培养基将其稀释至约105cfu/mL,取10ml该菌悬液,加入LSJ618,使其终浓度为 40AU/mL,30℃孵育 0、10、30、60、90和120min后稀释涂平板,以不添加细菌素的菌悬液作为对照,30℃倒置培养18-24h后计数并根据计算抑菌率[5].
1.2.4 葡萄糖能量化对清酒乳杆菌素LSJ618的抑菌能力的影响
将菌藤黄微球菌培养至对数生长期,经8000rpm离心20min,收集菌体,用5mmol/L pH6.0磷酸缓冲液(PBS缓冲液)洗涤菌体表面3次,并重悬于少量该缓冲液中,4℃静置2h,使细胞代谢消化掉残留能量,然后再次离心,收集菌体并重悬于上述缓冲液中,调节菌液浓度至108cfu/mL,向4支灭菌试管中分别加入5mL菌悬液,并向其中三支加入葡萄糖使其终浓度为0、100和200mmol/L,再分别加入LSJ618使终浓度为20AU/mL,设空白对照.在30℃下孵育30min,然后采用稀释涂平板方法进行活菌计数.以同样方法测定葡萄糖能量化对LSJ618抑制鸡白痢沙门氏菌的影响,实验平行3次.
1.2.5 清酒乳杆菌素LSJ618对敏感菌生长曲线的影响
取装有200mL LB液体培养基的三角瓶四个(每种指示菌四个),均以4%(v/v)的接种量接入种子液(培养至对数期),30℃,110rpm恒温摇床培养.实验组1在接入种子液时同时加入LSJ618,并使其终浓度为20AU/mL;实验组2和实验组3均在在菌液培养6h后加入20AU/mL的细菌素LSJ618,其中第三组在继续培养4h后,再次加入20AU/mL的LSJ618;对照组不添加LSJ618.每隔2h取出5mL培养液测OD600值,用LB液体培养基做空白对照调零.以培养时间(h)为横坐标,OD600值为纵坐标,绘制藤黄微球菌和鸡白痢沙门氏菌的特性生长曲线.实验平行3次.
1.2.6 清酒乳杆菌素LSJ618对敏感菌菌液电导率的影响
分别将培养至到生长对数期的藤黄微球菌和鸡白痢沙门氏菌的菌悬液经8000rpm,离心20min,收集菌体,用5mmol/L pH6.0 PBS缓冲液洗涤菌体表面3次,并重悬于该缓冲液中,调节菌液浓度至108cfu/mL.取4个灭菌三角瓶,分别加入40mL藤黄微球菌菌液,分为4组,第1、2组加入LSJ618其终浓度分别为20AU/mL和40AU/mL;第3组加入最终含量为5%(g/L)的乳酸链球菌nisin;对照组不添加任何细菌素.在混合后的 0min、5min、15min、30min、60min、90min和180min时分别从每组移取5mL菌液测定电导率.以同样方法测定细菌素对鸡白痢沙门氏菌菌液电导率的影响.实验平行3次.
1.2.7 清酒乳杆菌素LSJ618对敏感菌紫外吸收物质泄露的影响
实验前期步骤同1.2.6,添加细菌素后(对照组不添加),30℃恒温孵育,在100min内,每隔20min取样一次,每次取样5mL,于8000rpm离心20min,收集上清液,然后用0.22μm的硝酸纤维素膜过滤,测定滤液在260nm和280nm处的OD值,以处理0min的样品作为空白调零,记录OD变化值.细胞上清液的吸光值的变化,即表示紫外吸收物质的含量的变化.以同样方法测定细菌素对鸡白痢沙门氏菌紫外吸收物质外泄的影响.实验平行3次.
2 结果与分析
2.1 清酒乳杆菌素LSJ618的效价及蛋白浓度的测定结果
经Sephadex G-50凝胶层析获的的活性样品的效价为320AU/mL,蛋白浓度约为1.53mg/mL,比活为209.15AU/mg.
2.2 清酒乳杆菌素LSJ618的抑菌率的测定结果
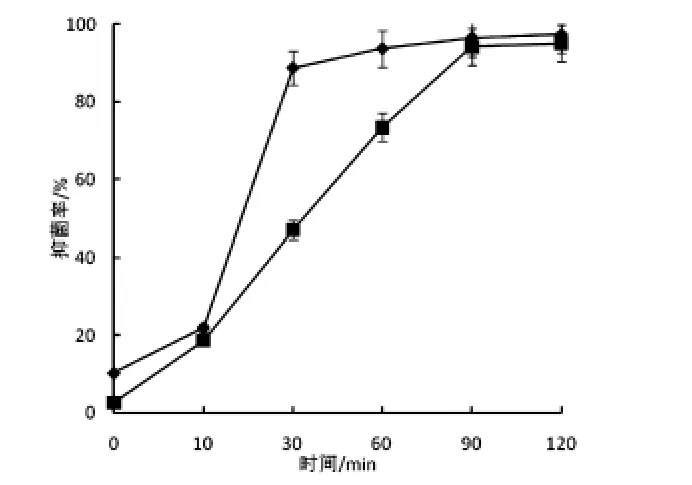
图1 清酒乳杆菌素LSJ618的抑菌率
图1显示了清酒乳杆菌素LSJ618经不同时间作用后对藤黄微球菌和鸡白痢沙门氏菌的抑制效果.结果显示,LSJ618对两种菌均有较好的抑制作用,且在120min内随着作用时间的延长,抑菌率呈现增长趋势.处理30min的鸡白痢沙门氏菌的抑菌率高达90%,而此时对藤黄微球菌的抑菌率仅50%,随着处理时间的增加,LSJ618对两种菌的抑菌率均可达到90%.说明LSJ618同时抑制革兰氏阳性细菌和革兰氏阴性细菌,且可在更短时间内发挥对革兰氏阴性细菌(鸡白痢沙门氏菌)的抑制作用.
2.3 葡萄糖能量化对清酒乳杆菌素LSJ618的抑菌能力的影响
图2及图3显示了葡萄糖能量化的不同细菌敏感性变化不同,从图2可以看出,能量化的藤黄微球菌对LSJ618敏感性增加,也就是说LSJ618抑制能量化的藤黄微球菌的效果增强,虽然加入100mmol/L和200mmol/L的葡萄糖差异性并不明显,这与McAuliffe等[6]发现lacticin 3147对能量化的敏感菌作用效果更好相一致.但是葡萄糖能量化的鸡白痢沙门氏菌和没有能量化的鸡白痢沙门氏菌的敏感性并无区别,可能是由于细菌素作用于革兰氏阴性菌的作用机制与作用于革兰氏阳性菌的机制有一定区别,这个区别是什么仍有待进一步探索.
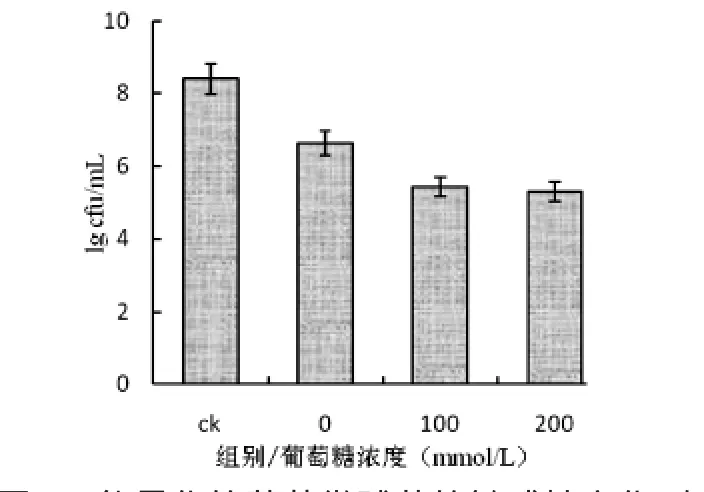
图2 能量化的藤黄微球菌的敏感性变化(左)
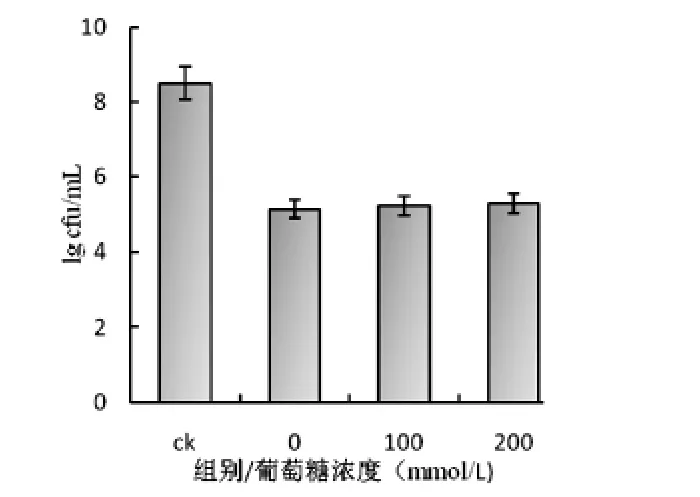
图3 能量化的鸡白痢沙门氏菌的敏感性变化(右)
2.4 清酒乳杆菌素LSJ618对敏感菌生长曲线的影响

图4 清酒乳杆菌素对藤黄微球菌生长的影响
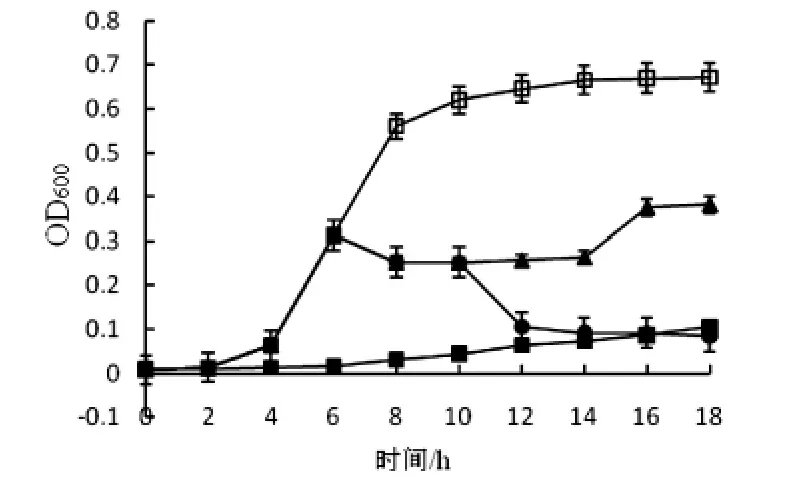
图5 清酒乳杆菌素对鸡白痢沙门氏菌生长的影响
图4-5显示了LSJ618对藤黄微球菌及鸡白痢沙门氏菌生长曲线的影响.结合两图可看出LSJ618对这两种菌均可抑制其生长,与上文抑菌率实验的结果(图1)吻合,并且对这两种敏感菌的影响的大致趋势相同.在0时刻添加LSJ618可在至少12h内抑制或延缓细菌素进入生长对数期并可维持在极低菌浓度水平;当细菌已经培养进入长对数期后加入细菌素,可立即抑制细菌进一步繁殖,并在一定范围内降低菌液浓度,20AU/mL的LSJ618可使菌液浓度降低约0.1个OD600值,这种抑制水平仅可维持8h或更短时间,之后细菌将再次大量繁殖,不过繁殖速率明显低于对照组;多次加入细菌素可呈现出梯段式抑菌效果,因而我们可以推测,在一定范围内加大清酒乳杆菌细菌素浓度可以增强其抑菌效果,这与李丽等[6]研究乳酸片球菌素作用机理时观察到的现象基本一致.
2.5 清酒乳杆菌素LSJ618对敏感菌细胞膜透性的影响
菌体胞内带电粒子的流出及核酸蛋白类物质的外泄均可表示细菌细胞膜受到损伤[7],为了探讨LSJ618对藤黄微球菌及鸡白痢沙门氏菌细胞膜透性的影响,我们研究了不同浓度细菌素处理后的两种敏感菌的菌液电导率值变化及其紫外物质吸收值的变化,并以5%的Nisin作为参比对象.
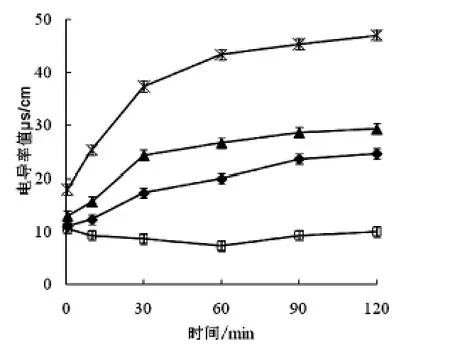
图6 细菌素对藤黄微球菌菌液电导率的影响
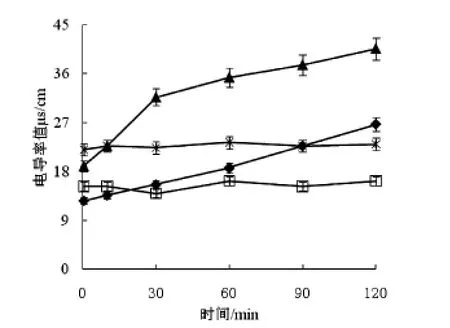
图7 细菌素对鸡白痢沙门氏菌菌液电导率的影响
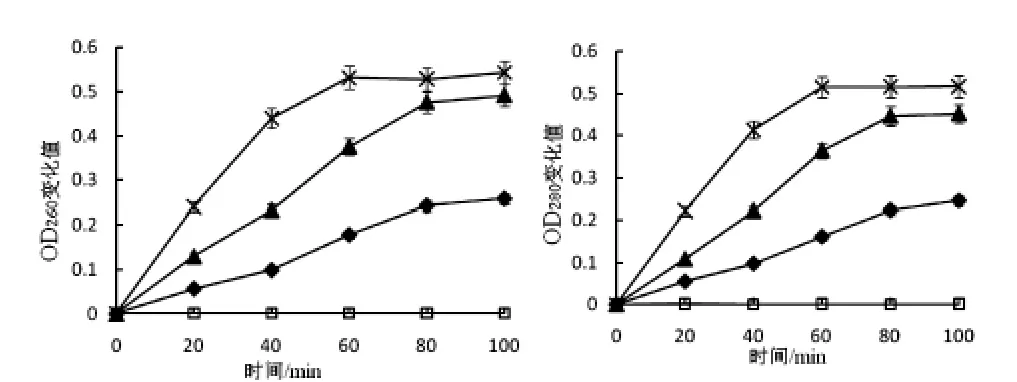
图8 细菌素对藤黄微球菌菌液紫外吸收物质泄露的影响
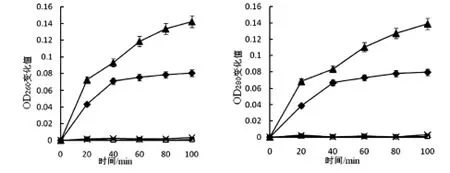
图9 细菌素对鸡白痢沙门氏菌菌液紫外吸收物质泄露的影响
图6-7显示了20AU/mL、40AU/mL的 LSJ618及5%的nisin处理的藤黄微球菌及鸡白痢沙门氏菌菌液电导率值的变化,图8-9显示了紫外吸收物质泄露值的变化,这些都可反应细菌素对指示菌细胞膜透性的影响.
以藤黄微球菌作为指示菌时,未作处理的对照组的电导率不随时间发生变化,添加了LSJ618和Nisin的菌液电导率值和紫外吸收物质变化值均随时间延长而增大,且增大的趋势先急后缓;以鸡白痢沙门氏菌作为指示菌时,添加Nisin的菌液电导率值及紫外吸收物质变化值并不随时间延长而发生变化,这与Nisin不抑制革兰氏阴性菌的现象一致,但是清酒乳杆菌素LSJ618可同时引起两种指示菌电导率值及紫外吸收物质变化值的升高,可以推断LSJ618可增加这两种指示菌细胞膜透性,进而杀死细菌,这与前文所述结果一致.
添加40AU/mL的LSJ618比添加20AU/mL的LSJ618可引起指示菌菌液电导率及紫外吸收物质变化值加大,即增加LSJ618浓度可以增大其抑菌效果,这一结论验证了与LSJ618对敏感菌生长曲线的影响试验中结果相一致.
3 结论与讨论
清酒乳杆菌素Sakasin LSJ618可在较短时间内发挥对藤黄微球菌(革兰氏阳性菌)和鸡白痢沙门氏菌(革兰氏阴性菌)的抑制作用,40AU/mL的Sakasin LSJ618处理1h可达近90%的抑菌率.研究Sakasin LSJ618对这两种菌的生长曲线的影响,发现在初始时刻添加Sakasin LSJ618可有效保持菌液浓度维持在一个很低水平长达12h,当指示菌进入生长对数期后,添加Sakasin LSJ618可立即使菌液OD600值下降并维持数小时,但幅度不是很大,多次添加Sakasin LSJ618会使指示菌生长曲线多次出现下降现象,表明增加Sakasin LSJ618浓度有助于其抑菌效果更加明显.此外经Sakasin LSJ618处理后的只是菌菌液电导率值及紫外吸收物质变化值都有一定增加,表明细菌细胞膜受到损伤,这可能就是Sakasin LSJ618的抑菌作用发挥的第一步,这与很多其他细菌素的作用机理相似,但是能量化的藤黄微球菌对Sakasin LSJ618更加敏感,而鸡白痢沙门氏菌并无此现象,说明Sakasin LSJ618对革兰氏洋相细菌和革兰氏阴性细菌的作用机制有一定区别,有待进一步的研究.
〔1〕O'sullivan L,Ross R,Hill C.Potential of bacteriocin-producing lactic acid bacteria for improvements in food safety and quality[J].Biochimie,2002,84(5-6):593-604.
〔2〕姜洁,施波,方佳琪,等.清酒乳杆菌细菌素研究的现状及展望 [J].中国微生态学杂志,2011,23(3):268-271.
〔3〕Okorochenkov S A, Zheltukhina G A,Nebol'sin V E.Antimicrobial Peptides:the mode of action and perspectives of practical application. Biomedical Chemistry,2011,5(2):95-102.
〔4〕汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2001.51-54.
〔5〕钱丽红,陶妍,谢晶.茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理 [J].微生物学通报,2010,37(11):1628-1633.
〔6〕McAuliffe O,Ryan MP,Ross RP,et al.Lacticin 3147, a broadspectrum bacteriocin which selectively dissipates the membrane potential[J].Appl Environ Microbiol,1998,64(2):439-445.
〔7〕李丽,韩烨,周志江.乳酸片球菌素的抑菌方式[J].食品研究与开发,2009,30(5):181-185.
〔8〕Cherif A,Rezgui W,Raddadi N,et al.Characterization and partial purification of entomocin 110,a newly identified bacteriocin from Bacillus thuringiensis subsp. Entomocidus HD110[J].Microbiological Research,2008,163(6):684-692.

