江苏省淡水产品中主要弧菌菌群的RAPD分型
高 璐, 唐 伟, 杨振泉, 杭 莉, 高 崧, 方维明
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.扬州大学兽医学院,江苏 扬州 225009;3.泰州市出入境检验检疫局,江苏 泰州 225300;4.泰州市疾病预防控制中心,江苏 泰州 225300)
弧菌广泛存在于水产品中,现报道的共有200多种。其中,有12种对人体具有很强的致病性,可引起人体严重腹泻或者伤口感染、中耳炎及败血症等[1]。近年来,有关此类的食物中毒事件的案例不断增加,因而对消费者的健康构成潜在的威胁[2]。副溶血弧菌和溶藻弧菌是2种重要的致病菌种,通常认为他们是条件致病菌,是引起海洋鱼类和无脊椎动物大量死亡的主要原因,并且每年导致全世界水产养殖业大量的经济损失[3-6]。
微生物分型技术是进行食品中微生物检测和流行病学研究中必不可少的工具,但研究结果表明传统的血清分型、表型分型技术在环境和流行病学调查分析中具有局限性。分子分型方法以其高灵敏性、高分型率等优点被广泛应用于弧菌的分型和诊断中。随机扩增多态性DNA技术(Random amplified polymorphic DNA,RPAD)是以PCR为基础的分子标记技术,是Williams等[7]和 John 等[8]建立的一种新的揭示基因组多态性的方法,所需要的引物无需专门设计,模板DNA用量少,灵敏度高,已被广泛地应用于生物的遗传多样性和种群的遗传、分类及亲缘关系等研究。
本研究对从江苏省部分地区淡水产品中分离到的59株副溶血弧菌和107株溶藻弧菌的全基因组进行了RAPD分析,旨在探讨其种内各分离株间的亲缘关系和分子特性,为监测流行株、及时准确确立污染源、调查传播途径的研究提供依据,也为有效预防控制弧菌引起的腹泻及食物中毒事件提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 所用菌株均分离自江苏省连云港、扬州、泰州、常州地区的鱼、虾、蟹、贝等淡水产品,由扬州大学食品科学与工程学院发酵微生物实验室保存。
1.1.2 主要试剂与仪器 TCBS琼脂购于杭州微生物试剂有限公司;PCR所用生物试剂(10×Buffer、RNase、Taq 酶、dNTPs、DNA Marker)均为上海生工生物工程技术有限公司产品。
SPX-250-250B-Z型生化培养箱(购自上海博讯公司),PTC-100 PCR仪(购自美国MJ公司),DYY-8B型稳压稳流电泳仪(购自北京市六一仪器厂),TG16-WS型高速离心机(购自湘仪离心机仪器有限公司),GELDOCXR凝胶成像系统(购自BIO-RAD公司)。
1.2 弧菌基因组DNA提取
参照文献[9]和《精编分子生物学实验指南》的CTAB法提取弧菌分离株基因组DNA。
1.3 RAPD 扩增体系
参照文献[9],选取2条随机引物(AP11:5'-GGGAACGTGT-3';AP21:5'-AATCGGGCTG-3')进行随机多态性扩增试验。
RAPD扩增反应体系:模板(100 ng/μl)1.0 μl、dNTPs(10 mmol/L)0.5 μl、随 机 引 物 (10 pmol/μL)2.0 μl、10 × Buffer 2.5 μl、MgCl2(25 mmol/L)2.0 μl、Taq 酶 (5 U/μl)0.3 μl、ddH2O 15.7 μl,总体积 25.0 μl。
RAPD热循环参数:94℃ 3 min,36℃ 1 min,72℃ 2 min,1次循环;94℃ 1 min,36℃ 55 s,72℃ 2 min,35次循环;94 ℃ 1 min,36 ℃ 55 s,72 ℃ 10 min,1 次循环。
扩增产物的检测:取10.0 μl产物在1.2%的琼脂糖凝胶上进行电泳(电压5 V/cm)1.5 h,电泳结束后经溴化乙锭染色20 min,在凝胶成像系统上进行观察并拍照。根据条带清晰程度,弥散背景情况以及带型强弱选择图片进行分析。
1.4 RAPD重复性试验
取不同的分离株,每个菌株利用上述建立和优化的系统分别独立进行RAPD-PCR扩增3次,并分析扩增谱带的稳定性和重复性。
1.5 RAPD指纹图谱分析
电泳图中相同迁移位置上有条带的记1、无条带的记0,以1、0数列矩阵形式记录PCR产物的扩增位点。利用Popgene 32软件对数据进行分析,得出Nei's基因多样度、Shannon's信息指数、遗传相似度、遗传距离等数据,并根椐遗传距离利用Mega 4构建UPGMA系统进化树。
2 结果
2.1 RAPD扩增重复性试验
对于各分离株进行3次RAPD扩增,电泳结果如图1所示,3次扩增获得的指纹基本一致,显示指纹图谱具有较好的稳定性和可重复性。

图1 RAPD指纹图谱分型Fig.1 The repeated amplification of the isolates by RAPD
2.2 副溶血弧菌RAPD分型
应用RAPD分型方法对59株副溶血弧菌分离株进行分析,2种不同随机引物AP11、AP21的扩增谱带模式如图2所示。AP11扩增得到8个不同的指纹图谱(图2A),其中,菌株分布最集中的是1型、4型和 7型,所占的比例分别为32.8%(19/59)、25.4%(15/59)和 22.0%(13/59);AP21扩增得到7个不同的指纹图谱(图2B),其中,菌株分布最集中的是a型、c型和d型,所占的比例分别为39.0%(23/59)、27.1%(16/59)和15.3%(9/59)(表 1)。
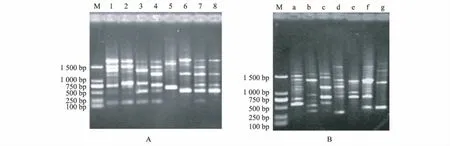
图2 副溶血弧菌RAPD谱带Fig.2 RAPD patterns of V.parahaemolyticus isolates
按照每个菌株的2种谱带模式组合进行基因分型,共获得了18个基因型别(表1),其中1a、4a、7d为主要型别,所占比例分别为 16.9%、15.3%、10.2%。根据分子指纹图谱计算Nei氏相似系数,通过UPGMA聚类分析,绘制系统进化树(图3)进一步表明,18个分子型在相似性80%的基础上可分为A至I 9个遗传谱系,其中A型和C型是副溶血弧菌的主要型别,属于A型的有17株分离株、C型的有19株,分别占总分离株的28.8%和32.2%,且A型和C型副溶血弧菌在所有采样地区和样品种类中均有检出(表2)。

图3 副溶血弧菌分离株的RAPD指纹图谱聚类分析图Fig.3 The clustering analysis of RAPD patterns of V.parahaemolyticus isolates

表2 副溶血弧菌在不同地区、样品中的分布Table 2 Distribution of different genotypes of V.parahaemolyticus isolates in four samples from all four areas
2.3 溶藻弧菌RAPD分型
应用随机引物AP11、AP21对107株溶藻弧菌分离株进行随机多态性扩增分析,不同随机引物的谱带扩增模式如图4所示。AP11扩增得到11个不同的指纹图谱(图4A),其中,菌株分布最集中的是1型、8型和10型,所占比例分别为29.0%(31/107),15.0%(16/107)和32.7%(35/107);AP21扩增得到6个不同的指纹图谱(图4B),其中,菌株分布最集中的是a型、c型和f型,所占比例分别为50.5%(54/107),19.6%(21/107)和16.8%(18/107)(表3)。

图4 溶藻弧菌RAPD谱带Fig.4 RAPD patterns of V.alginolyticus isolates
按照每个菌株的2种谱带模式组合进行基因分型,共获得了21个基因型别(表3),其中1a、8c、10a和10f为主要型别,所占比例分别为22.4%、13.1%、19.6和11.2%。根据分子指纹图谱计算Nei氏相似系数,通过UPGMA聚类分析,绘制系统进化树(图5)进一步表明,21个分子型在相似性80%的基础上可分为A至I 12个遗传谱系,其中A型是溶藻弧菌的最主要型别,含分离株50株,占总分离株的46.7%。溶藻弧菌的谱系A和K在所有采样地区和样品中均有检出(表4)。

表4 溶藻弧菌在不同地区、样品中的分布Table 4 Distribution of different genotypes of V.alginolyticus in four samples from all four areas

图5 溶藻弧菌分离株的RAPD指纹图谱聚类分析图Fig.5 The clustering analysis of RAPD patterns of V.alginolyticus isolates

表3 不同来源的溶藻弧菌分离株的RAPD分型结果Table 3 Results of RAPD genotyping differently-originated V.alginolyticus isolates
3 讨论
随着分子生物学技术的发展,在基因型方面的分子分型技术已经得到了广泛的应用。目前,弧菌中应用最多的是以脉冲凝胶电泳分析(PFGE)为首的分子分型方法,但是其分型成本高、操作费时而且技术复杂,不适用于大量样品的快速分型[10]。
RAPD技术具有个体、种群、亚种和种等各层次水平上的特异性,且操作简单,所需要引物不需要专门设计,适用于大量样品的快速分型,尤其是在疾病暴发流行时,它是分析相关菌株和排除不相关菌株的良好基础,已广泛应用于遗传多样性、分类及亲缘关系等领域的研究[11]。
本研究在我们已建立的副溶血弧菌RAPD分型技术的基础上,选取了AP11、AP21 2条随机引物,对不同来源的副溶血弧菌和溶藻弧菌进行分型,结果显示,AP11、AP21 2条引物将59株副溶血弧菌分为18个谱型,将107株溶藻弧菌分为21个谱型,显示了副溶血弧菌和溶藻弧菌均具有较好的基因多样性,这与Sudheesh等[12]的研究基本一致。
从弧菌的地理分布上看,连云港地区样品中分离到的副溶血弧菌和溶藻弧菌具有丰富的多态性,其谱带模式均多于扬州、泰州、常州地区样品中分离株。这可能与连云港所处的沿海地理位置相关,易与海产品发生相互交叉污染,或是沿海入口的生存环境(如盐度、温度等)更易于弧菌的生长,我们前期的研究也发现连云港地区样品中弧菌的多样性比扬州、泰州、常州地区丰富[13]。
从弧菌的样品来源上看,在鱼、蟹和虾这3类样品中,副溶血弧菌和溶藻弧菌均显示了较好的多态性,鱼和虾样品中分离株的指纹谱带模式较为接近,而在贝类样品中的指纹图谱谱带比较单一,这可能与这些水生动物的生活习性有关,也可能与我们样品数量有限所致。因而,我们仍需进一步的研究以了解他们之间的相关性。对这些不同地区不同样品的主要携带型别进行深入的研究,将为水产品中污染源的溯源及水产养殖中疾病传染的控制提供重要的依据。
[1]HOLT J G,KRIEG N R,SNEATH P H,et al.Bergey’s manual of determinative bacteriology[M].9th ed.Philadelphia:Williams& Wilkins,1994.
[2]MARTHA I,TRACY A,BARBARA E,et al.Infections in the United States Epidemiology of seafood-associated[J].Clinical Microbiology Reviews,2010,23(2):399-411.
[3]LIGHTNER D V.Vibrio disease in penaeid shrimp[M]//SINDERMAN C J,LIGHTNER D V.Disease diagnosis and control in North American marine aquaculture.Elsevier:Amsterdam,1988:42-47.
[4]CHEN C,WANG Q B,LIU Z H,et al.Characterization of role of the toxR gene in the physiology and pathogenicity of Vibrio alginolyticus[J].Antonie Van Leeuwenhoek,2012,101(2):281-288.
[5]马月姣,孙晓红,赵 勇,等.不同样品副溶血性弧菌多样性分析[J].江苏农业科学,2012,40(12):37-41.
[6]张 毅,王爱华,王贵春.EMA-LAMP方法快速检测食源性副溶血性弧菌活细胞[J].江苏农业科学,2012,40(10):290-292.
[7]WILLIAMS J G,KUBELIK A R,LIVAK K J,et al.DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J].Nucl Acids Res,1990,18:6531-6535.
[8]JOHN W E,MICHAEL M C.Fingerprinting genomes using PCR with arbitrary primers[J].Oxford Journals Life Sciences Nucleic Acids Research,1990,18(24):7213-7218.
[9]YANG Z Q,JIAO X A,ZHOU X H,et al.Isolation and molecular characterization of Vibrio parahaemolyticus from fresh,low-temperature preserved,dried,and salted seafood products in two coastal areas of eastern China[J].International Journal of Food Microbiology,2008,125(3):279-285.
[10]江 晓,任春华,胡超群.分子分型技术在弧菌研究中的应用进展[J].海洋科学进展,2010,28(4):563-568.
[11]NILIMA P M,BASANTA K D,JVOTIRMAVEE P,et al.RAPDPCR and outer membrane protein characterization of Vibrio alginolyticus and Vibrio parahaemolyticus isolated from diseased shrimp[J].The Israeli Journal of Aquaculture-Bamidgeh,2012,64:1-8.
[12]SUDHEESH P S,KONG J,XU H S.Random amplified polymorphic DNA-PCR typing of Vibrio parahaemolyticus and V.alginolyticus isolated from cultured shrimps[J].Aquaculture,2002,207:11-17.
[13]高 璐,杭 莉,杨振泉,等.江苏省部分地区淡水产品中弧菌菌群及其致病性分析[J].人兽共患病学报,2013,29(2):142-147.

