毕赤酵母表达人溶菌酶基因的初步研究
王安平, 朱善元, 王永娟, 吴 双, 左伟勇, 洪伟鸣
(江苏畜牧兽医职业技术学院,江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
溶菌酶(LYZ)是1922年由英国科学家Fleming首先在人的唾沫、眼泪和鼻涕中发现的,因其可使细菌细胞壁溶解而得名[1]。它能切断肽聚糖中N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键的联结,破坏肽聚糖支架,在内部渗透压的作用下细胞胀裂开,引起细菌裂解,有些革兰氏阴性菌也会受到溶菌酶的破坏。人和动物细胞无细胞壁结构亦无肽聚糖,故溶菌酶对人体细胞无毒性作用[2]。
人溶菌酶(hLYZ)属于c型溶菌酶,即鸡卵清溶菌酶(cLYZ),由130个氨基酸残基组成,相对分子质量为14 700。参与机体的防御机制,有抗感染、抗肿瘤和免疫调节的作用,具有潜在的临床应用价值[3]。通常人溶菌酶是从人乳或胎盘中少量提取,由于来源困难,提取方法复杂,不能进行大规模工业化生产。采取DNA重组技术,从原核或真核表达系统生产人溶菌酶是解决其供需矛盾的有效途径。毕赤酵母是目前最为成熟的真核表达系统之一,迄今为止已成功地表达了100多种外源蛋白质[4]。本研究通过基因工程手段,利用毕赤酵母系统表达具有生物活性且易于纯化的人溶菌酶,为人溶菌酶的规模化开发应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种和载体 含人溶菌酶基因的真核表达质粒p215C3-LYZ、酵母表达载体pPIC9K和酵母株GS115由本实验室保存;大肠杆菌TOP10感受态细胞由本实验室制备和保存;微球菌由扬州大学医学院微生物教研组提供。
1.1.2 酶和试剂 Prime STAR HS DNA高保真聚合酶、限制性内切酶EcoRⅠ、NotⅠ及DNA连接酶购自大连宝生物公司;Wizard DNA纯化试剂盒购自美国Promega公司;氨基糖甙类抗生素G418购自Americo公司;hLYZ单抗购自Abcam公司;其他试剂均为国产分析纯级。
1.1.3 PCR引物合成 根据已发表的hLYZ(NM_000239)基因序列设计1对引物,并在其两端分别引入EcoRⅠ、NotⅠ酶切位点,其序列分别为:正向引物5'-GGTGAATTCAAGGTCTTTGAAAGGTGTG-3'和反向引物5'-GTTGCGGCCGCCACTCCACAACCTTGAACA-3'。引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 hLYZ基因的获得 以本实验室保存的含人溶菌酶基因的重组质粒p215C3-LYZ为模板扩增人溶菌酶基因。反应条件为:95℃预变性3 min;95℃变性30 s,54 ℃退火30 s,72 ℃延伸 1 min,反应进行30个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分离后,按Wizard DNA Clean-up System试剂盒说明书进行纯化回收目的基因。
1.2.2 毕赤酵母重组表达载体的构建 用限制性内切酶EcoR I和NotⅠ酶切回收的PCR产物,经凝胶电泳分离和回收后,与用同样酶切线性化的毕赤酵母表达载体pPIC9K连接。连接产物转化E.coli TOP10感受态细胞,在含100 μg/ml氨苄青霉素的LB琼脂平板上37℃培养过夜后,挑取单菌落,提取质粒电泳筛选,并进行酶切鉴定。酶切鉴定正确后送由上海生工公司测序。
1.2.3 毕赤酵母宿主菌电转化 用SacⅠ酶切线性化pPIC9K-LYZ质粒,纯化回收并将其浓度调整为 1 μg/μl。将 10 μl pPIC9K-LYZ 与 80 μl GS115感受态细胞混合,1 500 V电击5 ms;电击后酵母细胞涂布于MD平板上,30℃静置培养2~3 d,直至长出白色菌落。
1.2.4 重组酵母菌株高拷贝转化子的筛选及甲醇利用型鉴定 无菌条件下,用96孔细胞培养板对阳性克隆进行连续传代,使细胞浓度达到一致,充分悬浮细胞,用微量移液器吸取5 μl细胞悬液分别滴加于含 0.25 mg/ml、0.50 mg/ml、0.75 mg/ml、1.00 mg/ml、1.50 mg/ml、2.00 mg/ml、3.00 mg/ml、4.00 mg/ml G418的YPD平板,30℃静置培养2~5 d,筛选得到高拷贝克隆子。将筛选到的高拷贝克隆子分别接种MD和MM平板,30℃静置培养3 d,如果两种平板上均生长良好,则为Mut+型转化菌,仅MD板上生长良好而MM板上生长较差的为Muts型转化菌。
1.2.5 PCR检测hLYZ基因与毕赤酵母染色体基因组的整合 按照Invitrogen公司提供的方法,提取高拷贝重组毕赤酵母菌总DNA,以通用引物5'-AOX和3'-AOX PCR法检测hLYZ基因与毕赤酵母染色体基因组的整合,以pPIC9K空质粒转化的毕赤酵母菌作阴性对照。
1.2.6 重组酵母菌株的诱导表达 取少量甘油保存的高拷贝GS115转化子接种于5 ml YPD培养基中,200 r/min转速30℃培养过夜;按1∶100的比例接种于BMGY培养基,200 r/min 30℃培养24 h;室温下3 000 g离心5 min,收获细胞沉淀,用1/4体积含0.5%甲醇的BMMY培养基诱导表达,为了增加通气量,用纱布封口。每隔24 h取上清以备分析,并添加甲醇至终浓度为0.5%继续诱导。
1.2.7 重组蛋白质的SDS-PAGE和Western blot鉴定 将高拷贝重组酵母菌株的诱导上清,用真空抽干机浓缩10倍,取10 μl作为样品,与上样缓冲液混合均匀,40℃孵育30 min,再60℃孵育10 min,最后煮沸2 min。电泳条件为:恒压电泳,先40 V 1 h,当样品进入分离胶时,电压升至60 V约3 h。电泳完毕时,胶置于染色液中振荡染色1.5~2.0 h,转至脱色液中扩散脱色,直到背景清晰。
1.2.8 重组蛋白质抑菌活性测定 抑菌活性测定采用管碟法:取处于对数生长期的微球菌菌液15 μl稀释于 150 μl灭菌水中,均匀涂布于 LB 琼脂板表面,将直径6 mm的无菌不锈钢小管放在平板表面,于管内滴加样品100 μl,以同体积的空载体pPIC9K转化子的诱导上清为阴性对照,溶菌酶标准品为阳性对照,放置于37℃恒温箱中,培养18 h后观察结果。
2 结果
2.1 表达载体pPIC9K-LYZ的构建与鉴定
以重组质粒p215C3-LYZ为模板扩增出大小约400 bp左右的条带,琼脂糖凝胶电泳回收后,用EcoRⅠ及 NotⅠ进行酶切,与经同样双酶切的pPIC9K连接,获得酵母表达重组载体pPIC9K-LYZ。Pst I酶切鉴定正确(图1),并且DNA测序证明LYZ基因克隆正确无突变。

图1 酵母表达载体pPIC9K-LYZ酶切鉴定Fig.1 Identification of yeast expression vector pPIC9K-LYZ by endonuclease digestion
2.2 重组酵母菌株的筛选与鉴定
将pPIC9K-LYZ转化的酵母菌重组菌在MD平板上培养,挑取单菌落接种于含YPD培养液的96孔板,3次传代培养使细胞密度均匀一致,然后用含不同浓度G418的YPD平板筛选高拷贝转化子,并用MD和MM平板鉴定其甲醇利用型,结果获得抗4 mg/ml G418的高拷贝转化子5株,且皆为Muts表型。以高拷贝重组毕赤酵母GS115/pPIC9K-hLYZ基因组为模板的PCR扩增产物经0.8%琼脂糖凝胶电泳分析,可见1条大小约900 bp的条带,而以重组毕赤酵母GS115/pPIC9K为模板的PCR产物未扩增出目的条带(图2),说明hLYZ基因已经整合入GS115基因组中。

图2 重组毕赤酵母GS115/pPIC9K-hLYZ的PCR鉴定Fig.2 Identification of recombinant Pichia pastoris GS115/pPIC9K-hLYZ by PCR
2.3 重组蛋白质hLYZ在毕赤酵母中的分泌表达
取0.5%甲醇诱导72 h的Muts型酵母菌表达上清浓缩10倍,取10 μl进行SDS-PAGE电泳分析,银染后检测到特异表达条带,大小约为1.44×104,与理论值相符(图3),说明重组蛋白质hLYZ在毕赤酵母中成功表达。

图3 重组蛋白质hLYZ的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the recombinant protein
2.4 重组蛋白质hLYZ的抗菌活性
利用管碟法测定了诱导上清对溶壁微球菌的抑菌作用,结果显示重组蛋白质hLYZ及溶菌酶标准品对溶壁微球菌均具有良好的抑菌效果,而空载体pPIC9K转化子的诱导上清则没有抑菌作用(图4)。
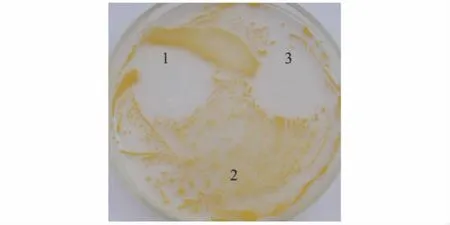
图4 重组蛋白质hLYZ抑菌活性测定Fig.4 Antibacterial assay of the recombinant protein hLYZ
3 讨论
随着人们对“无毒、无残留、无耐药性”新一代抗菌物质的认识,溶菌酶已成为研究热点。溶菌酶广泛存在于自然界动物、植物和微生物中。人们主要从鸡蛋清中提取此酶。人溶菌酶(hLYZ)属于c型溶菌酶,主要用于临床治疗,具有抗菌和抗肿瘤的作用。通常人溶菌酶是从人乳或胎盘中少量提取,由于来源少,提取方法复杂,不能进行大规模工业化生产[5-6]。
随着基因工程技术的成熟,通过重组技术表达外源蛋白质成为可能。毕赤酵母表达系统是目前应用较为广泛的第二代真核表达系统,该系统表达外源蛋白质具有基因操作简单、外源蛋白质能正确加工与修饰、表达量高、易大量发酵培养、易纯化等优点。毕赤酵母表达系统已成功表达多种外源蛋白质[7-11],有些外源蛋白质如人血清白蛋白的表达量可达较高水平[12-13]。
本研究采用毕赤酵母表达系统,成功地分泌表达了具有抗菌活性的重组蛋白质hLYZ,SDS-PAGE试验结果表明表达的重组蛋白质分子量正确,抑菌试验进一步证实hLYZ具有良好的杀菌活性,为其大量生产从而开发新型抗菌药物奠定了一定的基础。但有关hLYZ表达水平、抗菌效力及作用机理等还需要进一步研究。
[1]FLEMING A.On a remarkable bacteriolytic element found in tissues and secretions[J].Proc R Soc London B Biol Sci,1922,93:306-317.
[2]孙怀昌,张 泉,施伟庆,等.人溶菌酶cDNA的克隆及其在小鼠体内的表达[J].中国兽医学报,2004,2(24):157.
[3]叶 军,钱世钧.工程菌人溶菌酶的纯化和性质[J].微生物学报,1999,39(1):55-59.
[4]CEREGHINO J L,CREGG J M.Heterologous protein expression in the methylot rophic yeast Pichia pastoris[J].FEMS Microbiol Rev,2000,24:45-66.
[5]HUANG B,ZHAO C,LEI X,et al.The cloning,sequencing and analysis of Chinese human lysozyme gene cDNA amplified with RT-PCR from human placental total RNA[J].Chin Biochem J,1993,9:269-273.
[6]CASTANON M J,SPEVAK W ,ADOLF G R,et al.Cloning of human lysozyme gene and expression in the yeast Saccharomyces cerevisiae[J].Gene,1988,66:223-234.
[7]姚 晶,吴正钧,任 婧.奶牛 β-1,4-半乳糖基转移酶基因在毕赤酵母GS115中的转化表达及发酵优化[J].江苏农业学报,2012,28(6):1367-1372.
[8]姚 晶,吴正钧,任 婧.巴氏毕赤酵母表达系统的研究进展[J].江苏农业科学,2012,40(3):35-38.
[9]王安平,李哲峰,朱善元,等.牛气管抗菌肽在毕赤酵母中的表达与鉴定[J].江苏农业学报,2011,27(6):1316-1320.
[10]王 东,李海军.高剑峰小鼠CCL2基因毕赤酵母表达载体的构建及鉴定[J].江苏农业科学,2011,39(4):33-35.
[11]俞咪娜,邓 晟,王 颖,等.寄生疫霉ParA1蛋白在毕赤酵母中的表达[J].江苏农业科学,2011,39(1):48-51.
[12]JAHIC M,GUSTAVSSON M,JANSEN A K,et al.Analysis and control of proteolysis of a fusion protein in Pichia pastoris fed-batch processes[J].Biotechnol,2003,102(1):45-53.
[13]MASUDA T,UENO Y,KITABATAKE N.High yield secretion of the sweet-tasting protein lysozyme from the yeast Pichia pastoris[J].Protein Expression& Purification,2005,39(3):35-38.

