氮磷营养限制影响三角褐指藻光合无机碳利用和碳酸酐酶活性
李小梅 夏建荣
(广州大学环境科学与工程学院, 广州 510006)
海洋硅藻是海洋初级生产力的重要组成部分,其固碳量可以达到海洋初级生产力的 40%[1]。海洋硅藻也与高等植物一样利用核酮糖-1, 5-二磷酸羧化酶/氧化酶(Rubisco)固定 CO2。海洋藻类 Rubisco的Km(CO2)约为 40—60 µmol/L[2], 但实际海水中CO2浓度只有约 10 µmol/L(pH 8.0, 20℃), 因此海水中 CO2可能成为海洋硅藻光合固碳的限制因子, 但海洋硅藻的大部分种类均具有无机碳浓缩机制(CO2Concentrating Mechanism, CCM), 即通过 HCO3−的主动转运和碳酸酐酶(Carbonic anhydrase) 调控HCO3−和 CO2的相互转化, 在核酮糖-1, 5-二磷酸羧化酶/氧化酶周围提高CO2浓度, 以维持较高的光合效率[3]。随着大量污染物排入海洋, 海水中氮磷浓度出现了不同程度的升高[4], 使氮磷比明显高于或低于Redfield比率(N∶P≈16), 导致浮游植物无法达到最适生长, 而处于营养(氮磷)限制状态[5]。利用人工海水在实验室探讨海洋藻类生长与氮磷比关系, 结果显示两者具有明显的相关性[6—8]。在近海自然海区浮游植物初级生产力与氮磷比关系研究中发现具有类似的结果[9]。氮磷比除了影响浮游植物的生长,还对其光合作用产生明显的影响, 如氮限制可以导致细胞内色素(特别是叶绿素)含量的减少、光系统I、II反应中心蛋白合成受阻而影响能量的转换效率[10];氮限制也明显降低 Rubisco活性与含量[11]。而磷限制可通过改变ATP/ADP的比例和降低Rubisco活性以影响卡尔文循环[12,13]。但氮磷限制对海洋浮游植物无机碳利用机制与碳酸酐酶活性影响还鲜有报道。本文利用海洋浮游硅藻三角褐指藻作为实验材料, 在不同氮磷比人工海水中培养, 探讨三角褐指藻如何通过调控光合无机碳利用和碳酸酐酶活性以适应营养限制环境。
1 材料与方法
三角褐指藻(Phaeodactylum tricornutumBohlin)购自中国科学院海洋研究所, 藻种用 f/2加富的人工海水进行培养, 培养条件为: 光强200 µmol photons/(m2·s), 温度 20℃, 光暗周期 12∶12, 通过滤空气, 培养至对数期离心收获, 用于不同氮磷比实验。在人工海水配制过中加入不同量的无机氮磷, 分别达到表1设置的浓度与N∶P。

表1 氮磷营养限制实验中的N、P浓度和N∶P设置Tab.1 N, P concentrations and N/P ratios under N or P-limited experiments
采用半连续培养, 每天照光前将藻离心收获,更换新鲜培养液, 细胞起始密度维持在(1.5—2.0)×106/mL, 培养条件同上, 培养5—6d后, 用于实验。
1.1 生长测定
在培养第 5天, 分别在光照开始和光照12h后通过血球计数板对细胞进行计数, 半连续培养生长速率按以下公式计算:

X2和X1分别为光照后和光照前细胞密度,t2和t1分别为当天光照结束与光照起始的时间。
1.2 叶绿素含量测定
在 4℃下用90%丙酮抽提 12h, 分别于 630 nm和664 nm处测其光密度值(OD值), 通过以下公式计算叶绿素含量[14]。

1.3 光合作用光响应曲线(P-I曲线)
取半连续培养5d后的藻, 重悬于新鲜的f/2加富的人工海水中, 取5 mL加入反应槽中, 用恒温水浴槽控制温度在 20℃, 光合放氧速率用生物氧测定仪(5300A, YSI)测定, 用卤钨灯照光, 通过调节卤钨灯与反应槽的距离获得不同光强。用下列公式对P-I曲线进行非线性拟合[15]:
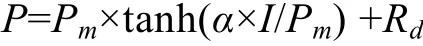
其中I为光照强度;P是光照强度I时所对应的光合速率;Pm为光饱和光合速率;α是光合作用在光限制部分的初始斜率, 表示光合效率;Rd为暗呼吸速率。
1.4 光合作用无机碳响应曲线(P-C曲线)
半连续培养5d后的藻悬浮于pH 8.2的25 mmol/L Tris缓冲液中, 取 4 mL加入反应槽, 在温度 20℃,光强为 400 µmol photons/(m2·s)条件下, 用 YSI氧电极测定光合放氧速率。当反应槽中藻细胞光合放氧速率为0时(无机碳补偿点), 注入NaHCO3溶液得到反应体系中的可溶性无机碳(DIC)浓度梯度, 得到光合放氧速率对DIC浓度的响应曲线(P-C曲线)。用下列公式对P-C曲线进行非线性拟合:

其中V为光合放氧速率,Vmax为最大光合放氧速率;[DIC]为反应介质中总无机碳浓度;K0.5是当光合放氧速率达到最大光合速率一半时对应的无机碳浓度。
1.5 pH-drift 测定
将半连续培养的藻细胞收获, 重新悬浮于新鲜的 f/2加富的人工海水中, 封闭, 在光强 200 µmol photons/(m2·s), 温度 20℃下, 连续光照, 每隔一定时间测定培养液中的pH, 至稳定为止。
1.6 质膜氧化还原活性测定
通过测定完整藻细胞对 K3Fe(CN)6的还原作用确定质膜的氧化还原活性[16]。测定时将细胞悬浮于新鲜培养液中, 加入K3Fe(CN)6, 使培养液中K3Fe(CN)6的初始反应浓度为0.50 mmol/L, 每隔30min取5 mL藻液离心, 取上清液测定其在420 nm处的吸光度。
1.7 碳酸酐酶活性测定
采用Willbur和Anderson方法测定胞内、外碳酸酐酶活性[17]。离心收集藻细胞, 悬浮于8 mL pH 8.3巴比妥缓冲液中。在 4℃下迅速加入 4 mL 4℃CO2饱和水, 用 pH计监测反应体系中 pH变化, 记录pH从8.3降至7.3所需的时间。碳酸酐酶活性(U)的计算公式为:EU=10×(T0/T−1), 其中T0为反应体系中未加藻细胞时pH下降所需的时间,T为反应体系中加藻细胞时 pH下降所需的时间。胞外和总碳酸酐酶活性分别通过测定整个细胞和细胞经超声破碎后的碳酸酐酶活性获得。碳酸酐酶活性单位(以单位细胞计)为EU/cell。胞内碳酸酐酶活性=总碳酸酐酶活性−胞外碳酸酐酶活性。
1.8 数据处理
实验数据以平均值±标准偏差表示。数据利用方差分析及多重比较进行分析, 并用星号“*”表示处理之间的差异显著性水平(P<0.05)。
2 结果
2.1 不同N∶P对三角褐指藻生长的影响
不同N∶P下半连续培养5d后三角褐指藻的生长速率(图1), 在N∶P=16∶1的人工海水培养下三角褐指藻的生长速率最大, 约为0.8/d, 其余4种氮磷比培养下生长速率均明显下降(P<0.05), 表明高于或低于 N∶P=16∶1时, 三角褐指藻的生长明显受到氮磷营养的限制, 其中严重的氮限制(N∶P=1∶1)使生长速率降低 75%, 严重的磷限制(N∶P=256∶1)则导致光照 12h后细胞数目比起始光照时明显下降, 表明三角褐指藻的生长对严重磷限制比严重氮限制更敏感。

图1 不同N∶P培养下三角褐指藻的生长速率Fig.1 Growth rate in P.tricornutum grown under the varied nutrient levels
2.2 不同N∶P对三角褐指藻叶绿素含量的影响
在不同氮磷水平培养下, 叶绿素a含量在(0.57—1.19)×10−7μg/cell 之间, 叶绿素c含量在(0.10—0.21)×10−7μg/cell(图 2)。氮限制(N∶P = 4∶1 或 1∶1)导致叶绿素a含量分别下降 30.1% 和 47.6%(P<0.05), 磷限制(N∶P = 64∶1或 256∶1)下降39.1% 和52.4%(P<0.05), 但氮磷限制对叶绿素c含量没有明显影响(P>0.05)。
2.3 不同N∶P对三角褐指藻pH漂移曲线的影响
适应不同 N∶P下生长的细胞再在封闭系统中培养, 培养过程中 pH变化(图 3), 随着培养时间的延长, pH逐渐升高, 营养充足条件下(N∶P =16∶1)培养的细胞pH达到稳定时(即pH补偿点)接近9.9。氮磷限制培养的细胞pH补偿点明显下降(P< 0.05)

图2 不同氮磷比对三角褐指藻叶绿素含量的影响Fig.2 Effects of N∶P ratios on chlorophyll content in P.tricornutum

图3 不同营养水平培养的三角褐指藻的pH漂移曲线Fig.3 pH-drift curves in P.tricornutum grown under the different nutrient levels
2.4 不同N∶P对三角褐指藻P-I曲线的影响
光合作用光反应曲线经常用于测定藻类的光适应能力, 从图4和表2可以看出不同营养水平培养对光饱和光合速率具有明显的影响(P<0.05), 与营养充足培养相比, 在严重氮磷限制(N∶P=1∶1或256∶1)培养下光饱和光合速率分别下降39.7%和48.0%。光合效率(α)变化范围在 4.0—7.3 µmol O2/(cell⋅h)×10−10/µmol photons/(m2⋅s), 氮磷营养限制培养下藻细胞α值明显下降(P<0.05)。不同营养水平处理的细胞暗呼吸速率也明显不同, 氮磷限制培养明显低于营养充足培养(P<0.05)。
2.5 不同N∶P对三角褐指藻P-C曲线的影响
在光合作用与无机碳浓度响应曲线中(图5、表3), 随着反应液中无机碳浓度的升高, 光合速率均明显增加, 但不同营养水平培养的细胞光合速率的变化存在一定差异, 氮磷限制导致最大光合速率下降28.7%和38.7%(P<0.05)。但达到最大光合速率一半时的CO2浓度在磷限制下下降了30%, 但氮限制并没有明显影响, 表明磷限制有助于提高细胞对CO2的亲和力。

图4 不同氮磷比培养的三角褐指藻的P-I曲线Fig.4 Photosynthesis-light response curves in P.tricornutumgrown under the medium with different N∶P

表2 不同营养水平培养下P-I曲线参数Tab.2 The parameters of P-I curves in P. tricornutum grown under the medium of different N∶P

图5 不同氮磷比培养的三角褐指藻的P-C曲线Fig.5 P-C curves of P.tricornutum grown under the medium with different N∶P
2.6 不同N∶P对三角褐指藻质膜氧化还原活性的影响
胞外碳酸酐酶活性经常受到质膜氧化还原活性的影响, 利用 K3Fe(CN)6的浓度变化可以测定质膜氧化还原活性。图6显示不同营养水平培养的细胞具有明显不同的 K3Fe(CN)6氧化还原速率, 营养充足培养细胞反应液中Fe(CN)63−下降速率更快, 表明在氮磷限制环境中生长的藻细胞质膜氧化还原能力明显低于营养充足条件下生长的细胞。
2.7 在不同N∶P培养下三角褐指藻碳酸酐酶活性的变化
不同营养水平培养对三角褐指藻碳酸酐酶活性的影响(图7), 在不同营养水平培养下碳酸酐酶的活性明显不同, 胞外碳酸酐酶的活性变化范围在(0.76—1.52)×10−7EU/cell, 胞内碳酸酐酶活性明显低于胞外活性, 在(0.36—0.63)×10−7EU/cell。氮磷限制导致胞内外碳酸酐酶活性明显下降(P<0.05), 其中在氮限制下胞外碳酸酐酶活性分别下降 50%和37.5%, 在磷限制下下降22.3%和42.1%。严重的氮(N∶P=1∶1)或磷(N∶P=256∶1)限制导致胞内碳酸酐酶活性下降36.5%和42.9%。

表3 不同N∶P培养下三角褐指藻P-C曲线的各参数Tab.3 The parameters of P-C in P.tricornutum grown under the different N∶P

图6 不同氮磷比培养对质膜氧化还原活性的影响Fig.6 The variation of plasma membrane redox activity in P.tricornutum grown under the medium with different N∶P

图7 不同氮磷比培养对碳酸酐酶活性的影响Fig.7 Impacts of different N∶P on carbonic anhydrase activity in P.tricornutum
3 讨论
3.1 氮磷限制对三角褐指藻生长与光合作用的影响
海洋浮游植物细胞内氮磷元素的比例通常约为16∶1, 所以该比例常被用来作为判断海洋浮游植物最适生长是否受到营养限制(氮磷限制)的指标[18]。但不同浮游植物对营养盐的需求也存在一定差异,其最适生长所需的N∶P也存在一定的变化。Ho和Hodgkiss通过对香港海域赤潮藻类初级生产力的研究发现, 它们最适生长所需的N∶P在4—16[19]。本研究结果显示在N∶P=16∶1时生长速率明显高于N∶P比大于 16∶1(N∶P=64∶1或 256∶1)或小于 16∶1(N∶P= 4∶1或 1∶1), 表明三角褐指藻在 N∶P=4∶1或1∶1的培养液中存在明显的氮限制, 在N∶P=64∶1或256∶1培养液中存在明显的磷限制。植物对氮磷限制的响应主要表现为: (1)促进营养盐的吸收和同化; (2)减少生长与代谢速率以平衡细胞内资源的有效利用[20,21]。在本研究中所使用的 N∶P比范围内, 三角褐指藻细胞明显采用第二种策略适应营养限制的环境, 表明在氮磷限制的环境中, 细胞已不足以恢复其最适生长, 但可以通过细胞生理活性的下调来维持适度的生长[20]。生长速率的降低也伴随着叶绿素a含量的降低, 在营养限制环境中,原核与真核藻类色素含量的降低是一种常见现象,其原因可能在于氮是叶绿素a合成的原料, 氮限制可以导致叶绿素a的合成受限, 但氮磷限制对叶绿素c含量并没有明显影响, 表明氮磷限制并不影响藻细胞对光能的捕获, 但对光能的吸收和利用能力降低, 营养物质可能更多地流向其他代谢过程, 而对叶绿素a合成上的投入减少。
石岩峻等的研究表明不同氮磷水平对微小原甲藻光合特性具有明显影响[22], Geider,et al.也发现营养限制下光饱和光合速率存在明显的下降[11]。三角褐指藻细胞在氮磷限制条件下光饱和光合速率变化与之相似。光饱和光合速率大小与无机碳的获取、细胞内 Rubisco活性和含量密切相关[15]。在氮限制下生长的莱茵衣藻光合蛋白的合成速率明显降低[23]。大型海藻(Gracilaria secundata)在氮限制培养下Rubisco含量下降了 50%[24]。有关维管束植物的研究表明饱和光合速率也受到 Rubisco 的底物核酮糖二磷酸再生速率的影响, 核酮糖二磷酸再生速率受到光合作用产物的反馈限制。磷酸盐可以作为卡尔文循环和光合作用光反应的一种底物信号影响在Rubisco激活过程中Rubisco激活位点与非底物CO2的稳定结合而增加这种反馈限制[13,25]。光合效率(α)与光捕获效率和光合作用光能转换效率密切相关,在本研究中营养限制并没有导致光能捕获色素叶绿素c含量的变化, 表明在营养限制环境中, 光合效率的降低应与光合作用光能的转换效率有关, 这与营养限制条件下叶绿素a含量的下降是一致的, 同时光合效率的变化也与光饱和光合速率的变化是一致的。而在营养限制环境中藻细胞暗呼吸速率的降低可能与呼吸作用相关酶的合成减少和活性降低有关。
3.2 氮磷限制对三角褐指藻无机碳利用与碳酸酐酶的影响
pH 补偿点常用来表示藻类利用 HCO3−的能力,pH补偿点高于 9.2时被认为藻类具有直接利用HCO3−的能力[26], 本研究结果显示在实验所设置的营养水平范围内三角褐指藻 pH补偿点均高于 9.2,但在营养限制条件下 pH的补偿点下降, 表明三角褐指藻在营养限制条件下还能直接利用 HCO3−, 但HCO3−的利用能力与营养充足培养的相比有所下降,这可能与氮磷限制环境中 HCO3−的主动转运所需能量(ATP)和载体蛋白合成减少有关。硝酸盐还原与CO2固定需要消耗光合作用所产生的同化力, 碳氮的固定需要分享光合作用电子传递过程中产生的能量, 同时从无机氮合成氨基酸也需要细胞的碳骨架[27],因此氮代谢与光合无机碳利用过程是密切相关的。在微藻中 Rubisco和 CA合成所需的氮源需求的理论估计表明 CCM 活性的增加可能影响氮的利用效率[28]。氮限制导致小球藻(Chlorella emersonii)和盐藻(Dunaliella tertiolecta)对无机碳的亲和力明显增加[28,29]; 但 Hu 和 Zhou的研究显示, 在氮浓度达到300 µmol/L时对无机碳的亲和力最大, 高于或低于这个浓度其对无机碳亲和力均明显下降[30]。我们的研究结果显示在轻微的N限制(N∶P = 4∶1)下藻细胞对无机碳亲和力并没有明显的影响, 表明氮浓度对藻类 CCM 的影响可能与藻的种类或与氮限制程度有关。小球藻(C.emersonii) 在磷限制环境中CCM 的活性受到部分抑制[31], 但在藻类C.vulgaris[32]和Nannochloropsissp.[30]中结果正好相反,我们的结果与后者相似。无机磷在细胞能量的传递过程中起着非常重要的作用, 由于无机碳的主动转运过程需要ATP提供能量, 因此在磷限制环境中无机碳转运可能受到抑制。同时, 在磷限制环境中细胞光合作用产生的大量糖类可以黏附在细胞表面,阻止 CO2扩散进入细胞内[33], 从而可能导致细胞对无机碳的亲和力明显增加。
除了 HCO3−的直接转运, 三角褐指藻还可以通过CO2的扩散和胞外CA催化海水中HCO3−转化为CO2, 后者通过自由扩散进入细胞内, 以维持胞内CO2的供应, 其中碳酸酐酶在调控细胞CCM机制方面具有重要作用。夏建荣等的研究表明在低氮磷浓度下小新月菱形藻胞内外 CA活性明显降低[34], 本研究结果显示氮磷限制明显抑制三角褐指藻胞内外碳酸酐酶活性与之相似, 但 Kozlowska-Szerenos,et al.发现磷限制导致小球藻(C.vulgaris)胞内外碳酸酐酶的活性均有所增加[35], 这可能与其碳酸酐酶的活性单位以单位叶绿素含量或细胞密度不同表示有关, 在营养限制条件下叶绿素含量降低, 导致以单位叶绿素含量为单位的碳酸酐酶活性增加。Beardall,et al.的研究发现氮限制导致小球藻细胞具有较低CO2补偿点和较高浓度的细胞内 CO2池, 同时减少氮在 Rubisco合成上的投入[36]。低氮磷浓度也明显降低盐藻Rubisco的合成量[11]。Majeau 和Coleman证实了Rubisco和CA基因表达存在一定的协同性[37],在光合固碳过程中 Rubisco和 CA维持一定的比例是非常重要的, 因此为了维持正常的光合效率, 在低氮磷环境中CA合成量也可能下降, CA的合成量减少也可使酶活性降低。另一方面, 胞外 CA活性的变化也受到质膜氧化还原状态的调节, 我们的研究结果证实在氮磷营养充足的条件下, 细胞质膜氧化还原的活性明显高于氮磷营养限制培养的细胞,从而有利于启动质膜上的氧化还原链, 导致质子逸出, 在胞外 CA活性位点周围聚集, 从而激活胞外CA活性[38], 所以在营养充足培养下三角褐指藻细胞与营养限制培养相比具有较高的胞外CA活性。
4 结论
三角褐指藻在 N∶P=16∶1的培养液中生长速率最大, 氮磷限制导致三角褐指藻生长速率明显下降并伴随叶绿素a含量的下降, 但对叶绿素c含量并没有明显影响。氮磷限制明显地降低光饱和光合速率、光合效率和暗呼吸速率。
三角褐指藻在氮磷限制环境中 pH补偿点明显下降, 磷限制有利于藻细胞提高对无机碳的亲和力,但氮限制并没有明显影响。氮磷限制导致藻细胞质膜氧化还原活性和胞内外碳酸酐酶活性下降。三角褐指藻在氮磷限制的环境中通过调节叶绿素含量、无机碳利用方式和碳酸酐酶活性以维持适度的生长。
[1] Granum E, Raven J A, Leegood R C.How do marine diatoms fix 10 billion tones of carbon per year [J]?Canadian Journal of Botany, 2005, 83: 898—908
[2] Badger M R, Anderews T J, Whitney S M,et al.The diversity and coevolution of Rubisco, plastids, pyrenoids and chloroplast based CO2concentrating mechanisms in algae [J].Canadian Journal of Botany, 1998, 70: 1052—1071
[3] Reinfelder J R.Carbon concentrating mechanisms in eukaryotic marine phytoplankton [J].Annual Review Marine Science, 2011, 3: 291—315
[4] Cloern J E.Our evolving conceptual model of coastal eutrophication problem [J].Marine Ecology Progress Series, 2001,210: 223—253
[5] Conley D J.Biogeochemical nutrient cycles and nutrient management strategies [J].Hydrobiologia, 1999, 410: 87—96
[6] Liu DY, Sun J, Chen Z T,et al.Effect of N∶P ratio on the growth of a red tide diatomSkeletonema costatum[J].Transactions of Oceanology and Limnology, 2002, 33(1): 39—44[刘东艳, 孙军, 陈宗涛, 等.不同氮磷比对中肋骨条藻生长特性的影响.海洋湖沼通报, 2002, 33(1): 39—44]
[7] Liu H, Gao Y L, Yin K D,et al.Effects of N to P ration on the growth of two red tide diatomSkeletonema costatumandThalassiosira weissflogii[J].Journal of Tropical Oceanography, 2010, 29(6): 92—97 [刘皓, 高永利, 殷克东, 等.不同氮磷比对中肋骨条藻和威氏海链藻生长特性的影响.热带海洋学报, 2010, 29(6): 92—97]
[8] Hu Z X, Xu N, Li A F,et al.Effects of different N∶P ratios on the growth of three red tide algae [J].Acta Hydrobiologica Sinica, 2008, 32(4): 482—487 [胡章喜, 徐宁, 李爱芬, 等.氮磷比率对 3种典型赤潮藻生长的影响.水生生物学报, 2008, 32(4): 482—487]
[9] Hodgkiss I J, Ho K C.Are changes in N∶P ratios in coastal waters the key to increased red tide blooms [J]?Hydrobiologia, 1997, 352: 141—147
[10] Geider R J, La Roche J, Greene R M,et al.Response of the photosynthetic apparatus ofPhaeodactylum tricornutum(Bacillariophyceae) to nitrate, phosphate and iron starvation[J].Journal of Phycology, 1993, 29: 755—766
[11] Geider R J, Macintyre H L, Graziano L M,et al.Responses of the photosynthetic apparatus ofDunaliella tertiolecta(Chlorophyceae) to nitrogen and phosphorus limitation [J].European Journal of Phycology, 1998, 33: 315—332
[12] Brooks A.Effects of phosphorus nutrition on ribulose-1,5-bisphosphate carboxylase activation, photosynthetic quantum yield and amounts of Calvin-cycle metabolites in spinach leaves [J].Australian Journal of Plant Physiology, 1986, 13:221—237
[13] Anwaruzzaman, Sawada S, Usuda H,et al.Regulation of ribulose 1, 5-bisphosphate carboxylase oxygenase activation by inorganic phosphate through stimulating the binding of the activator CO2to the activation sites [J].Plant Cell Physiology, 1995, 36: 425—433
[14] Jeffrey S W, Humphrey G F.New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton [J].Biochemie und Physiologie Pflanzen, 1975, 167: 191—194
[15] Henley W J.Measurement and interpretation of photosynthetic light-response curves in algae in the context of photoinhibition and diel changes [J].Journal of Phycology, 1993,29: 729—739
[16] Nimer N A, Warren M, Merret M J.The regulation of photosynthetic rate and activation of extracellular carbonic anhydrase under CO2-limiting conditions in the marine diatomSkeletonema costatum[J].Plant Cell Environment, 1998, 21:805—812
[17] Willbur K M, Anderson N G.Electronic and colorimetric determination of carbonic anhydrase [J].Journal of Biological Chemistry, 1948, 176: 147—154
[18] Redf i eld B C.The biology control of chemical factors in the environment [J].American Scientist, 1958, 46: 205—221
[19] Ho K C, Hodgkiss I J.Assessing the limiting factors of red tide by bottle bioassay [J].Asian Marine Biology, 1993, 10:77—94
[20] Davies J P, Grossman A R.Responses to deficiencies in macronutrients [A].In: Rochaix J D, Golschmidt-Clermont M, Merchant S (Eds.), The Molecular Biology of Chloroplasts and Mitochondria inChlamydomonas[C].Dordrecht:Kluwer Academic Publisher.1998, 613—633
[21] Giordano M, Hell R.Mineral nutrition in photolithotrophs:cellular mechanisms controlling growth in terrestrial and aquatic habitats [J].Recent Research Developments in Plant Physiology, 2001, 2: 95—123
[22] Shi Y J, Hu H H, Ma R Y,et al.Photosynthetic characteristics ofProrocentrum minimumand its nutrient uptake at different nitrogen and phosphorus levels [J].The Chinese Journal of Process Engineering, 2004, 4(6): 554—559 [石岩峻, 胡晗华, 马润宇, 等.不同氮磷水平下微小原甲藻对营养盐的吸收和光合作用特性.过程工程学报, 2004, 4(6):554—559]
[23] Plumley F G, Schmidt G W.Nitrogen-dependent regulation of photosynthetic gene expression [J].Process of National Academic Science USA, 1989, 86: 2678—2682
[24] Ekman P, Lignell A, Pedersen M.Localization of ribulose-1,5-bisphosphate carboxylase/oxygenase inGracilaria secundata(Rhodophyta) and its role as a nitrogen storage pool [J].Botanica Marina, 1989, 32: 527—534
[25] Sharkey T D.Feedback limitation of photosynthesis and the physiological role of ribulose bisphosphate carboxylase carbamylation [J].Botanical Magazine, 1990, 2: 87—105
[26] Maberly S C, Spence D H N.Photosynthetic inorganic carbon use by freshwater plants [J].Journal of Ecology, 1983,71: 705—724
[27] Beardall J, Roberts S, Millhouse J.Effects of nitrogen limitation on inorganic carbon uptake and specific activity of ribulose-1,5-P2 carboxylse in green microalgae [J].Canadian Journal of Botany, 1991, 69: 1146—1150
[28] Huppe H C, Turpin D H.Integration of carbon and nitrogen metabolism in plant and algal cells [J].Annual Review of Plant Physiology and Plant Molecular Biology, 1994, 45:577—607
[29] Young E B, Beardall J.Modulation of photosynthesis and inorganic carbon acquisition in a marine microalga by nitrogen, iron and light availability [J].Canadian Journal of Botany, 2005, 83(7): 917—928
[30] Hu H H, Zhou Q B.Regulation of inorganic carbon acquisition by nitrogen and phosphorus levels in theNannochloropsissp.[J].World Journal of Microbiology Biotechnology,2010, 26: 957—961
[31] Beardall J, Roberts S, Raven J A.Regulation of inorganic carbon acquisition by phosphorus limitation in the green algaChlorella emersonii[J].Canadian Journal of Botany, 2005,83: 859—864
[32] Kozlowska-Szerenos B, Zieliński P, Maleszewski S.Involvement of glycolate metabolism in acclimation ofChlorella vulgariscultures to low phosphate supply [J].Plant Physiology and Biochemistry, 2000, 38: 727—734
[33] Raven J A, Cockell C S, La Rocha C L.The evolution of inorganic carbon concentrating mechanisms in photosynthesis [J].Philosophical Transactions of Royal Society B, 2008,363: 2641—2650
[34] Xia J R, Huang J.Impacts of nitrogen and phosphorus on inorganic carbon utilization and carbonic anhydrase activity inNitzschia closteriumf.minutissima[J].Acta Ecologica Sinica, 2010, 30(15): 4085—4092 [夏建荣, 黄瑾.氮、磷对小新月菱形藻无机碳利用与碳酸酐酶活性的影响.生态学报, 2010, 30(15): 4085—4092]
[35] Kozlowska-Szerenos B, Bialuk I, Maleszewski S.Enhancement of photosynthetic O2evolution inChlorella vulgarisunder high light and increased CO2concentration as a sign of acclimation to phosphate deficiency [J].Plant Physiology and Biochemistry, 2004, 42: 403—409
[36] Beardall J, Griffiths H, Raven J A.Carbon isotope discrimination and the CO2accumulating mechanism inChloroella emersoni[J].Journal of Experimental Botany, 1982, 33:729—737
[37] Majeau N, Coleman J R.Correlation of carbonic anhydrase and ribulose-1, 5-bisphosphate carboxylase/oxygenase expression in pea [J].Plant Physiology, 1994, 104: 1393—1399
[38] Nimer N A, Miao X L, Brownlee C,et al.Inorganic carbon limitation, exofacial carbonic anhydrase activity, and plasma membrane redox activity in marine phytoplankton species [J].Journal of Phycology, 1999, 35: 1200—1205

