响应面法对牛喉管软骨多糖提取的工艺优化
陈宏硕,王维君,李晓颖,宋雪梅
(1.河北联合大学电气工程学院,河北唐山 063009;2.天津市食品加工工程中心,天津 300457)
多糖种类繁多,来源广泛,它们广泛存在于动物、植物、微生物(细菌和真菌)和海藻中。它们又可分为胞外和胞内多糖,其中研究得比较多的是植物多糖和微生物多糖。而动物软骨中除含有丰富的磷、钙、微量元素外,还含有大量的胶原蛋白和酸性粘多糖。酸性粘多糖是构成动物结缔组织的特有成分之一,植物中几乎不含有。动物软骨中起作用的主要是多糖物质,动物多糖主要由糖原、甲壳素、肝素、硫酸软骨素、硫酸皮肤素、硫酸角质素、硫酸肝素、透明质酸等复合而成[1],本文主要针对牛喉管软骨多糖的提取工艺条件进行研究。
1 材料与方法
1.1 材料与试剂
牛喉管软骨、碱性蛋白酶、胰蛋白酶:均为天津市诺奥科技发展有限公司产品;硫酸软骨素abc 酶:美国sigma 公司产品;乙醇、苯酚、硫酸、咔唑、硼砂、过硫酸胺、十二烷基磺酸钠均为分析纯;乙腈、甲醇均为色谱纯。
1.2 主要仪器与设备
HW·SY21-K4 系列电热恒温水浴锅:北京长风仪器厂;PHS.3C 型pH 计:上海嘉鹏科技有限公司;高效液相色谱(HPLC)仪:日本岛津公司。
1.3 实验方法
1.3.1 多糖的提取工艺研究
工艺路线图[3-6]:组织脱脂、脱钙→加入水解酶(碱性蛋白酶,胰蛋白酶)双酶进行酶解→酶解液除蛋白(三氯乙酸→3 倍体积醋酸钾-乙醇混合液4 ℃沉淀过夜→8 000 转离心30 min,得沉淀物Ⅰ→沉淀物用0.2 mol/L 的NaCl 液溶解8 000 转离心30 min,取上清→加入0.5 mL 的十六烷基吡啶盐(5%)→离心得沉淀Ⅱ,再用2.5 mol/L 的NaCl 盐溶解→用5 倍体积的乙醇沉淀→10 000 r 离心30 min,得到多糖提取物。
按照下式计算多糖提取率:多糖提取率%=多糖的质量/提取前样品质量×100%
1.3.2 酸性多糖含量测定
动物软骨多糖中主要是含有酸性多糖,根据由Bitter 和Muir 改良的咔唑法(葡糖醛酸含量计)测定多糖含量。分别测定不同浓度葡萄糖醛酸标准溶液的吸光度,绘制标准曲线,并计算出吸光度和浓度的线性回归方程。取样品0.1 g/L 的溶液1 mL,按照标准曲线项下的方法测定吸光度,在标准曲线上查出相应的葡糖醛酸浓度,按下式计算酸性多糖含量:葡萄糖醛酸%=标准曲线查出的浓度/样品浓度×100%
1.3.3 软骨多糖的HPLC 分析
参照牛增元等[7-8]的方法进行分析。
2 结果与讨论
2.1 单因素实验
根据前期单因素试验研究结果,确定温度、pH、搅拌时间为影响多糖提取率的3 个关键因子,并且单因素实验多糖提取率最大值为18.13%。因此,采用三因素四水平的响应面优化实验来确定多糖提取率的条件。
2.2 响应面优化实验结果
2.2.1 Box-Behnken 实验设计
根据前期单因素试验研究结果,表明温度、pH、搅拌时间为影响多糖提取率的3 个关键因子。因此,采用Box-Behnken 模型,分别以X1、X2、X3来表示关键因子(自变量),+1、0、-1 代表其高、中、低水平。实验设计与数据处理采用辅助软件SAS 8.0 来完成。表1 列出了各自变量的实验水平范围及其编码。采用多元回归技术,拟合二次多项模型的Box-Behnken 设计见表1。

表1 Box-Behnke 实验因素水平Table 1 Experimental variables and levels for Box-Behnke
依据Box-Behnke 中心组合实验设计原理,以X1(温度)、X2(pH)、X3(搅拌时间)为自变量,以多糖喉管骨多糖得提取率Y(mg/mg,%)为响应值,设计响应面分析试验,Box-Behnke 实验设计及结果见表2。
以多糖提取率为响应值,根据表2 中Box-Behnken 设计的实验结果,利用SAS 软件对其结果进行二次回归分析,得回归方程(predictivemodelforY1),对其回归方程的方差分析见表3。
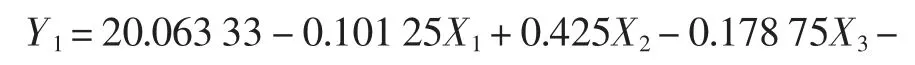
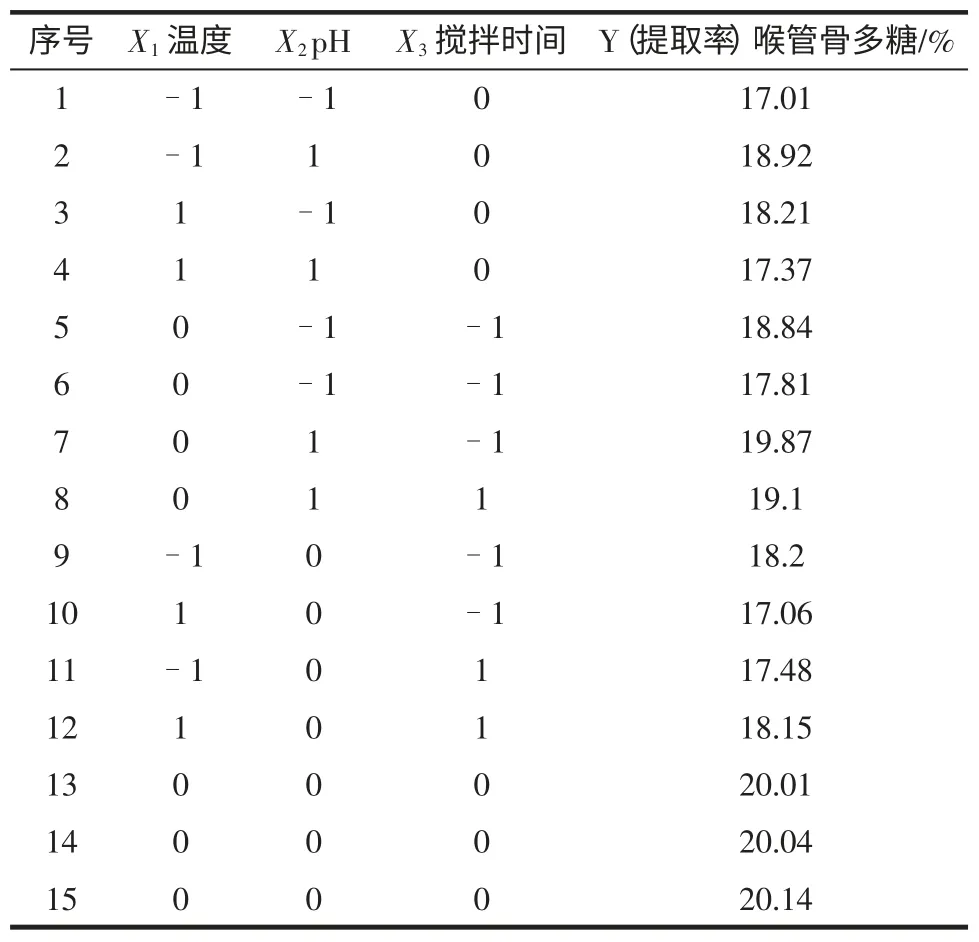
表2 Box-Behnke 实验设计及结果Table 2 Experimental design and results of Box-Behnke
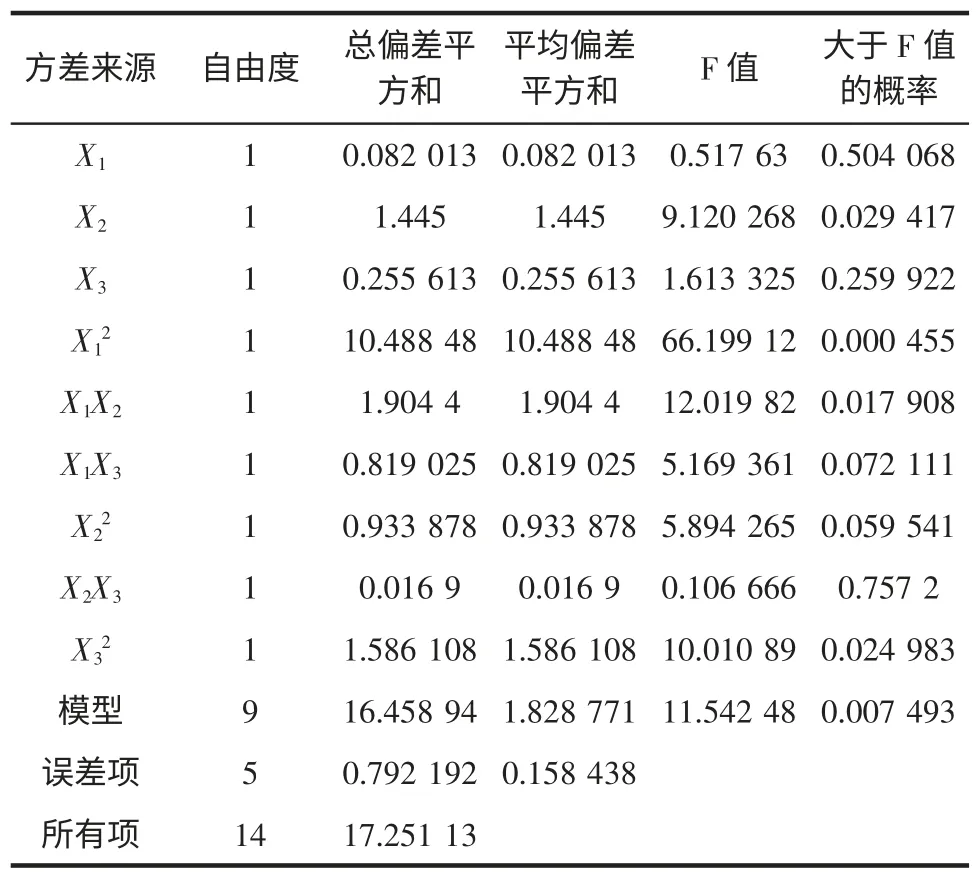
表3 回归方程的方差分析Table 3 Variance analysis for regression equation

其中:Y1代表喉管骨的多糖提取率响应值。
从回归方程的方差分析表3 中可以看出模型在α=0.01 水平上回归显著。模型可信度分析见表4,其中复相关系数的平方R2=0.954 1,说明模型可以解释95.41%实验所得多糖提取率的变化,表明方程拟合较好。CV(Y 的变异系数)表示实验的精确度,CV 值越高,实验的可靠性越低,本设计实验中CV=2.146 1%,较低,说明实验操作可信。综上说明回归方程给喉管骨多糖提取率提供了一个合适的模型。
2.2.2 响应面分析及最佳提取条件的确定
根据以上实验结果,对模型的可信度分析见表4。

表4 模型的可信度分析Table 4 Fit statistics for model
通过回归方程来绘制分析图,以考察所拟合响应曲面的形状,响应曲面立体分析见下图1。

图1 Y=f(X1,X2)响应面立体图Fig.1 Y=f(X1,X2)Responsive surface plot
综上所述,从图中及软件分析,回归方程存在稳定点,稳定点是极大值点。通过岭嵴分析(ridgeanalysis)得到极大值所对应的各主要因素(X1,X2,X3)的编码值分别为:喉管骨(-0.158 85,0.520 82,-0.165 37),即温度、pH、搅拌时间的最佳值分别为53.4 ℃、8.23、9.3 h,此时喉管骨多糖提取率可达20.19%。
2.2.3 实验结果验证
以2.2.2 确定的主要因素条件来提取多糖,喉管骨多糖提取率均值20.05%,与预测值20.19%是非常接近的;同时,与单因素实验的最大提取率相比提高了10.59%。可见,应用响应面法优化提取条件可行,回归模型较可靠。
2.3 牛喉管骨软骨多糖中酸性多糖含量分析
取含0.1 g/L 样品的溶液1 mL,按照1.3.2 方法测定吸光度,然后计算出多糖含量。单因素实验中测定其中的酸性多糖含量最高34.94%,而提取条件优化后结果显示喉管骨中酸性多糖含量为39.58%,酸性多糖含量相比提高了10.3%。
2.4 牛喉管软骨多糖液相分析
喉管骨多糖样品经处理后,通过高效液相色谱法得出喉管骨的液相色谱见图2。
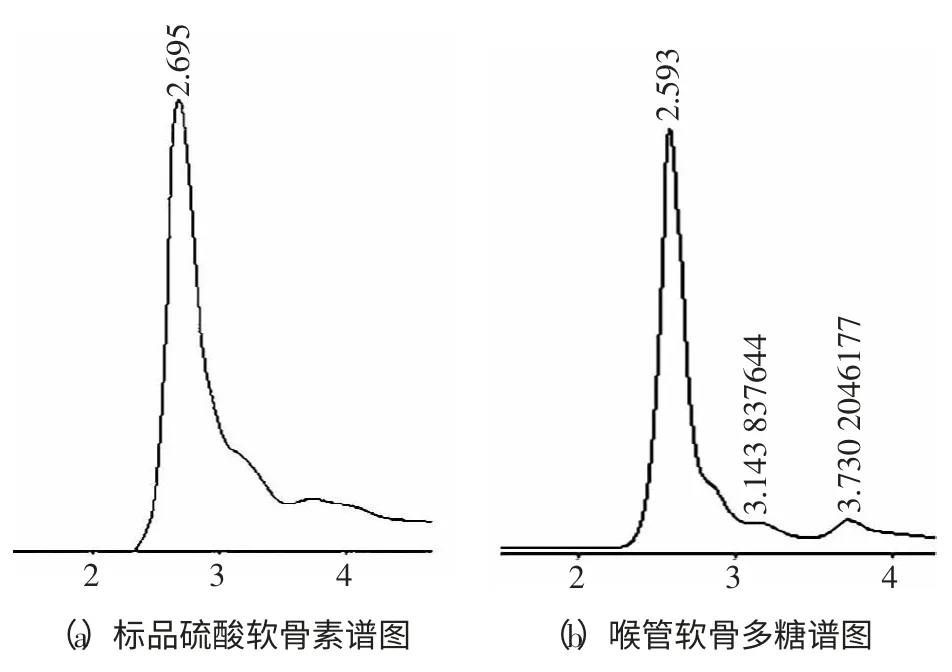
图2 喉管骨软骨多糖的液相色谱图Fig.2 The liquid chromatogram of throat cartilage polysaccharides
从图2 可以看出,喉管骨多糖的出峰位置是2.56 min,与标准品硫酸软骨素出峰位置2.69 min 相比延迟了,原因可能与自身某种基团的结构有关。而且牛喉管软骨多糖在主峰后面有一个小峰,可能是糖蛋白。
3 结论
1)通过单因素和响应面设计实验最终确定软骨多糖的最佳提取工艺条件,即温度、pH、搅拌时间的最佳值分别为53.41 ℃、8.23、9.33 h;此条件下的多糖提取率是20.05%,酸性多糖含量达39.58%。
2)通过液相色谱分析,初步推断出牛喉管软骨多糖为类硫酸软骨素多糖,说明优化工艺能够保持牛喉管软骨中的酸性多糖品质。
[1]殷涌光,韩玉珠,丁宏伟.动物多糖的研究进展[J].食品科学,2006,27(3):256-262
[2]苏现波.鲨鱼软骨粘多糖的提取、分离与功能性研究[D].河北:河北农业大学,2004:1-7
[3]刘义.梅花参糖胺聚糖的提取分离纯化及结构鉴定[D].无锡:江南大学,2005:10-11
[4]NicolaVolpi,Francesca Maccari.Purification and characterization of hyaluronic acid from the mollusc bivalve Mytilus galloprovincialis[J].Biochimie,2003,85:619-625
[5]Mohamad Warda,Eman M Gouda,Toshihiko Toid,et al.Isolation and characterization of raw heparin from dromedary intestine:evaluation of a new source of pharmaceutical heparin[J].Comparative Biochemistry and Physiology,2003,136:357-365
[6]陈宏硕,王维君,张国蓉,等.三种软骨多糖清除自由基活性研究[J],食品研究与开发,2008,29(2):56-58
[7]Lauder R,Huckerby T,Nieduszynski.A fingerprinting method for chondroitin demmtan sulphate and hyaluronan oligosaccharides[J].Glycobiology,2000,10(4):393-401
[8]Linli Chi,Jonatban Amster,Robert J Linhardt.Mass Spectrometry for the Analysis of Highly Charged Carbohydrates[J].Current Analytical Chemistry,2005,1(1):223-240
——以首场广东喉管·唢呐独奏音乐会为例

