交联微孔木薯淀粉的制备及其性能研究
吴思芸,王继虎,* ,张燕萍,于丹凤,邵思盼,李冬亮,贺正果,唐忠锋
(1.上海工程技术大学化学化工学院,上海 201620;2.广西工学院生物与化学工程系,广西柳州 545006)
微孔淀粉是一种变性淀粉,作为一种高效、无毒和安全的吸附剂被广泛地应用于食品、医药、化妆品、农业等行业。Whistler[1]用玉米原淀粉经酶水解后得到微孔淀粉,首次发表有关微孔淀粉吸附性能和应用方面的初步研究。日本人长谷川信弘[2]首次提出了较为明确的微孔淀粉的定义。目前制备微孔淀粉的主要方法有[3-8]:物理法、机械法和生物法。其中酶法制备微孔淀粉的效果最佳。然而,微孔淀粉在制备过程中,大量的淀粉分子链受到破坏,结构脆弱,稳定性较差,在较高温度或较高pH下,比原淀粉更易被糊化,且在吸水之后冷冻的情况下,其颗粒就很容易破裂、崩解,使其丧失吸附性能。因而交联微孔淀粉成为研究的热点[9-12]。常用的方法是先将淀粉微孔后再进行交联,存在的问题是在制备微孔淀粉的过程中其结构易受到破坏,达不到很好的交联效果。新的研究方法是淀粉先交联处理后,再进行酶解制得交联微孔淀粉。与先微孔后交联淀粉比较,其吸水和吸油能力得到提高,可更好地应用于生产中。本文以木薯淀粉为原料,三氯氧磷为交联剂进行交联反应,而后采用α-淀粉酶与糖化酶的复合酶进行反应,制备出交联微孔淀粉并考察其性能。
1 材料与方法
1.1 材料与仪器
木薯淀粉(食品级) 上海绿苑淀粉有限公司;α-淀粉酶(酶活力≥4000U/g)、糖化酶(酶活力≥4000U/g) 上海楷洋生物技术有限公司;氢氧化钠、无水乙酸钠、乙酸、盐酸、三氯氧磷(分析纯) 国药集团化学试剂有限公司;金龙鱼食用油(食品级) 市购。
HH-YS型恒温油水浴锅 巩义市英峪予华仪器厂;RW20型搅拌器 德国IKA集团;DHG-9140A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;800B型台式离心机 上海精密仪器仪表有限公司;BR705404型移液枪 德国BRAND公司;X’Pert PRO型X射线衍射仪 日本Rigaku公司;S-3400N型扫描电镜分析仪 日本Hitachi公司。
1.2 实验方法
1.2.1 交联淀粉制备 参照文献[12]制备交联淀粉,具体步骤如下:准确称取100g木薯淀粉(干基),加入到500mL三口烧瓶中,加入250mL的水,45℃下预热20min,同时用电动搅拌机搅拌,而后缓慢加入少量的 NaCl(占干淀粉质量0.5%)和一定量的POCl3。用1mol/L的NaOH溶液调节淀粉乳液pH,并维持乳液pH为11。反应4h后,用1mol/L的盐酸将乳液pH调至6~7,乳液再经过滤、洗涤干燥、粉碎得交联木薯淀粉。
1.2.2 交联微孔淀粉制备 配制一定质量浓度(10%、20%、30%、40%)的交联淀粉乳,加入到500mL三口烧瓶中,缓慢添加醋酸钠缓冲溶液,调节溶液的 pH,置于一定温度的恒温水浴锅中预热20min,同时用电动搅拌机搅拌。精确称取定量的复合酶 m(糖化酶)∶m(α-淀粉酶)=3∶1,用醋酸钠缓冲溶液10mL配成酶液,移入烧瓶中,酶解一定时间后,停止反应。悬浮液经抽滤、蒸馏水洗涤、干燥、粉碎后得到交联木薯微孔淀粉。
1.2.3 吸水率与吸油率的测定 精确称取质量为m1的交联微孔淀粉重量于250mL烧杯中,加入100mL蒸馏水,常温下混合搅拌30min,采用G2砂芯漏斗抽滤至无液滴,取出交联微孔淀粉后称重,质量为m2,根据前后重量差计算吸水率S1。
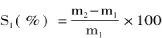
精确称取重量为m3的交联微孔淀粉于100mL烧杯中,加入体积为V1的色拉油,常温下混合搅拌30min,而后采用离心机3000r/min离心25min,取出上层色拉油,量取其体积为V2,根据前后体积差计算吸油能力S2。
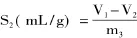
1.2.4 扫描电镜分析(SEM) 采用S-3400型扫描电子显微镜观察原淀粉和交联微孔淀粉的粒径大小以及表面形貌。测试条件:用导电双面胶将淀粉粉末固定在金属样品平台上,在真空中喷涂钯金后,置于电子扫描显微镜中以20kV电子束观察。
1.2.5 热失重分析(TGA) 采用PT-1000型TGA对原淀粉和微孔淀粉的试样进行热失重分析,以了解其耐热性能的变化。测试条件:氮气保护,升温速率 20℃ /min,升温范围:20~600℃。
1.2.6 X射线衍射分析(XRD) 采用X’Pert PRO型X射线衍射仪分析原淀粉和交联微孔淀粉的晶型结构。X射线衍射仪(XRD)测试条件:电压40kV,电流40mA,扫描速度 5°/min,测试角5~50°。
2 结果与讨论
2.1 交联淀粉乳浓度对交联微孔淀粉的影响
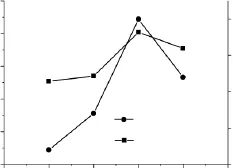
图1 淀粉乳浓度对交联微孔淀粉性能影响Fig.1 The influence of starch milk content on the property of crosslinked microporous starch
交联淀粉乳浓度对交联微孔淀粉性能的影响如图1所示。酶解条件:交联淀粉乳浓度变量(10%、20%、30%和40%),交联剂用量40μL/g(占干淀粉重量),缓冲液 pH5.0,酶解温度50℃,复合酶用量2.0%(占干淀粉重量),酶解时间12h。由图1可以看出,随着交联淀粉乳浓度的上升,交联微孔淀粉吸水率和吸油能力先上升后下降。当交联淀粉乳的浓度较低时,酶与淀粉作用的活性点较少,因而吸水率和吸油率较低,当交联淀粉乳浓度为30%时,酶和淀粉的配比较佳,交联微孔淀粉吸水率和吸油能力最高,进一步增加交联淀粉乳的浓度,由于酶的用量一定,多过的淀粉不能有效和酶作用,反而稀释了酶的有效浓度,造成吸水率和吸油能力略有下降。
2.2 交联剂用量对交联微孔淀粉的影响
交联剂用量对交联微孔淀粉性能的影响如图2所示。酶解条件:交联剂用量变量(20、40、80、150、300μL/g)(占干淀粉重量),交联淀粉乳浓度30%,缓冲液pH4.5,酶解温度50℃,复合酶用量2.0%(占干淀粉重量),酶解时间12h。
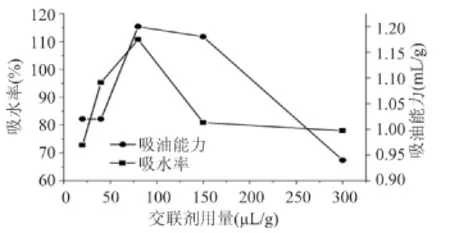
图2 交联剂用量对交联微孔淀粉性能影响Fig.2 The influence of crosslinking agent content on the property of crosslinked microporous starch
由图2可以看出交联剂用量对吸水率和吸油率影响较大。随着交联剂用量的上升,微孔淀粉吸水率和吸油能力先上升后下降。在交联剂用量为80μL时吸水率和吸油能力达到最大值。交联剂用量较少时,微孔淀粉交联程度较低,随着交联剂用量增加,交联程度逐步上升,达到一定浓度后,再进一步增加并不能有效提高交联程度。
2.3 酶用量的对交联微孔淀粉的影响
复合酶用量对交联微孔淀粉的性能影响如图3所示。酶解条件:复合酶用量变量(1.0%、1.5%、2.0%、2.5%)(占干淀粉重量),交联淀粉乳浓度30%,交联剂用量80μL/g(占干淀粉重量),缓冲液pH4.5,酶解温度45℃,酶解时间8h。
由图3可以看出,在复合酶用量为1.0%~2.0%范围内,吸水率和吸油能力一直呈上升的趋势,复合酶用量超过2.0%后反而略有下降。当复合酶的浓度较低时,酶与淀粉作用的活性点较少,因而吸水率和吸油能力较低,当复合酶用量达到2.0%时,酶和淀粉的配比最佳,交联微孔淀粉吸水率和吸油能力最高。复合酶用量进一步增加,由于淀粉乳的浓度一定,过多酶反而会影响交联淀粉的微孔化。
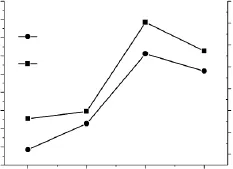
图3 复合酶用量对交联微孔淀粉性能影响Fig.3 The influence of composite enzyme content on the property of crosslinked microporous starch
2.4 缓冲液pH对交联微孔淀粉的影响
缓冲液pH对交联微孔淀粉的性能影响如图4所示。酶解条件:缓冲液pH变量(4.0、4.5、5.0、5.5),交联淀粉乳浓度30%,交联剂用量80μL/g(占干淀粉重量),酶解温度50℃,复合酶用量2.0%(占干淀粉重量),酶解时间16h。
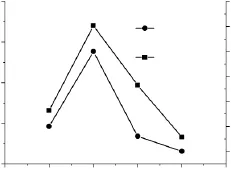
图4 缓冲液pH对交联微孔淀粉性能影响Fig.4 The influence of pH on the property of crosslinked microporous starch
由图4可知,当缓冲液pH为4.5,吸水率和吸油能力均达到最大值。酶需要在一定的酸度条件下才能发挥最大的活力,过低或过高的pH都会减弱酶的活性。
2.5 酶解温度对交联微孔淀粉的影响
酶解温度对交联微孔淀粉的性能影响如图5所示。酶解条件:酶解温度变量(30、40、50、60℃),交联淀粉乳浓度30%,交联剂用量80μL/g(占干淀粉重量),缓冲液 pH4.5,酶解温度50℃,复合酶用量2.0%(占干淀粉重量),酶解时间8h。
由图5可以看出,随着酶解温度的上升,交联微孔淀粉吸水率和吸油能力先上升后下降。反应温度较低时,复合酶的活力较低,不利于交联淀粉的微孔化,温度上升到50℃时,复合酶具有最大活性。酶解温度继续增加,酶的活力下降,影响了微孔化的程度。同时淀粉趋向于糊化,淀粉的结构容易被破坏。
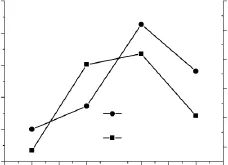
图5 酶解温度对交联微孔淀粉性能影响Fig.5 The influence of reaction temperature on the property of crosslinked microporous starch
2.6 酶解时间对交联微孔淀粉的影响
酶解时间对交联微孔淀粉的性能影响如图6所示。酶解条件:酶解时间变量(8、12、16、20h),交联淀粉乳浓度30%,交联剂用量80μL/g(占干淀粉重量),缓冲液 pH4.5,复合酶用量1.5%(占干淀粉重量),酶解温度50℃。
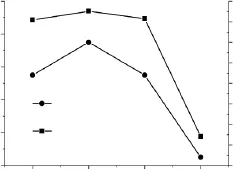
图6 酶解时间对交联微孔淀粉性能影响Fig.6 The influence of reaction time on the property of crosslinked microporous starch
由图6可以看出,交联微孔淀粉的吸水率和吸油能力的变化基本相同。在酶解时间为8~12h范围内,吸水率和吸油能力变化平缓。而酶解时间超过12h之后呈快速下降的趋势。其原因主要是随着酶解时间的延长,淀粉过度水解,使部分淀粉颗粒结构发生破坏,失去了微孔化的能力,导致吸水率和吸油能力的下降。
2.7 扫描电镜分析(SEM)
原淀粉、交联微孔淀粉的扫描电镜照片如图7、图8所示。

图7 原淀粉SEM图Fig.7 SEM images of natural starch
由图7可见原淀粉颗粒呈不规则椭球形,颗粒表面相对平滑。与原淀粉相比,经过复合酶处理后,图8中的交联微孔淀粉颗粒形貌大部分发生了明显的变化,一部分颗粒表面出现了孔状结构,微孔孔径都为2μm左右,另外一部分颗粒表面出现塌陷,形成浅坑状。

图8 交联微孔淀粉SEM图Fig.8 SEM images of crosslinked microporous starch
2.8 热失重分析(TGA)
原淀粉、交联微孔淀粉的热失重曲线如图9所示。
从图9可以看出,原淀粉样品热失重过程大致分为三个阶段:在分解初期,热失重变化不大,在100℃时失去约15%的重量,这是淀粉中水分的脱出;在300~350℃温度范围内,样品大量失重,这是淀粉中无定形区的分解,分解温度约为331℃,350℃时样品还剩约20%;350℃之后失重幅度变小,直至完全失重,这是由于淀粉随着温度的增加,水分和淀粉的无定形区消失,留下来的为淀粉的结晶区,其分解温度较高,约为510℃。
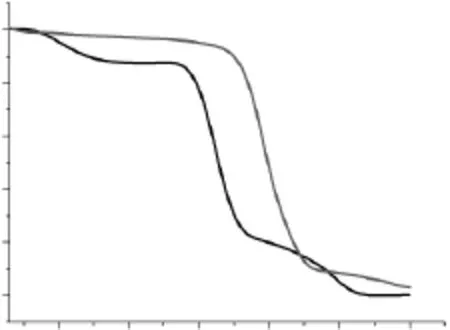
图9 原淀粉和交联微孔淀粉TGA图Fig.9 TGA curves of natural and crosslinked microporous starch
交联微孔淀粉样品失重过程基本上也分为三个阶段,与原淀粉基本相同,但分解温度有非常大的变化,如表1所示。
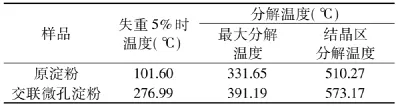
表1 原淀粉和交联微孔淀粉TGA分解温度Table1 Decomposition temperature of natural starch and crosslinked microporous starch
从表1中可以看出,原淀粉样品失重5%时的分解温度为101.60℃,最大分解温度为331.65℃。而交联微孔淀粉失重5%时的温度为276.99℃,最大分解温度为391.19℃。交联后的微孔淀粉与原淀粉相比,失重5%时的温度,最大分解温度,结晶区分解温度有非常大的提升,这说明了交联微孔淀粉的热稳定性得到明显的增加。
2.9 X射线衍射分析(XRD)
原淀粉、交联微孔淀粉的X射线衍射如图10所示。
根据晶型可将淀粉分为A、B、C类,从图10可以看到,原淀粉分别在2θ约为17.12°和17.81°处出现最强的峰,在2θ约为14.94°和22.80°处出现中等强度的单峰,在2θ角约为20.01°和26.45°处出现了低强度的单峰,属典型A型结构。
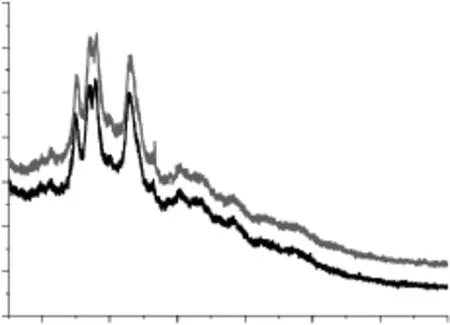
图10 原淀粉和交联微孔淀粉XRD图Fig.10 XRD patterns of natural and crosslinked microporous starch
衍射峰的高度和宽度取决于结晶的质量分数和大小,峰越高、越窄,意味着结晶越大或结晶区域越完整。由图10可以看出,原淀粉的X射线衍射谱图由尖峰衍射特征和弥散衍射特征两部分组成,是典型的多晶体系的衍射曲线。四个强度较高的峰说明木薯淀粉结构是由结晶结构和无定型结构两部分组成的。对比原淀粉和交联微孔淀粉的XRD图谱,从峰面积来看,交联微孔淀粉的结晶峰变得更高更窄,峰面积也相应增大,这说明结晶度增大,结晶区域更完整。
3 结论
3.1 采用先交联后微孔化的方法制备了木薯交联微孔淀粉,较佳工艺条件为:淀粉乳液质量浓度30%,交联剂用量80μL,缓冲液pH4.5,复合酶用量2.0%,酶解温度50℃,酶解时间12h。
3.2 木薯原淀粉经交联、酶解微孔化后,其颗粒有较多孔,并存在塌陷现象;交联微孔淀粉的热稳定性远大于木薯原淀粉;交联微孔淀粉X射线衍射峰强度、峰面积增大,结晶度提高。
[1]Whistler R L.Subgranular crystalline starch as fat substitute starch:US,5445678[P].1995-08-29.
[2]盛志佳,林亲禄,肖华西.籼米多孔淀粉的研制[J].粮油食品科技,2011(4):4-7.
[3]许丽娜,董海洲,张绪霞,等.多孔淀粉制备及开发前景[J].粮食与油脂,2007(2):18-20.
[4]刘树立,王春艳.微孔淀粉的制备和应用进展[J].粮食加工,2007,32(3):59-62.
[5]唐忠锋,张瑛,罗友亮.复合酶法优化木薯微孔淀粉的工艺及吸附性研究[J].粮食与饲料工业,2008(1):17-18.
[6]王继虎,陈有双,唐忠锋,等.盐酸水解制备木薯微孔淀粉的研究[J].粮油加工,2010(11):90-92.
[7]陈有双,王继虎,唐忠锋,等.不同配比复合酶协同酶解木薯微孔淀粉的研究[J].粮油加工,2010(9):82-85.
[8]唐忠锋,凌新龙,谢清若,等.酶法制备微孔淀粉的研究进展[J].高分子通报,2007(7):41-44.
[9]徐忠,刘明丽.玉米交联微孔淀粉制备工艺的研究[J].食品科学,2007,28(2):94-98.
[10]徐忠,王鹏.交联微孔淀粉的制备及性质研究[J].黑龙江大学自然科学学报,2006,23(6):729-733.
[11]周琼,张涛,刘雄,等.交联微孔淀粉基本性质的研究[J].食品与发酵工业,2005,31(8):19-22.
[12]周琼,刘雄,周才琼,等.交联微孔淀粉的制备[J].食品与发酵工业,2004,30(2):138-141.

