被动吸烟所致小鼠肺癌中Angiopoietin-3 基因过表达及其意义的初步探讨
张锁连,宋腾腾,梁 琨,陈照立
肿瘤的发病机制复杂,涉及多种遗传因素的改变,各类相关基因并非独立发生作用,而是互相配合、互相调控,构成错综复杂的网络,是累积性基因损伤在转化表型方面达到顶点的最终结果。了解肿瘤细胞与正常细胞基因表达谱的差异,可加深对肿瘤发生、发展分子机制的认识。肺癌是所有恶性肿瘤中发病率和病死率最高的肿瘤,其发生发展与多种危险因素有关,如环境因素、吸烟、精神因素、职业接触史等[1]。越来越多的研究表明肺癌与多个基因表达失调有关。吸烟除了导致肺组织形态学改变以外,还可导致基因的改变[2]。笔者通过建立吸烟导致小鼠肺癌模型[3],利用小鼠全基因组基因芯片筛选与吸烟所致肺癌的相关基因,再通过RT-PCR半定量和实时荧光定量PCR,以及Western blotting分析等技术深入研究某些(个)可能与吸烟所致肺癌有关的基因在不同处理组动物肺组织中的表达情况,为进一步确定其与肺癌的关系奠定基础。
1 材料与方法
1.1 动物模型与分组 将200 只5 周龄健康清洁级昆明系小鼠雌雄各半随机分为正常对照组、烟草暴露组、槲皮素干预组和维生素E 干预组,每组25 只。正常对照组动物不加任何干预,余组均在动式染毒柜中被动吸烟染毒,每周染毒5 d,每天6 h,连续染毒5 个月,恢复4 个月[4]。槲皮素干预组和维生素E 干预组染毒的同时还将槲皮素[80 mg/(kg·d)]和维生素E[100 mg/(kg·d)]分别加入饲料中,连续喂养9 个月。全部实验期间,包括烟草暴露期间,小鼠均自由饮水和进食。染毒实验结束后,将小鼠处死,手术切除全肺,放于正常光线下或解剖显微镜下,计数肺表面的肿瘤结节数和形态、颜色、大小等,编号并拍照。计算肿瘤发病率和肿瘤结节发生数。选取部分肺组织用去RNA 酶处理的生理盐水清洗后,液氮-80 ℃保存,包括正常对照组,被动吸烟组正常组织(以下简称“吸烟组”),被动吸烟加维生素E 干预组正常组织(以下简称“SE 组”);被动吸烟组肿瘤组织(以下简称“肿瘤组”)。以上各组样本量均为12,雌雄各6,随机编号为1 ~6。
1.2 主要仪器与药品 iCycler Real time PCR 仪购自美国Bio-Rad 公司,图像分析仪购自日本Kodak,BCA 蛋白浓度测定试剂盒购自碧云天生物技术研究所,Ang-3 大鼠单抗购自美国Abcam 公司。
1.3 检测方法 用基因芯片发现和分析肺癌的相关基因,最后选择了4 条上调基因Ang-3、Arg-2、H2-Ea 和H2-D1做进一步实验:mRNA 表达检测。
1.3.1 引物的设计与合成 小鼠Ang-3、Arg-2、H2-Ea、H2-D1 和内参照β-actin 引物通过Primer 软件设计,由大连宝生物公司合成。β-actin(207bp)上游引物:5'-gac agg atg cag aag gag a-3';下游引物:5'-gct gga agg tgg aca gtg ag – 3。Ang-3(110bp)上游引物:5'-gcc cag gtt ctt tgt tgt tg-3';下游引物:5'-agt tgg ctt ggc atc ata gtg-3'。Arg-2(256bp)上游引物:5'-cac ctc tca cca ctg tat c-3';下游引物:5'-aat gtc tgt tcc atc acc-3'。H2-Ea(183bp)上游引物:5'-ccc acc aaa cac cca aga ag-3';下游引物:5'-cgc cgt caa agt caa aca taa ac-3'。H2-D1 (184bp)上游引物:5'-tga aga gga gga gaa aca c-3';下游引物:5'-tga cta aag aga act gag gg-3'。
1.3.2 提取RNA 采用改良异硫氰酸胍法(Trizol试剂)提取小鼠肺组织总RNA,用紫外分光光度计分析RNA 纯度和浓度。
1.3. 3 反转录( cDNA 合成)采用Revert Aid First Stand cDNA Synthesis kit(Fermat 公司)进行反转录反应,所有操作均按照反转录试剂盒说明书讲行。荧光实时定量PCR 反应cDNA 经过荧光实时定量PCR 扩增每个片断,按照SYBR,Premix Ex Taq TM Kit (TaKaRa)说明书配制反应体系(表1)。根据引物合成的条件摸索该基因PCR 扩增条件,使扩增效率基本一致:β-actin:95 ℃/10 s,95 ℃/10 s,55 ℃/20 s 共40 cycles,95 ℃/1 min,55 ℃,95 ℃,0.5 ℃/10 s 共80 个循环后绘制溶解曲线。其他基因条件基本类似,简单如下:Ang-3:95 ℃ /10 s;95℃/10 s,54.5 ℃/20 s,共40 cycles;Arg-2:95 ℃/10 s;95 ℃/10 s,53.5 ℃/20 s,共40 cycles;H2-D1:95 ℃/10 s;95 ℃/10 s,53 ℃/20 s,共40 cycles;H2-Ea:95 ℃/10 s;95 ℃/10 s,56.5 ℃/20 s,共40 cycles。每个样品都做3 个重复样品管,结果去掉偏差大的值后取平均作为该样品的最后数据值。
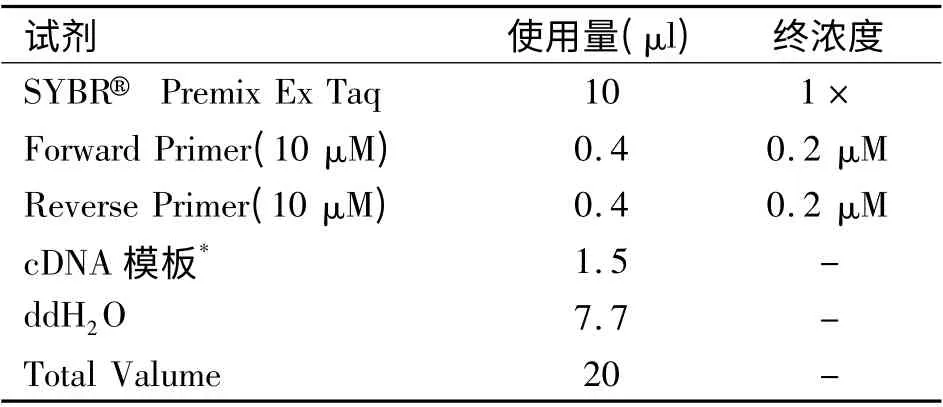
表1 PCR 反应体系
1.3.4 荧光实时定量PCR 图像分析和相对定量定量PCR 的Ct 值表示每个PCR 反应管内荧光信号到达设定的域值时所经历的循环数。各模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct 值越小,反之亦然。利用已知起始拷贝数的标准品可做出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表Ct 值。因此,只要获得未知样品的Ct 值,即可从标准曲线上计算出该样品的起始拷贝数。本实验是利用样品的Ct 值代入公式Fold Change = 2-Δ(ΔCT),ΔCt = Cttarget-Ctβ-actin,Δ(ΔCt)= ΔCtstimulated-ΔCtcontrol,计算目的基因RNA 表达量的相对量[4]。
1.4 小鼠肺组织Ang-3 蛋白的表达 采用BCA(bicinchoninic acid)法测量提取蛋白浓度,再通过Western blotting 实验法测定小鼠肺组织中Ang-3蛋白表达量及其意义[5]。
1.5 统计学处理 所有数据用SPSS 11.5 统计软件处理。计量资料以±s 表示,组间均数比较采用方差分析,以P <0.05 为差异有统计学意义。
2 结果
2.1 一般情况 所有小鼠对烟草暴露和抗氧化剂干预适应良好,未因实验因素直接导致死亡。烟草暴露组小鼠肺肿瘤发病率为43.5%,每只肺表面的平均肿瘤结节数为1 ± 0. 29,明显高于对照组(11.8%,0.18 ±0.09)和维生素E 干预组(17.9%,0.32 ±0.16),差异有统计学意义(P <0.05);维生素E 干预效果最好。槲皮素效果最不理想,其肿瘤结节数和肿瘤发病率均接近烟草暴露组。
2.2 荧光实时定量PCR 结果 荧光实时定量PCR扩增曲线稳定性和反应特异性均较好。先对每个组内的雌雄鼠组织中mRNA 表达量进行统计分析,发现组内雌雄比较无统计学意义。再进行组间比较,结果如下。
2.2.1 Ang-3 Ang-3 的mRNA 表达量在吸烟组(9.7951 ±2.9518)、SE 组(27.6338 ±15.6042)和肿瘤组(30.6544 ±15.2245)均明显高于正常对照组(1.0469 ±0.3441),差异有统计学意义(P <0.05);SE 组和肿瘤组也明显高于吸烟组,差异有统计学意义(P <0.05);SE 组与肿瘤组比较无统计学意义。
2.2.2 H2-Ea 肿瘤组的mRNA 表达明显高于对照组、吸烟组和SE 组,差异有统计学意义(P <0.05),吸烟组和SE 组相对于对照组有所增高但比较差异无统计学意义,吸烟组和SE 组之间比较也无统计学意义。
2.2.3 Ifi203 吸烟组的mRNA 表达明显高于对照组、SE 组和肿瘤组,比较差异有统计学意义(P <0.05);SE 组的mRNA 表达低于对照组和肿瘤组,比较有统计学意义(P <0.05);而肿瘤组与对照组之间比较差异无统计学意义。
2.2.4 H2-D1SE 组和肿瘤组的mRNA 表达明显高于对照组和吸烟组,差异有统计学意义(P <0.05);SE 组和肿瘤组高于吸烟组(P <0. 05),但SE 组和肿瘤组之间比较无统计学意义。
2.2.5 Arg-2 肿瘤组的mRNA 表达明显高于对照组、吸烟组和SE 组,比较差异有统计学意义(P <0.05);吸烟组与对照组比较有所增高但差异无统计学意义;SE 组与对照组和吸烟组比较有所下降但也无统计意义。
2.3 Western blot 法测定各组小鼠肺组织Ang-3蛋白的结果( 图1) Ang-3 的蛋白表达量肿瘤组(1. 5901 ± 0.1189)明显高于对照组(0. 9054 ±0.0523)和吸烟组(1.2724 ±0.1493),差异有统计学意义(P <0.05);吸烟组和SE 组(1.4282 ±0.0793)也高于对照组(P <0.05),但吸烟组与SE 组之间及肿瘤组与SE 组之间比较,差异无统计学意义。
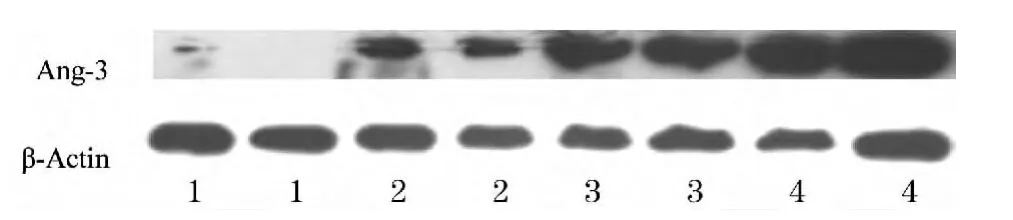
图1 各组小鼠肺组织Ang-3 蛋白表达
3 讨论
从基因芯片检测结果中选择了4 条上调基因Ang-3、Arg-2、H2-Ea 和H2-D1,应用荧光实时定量PCR 检测其在吸烟所致小鼠肺癌组织中mRNA 的表达水平。对于这4 条基因的功能研究目前较少。Ang-3 是新近发现的Ang 家族成员之一[6],在小鼠多种组织细胞内都有表达,其确切功能尚不甚了解,也少见该基因与肺癌相关性的研究;H2-Ea 和Ifi203 为两种免疫反应类的基因,为组织化学复合物和干扰素类的物质;H2-Ea 仅见于1995 年的一篇相关报道,而基因Ifi203 的研究,局限于对其的细胞调控功能的研究,有关与肺癌的关系研究目前还未见报道;Arg-2 主要在肾和脑中发现,肝外Arg-2 转化活性还未被提及,有人提出它参与多肽、氨基酸和神经递质的合成即在巨噬细胞中与一氧化氮合酶竞争,但是它的作用还很少被明确[7];H2-D1基因的相关文章尚未查找到。
本实验结果显示,4 个基因Ang-3、Arg-2、H2-Ea 和H2-D1在肺癌组织中表达明显高于正常组织,结果表明这4 个基因可能作为肺肿瘤中癌基因的新候选基因或者作为促进肿瘤发生的新基因。本实验又重点选择Ang-3 进一步做western blot 检测分析其蛋白表达及其意义。实验结果显示,Ang-3的蛋白表达量肿瘤组明显高于对照组和吸烟组,吸烟组和SE 组也高于对照组,但吸烟组与SE 组之间无差别,这与PCR 结果几乎完全一致,表明Ang-3基因在吸烟所致小鼠肺癌组织中高表达,并且发现吸烟有促进Ang-3 表达的作用,而维生素E 并未抑制该作用。Ang-3 是Ang 家族的成员之一,目前,Ang 家族主要包括Ang-1、Ang-2、Ang-3、Ang-4 四种分子[6]。Ang 是新近发现的唯一含有受体激动剂和受体抑制剂的血管生长因子家族,它们的结构基本相同,都是由信号肽、N-端区域、卷曲螺旋结构域和类纤维蛋白原结构域等部分组成,Ang与它们的共同受体Tie-2 结合后而产生不同的作用。
目前,有关Ang 与肺癌的研究还很少。有研究证实,在肺癌实体及癌周组织中均存在Ang-1 的低表达,Ang-1 可能是通过发挥促进正常血管成熟和稳定而达到抑制肿瘤血管的作用[8]。这与文献[9]提到的Ang-1 在正常肺组织中或者在肺癌组织中高表达都有较好的预后结论基本吻合。在乳腺癌中发现有Ang-2 高表达[10]。大多数报道表明,Ang-2 基因在肺癌尤其是非小细胞肺癌中高表达[11,12]。Ang-2 在肺癌各期患者血清中均有较高表达,对肺癌的早期发现有一定作用,血清Ang-2表达水平与肿瘤转移、分期有关,对肺癌临床分期有帮助[13]。目前只观察到Ang-3 在人肺和人脐静脉内皮细胞(HUVECs)中表达,并受血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的调控。Motoi 等[14]研究显示:经VEGF 可上调人脐静脉内皮细胞中的Ang-3 表达,并下调Ang-2 表达。Xu 等[15]证实与Ang-1、Ang-2 不同,Ang-3是通过硫酸乙酰肝素蛋白聚糖(HSPGs)尤其是基底膜蛋白多糖系缚于细胞表面。结合了Ang-3 的细胞表面容易与受体Tie-2 结合;HSPGs 可能增强或调节Ang-3 的生物活性,也有可能是HSPGs 使Ang-3 集中在细胞表面并使Ang-3 暴露于其受体以引起特异的局部反应。诱导突变试验揭示,Ang-3 的卷曲螺旋结构域与其结合于细胞表面有重要关系。还有人证实Ang-2 和Ang-3 与Ang-1 竞争结合Tie-2 并阻碍Ang-1 引起的Tie-2 磷酸化[16]。但Ang-3 如何影响内皮细胞行为以及如何调节其生物活性有待于进一步证实。Ang-3 的生物学功能还不十分明了,其与肺癌的关系更是罕见报道。Xu 等[17]最近发现Ang-3 抑制内皮细胞的再生及存活并能通过与Ang-1 竞争性结合Tie-2来阻碍Ang-1-和VEGF-诱导的Erk1/2 和Akt激酶活性。Ang-3 的过量表达通过抑制肿瘤血管生成和促进肿瘤细胞凋亡来抑制Lewis 肺癌和乳腺癌的肺转移。尽管这提示Ang-3 可能抑制癌转移,但并不能解释Ang-3 与肺癌的关系。Thijssen等[18]将卵巢癌细胞种植到裸鼠体内从而得到种植瘤,通过检测后,发现Ang-3 在非肿瘤细胞内是上调的。本实验首次证明了吸烟能够促进Ang-3 mRNA 及蛋白的表达,并且在吸烟所致肺癌组织中是过表达的。
本次实验,笔者通过基因芯片技术检测出小鼠全基因组表达谱,再通过荧光实时定量PCR 及western blotting 证实吸烟能明显导致Ang-3 mRNA及蛋白的高表达,并且,Ang-3 在肿瘤组织中表达最高,表明Ang-3 在吸烟所致小鼠肺癌的发生过程中是活跃因素,起了一定的促进作用。肿瘤持续性生长和转移需要新生血管的形成。在肿瘤新生血管形成的影响因素中,最有效和特异的因子就是VEGF,VEGF 通过促进新生血管的形成加速了非小细胞肺癌的侵袭和转移[19]。那么,Ang-3 作为血管生长因子家族之一,其与吸烟以及Ang-3 与肺癌的关系如何尚需要临床实验的进一步检测证实。如果,Ang-3 在人肺癌中显示高表达,那么Ang-3将与Ang-1、Ang-2 一样将成为指示肺癌预后的影响因子。
[1] 钟文昭,吴一龙. 吸烟和肺癌的遗传易感性[J]. 循证医学,2009,9(4):201-205.
[2] 刘 涛,李若葆. 长期吸烟对肺癌组织TGF-β1、VEGF-C 表达的影响及临床意义[J]. 实用医药杂志,2010,27(11):961-964.
[3] 杨 杰,袁振丽,姜丽娜,等. 昆明小鼠被动吸烟肺癌模型的建立[J]. 解放军预防医学杂志,2006,24(2):99-102.
[4] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25:402-408.
[5] ZHANG Suolian,CHEN Zhaoli,YANG Jie,et al. Angiopoietin-3 overexpression in tobacco smoke-induced mouse lung tumors and its relation to vitamin E intervention[J]. Mol Med Rep,2008(1):729-733.
[6] Valenzuela D M,Griffiths J A,Rojas J,et al. Angiopoietin 3 and 4:diverging gene counterparts in mouse and humans[J]. Proc Natl Acad Sci USA,1999,96(5):1904-1909.
[7] Buga G M,Singh R,Pervin S,et al. Arginase activity in endothelial cells:inhibition by NG-hydroxy-L-arginine during high-output NO production[J]. Am J Physiol,1996,271(5Pt2):H1988-1998.
[8] 何胜利,董竞成,王中吉,等. 促血管生成素1、2 及Tie-2 受体mRNA 在肺腺癌中的表达[J]. 中华结核和呼吸杂志,2003,26(5):317-318.
[9] Reinmuth N,Piegelbrock E,Raedel M,et al. Prognostic significance of vessel architecture and vascular stability in non-small cell lung cancer[J]. Lung Cancer,2007,55:53-60.
[10] 张兰胜,陈冬渡,贾晓民,等. 血管生成素-2/受体-2 在乳腺癌中的表达及在血管新生中的可能作用[J]. 现代肿瘤医学,2012,20(5):964-966.
[11] Takanami I. Overexpression of Ang-2 mRNA in nonsmall cell lung cancer:association with angiogenesis and poor prognosis[J]. Oncol Rep,2004,12:849-853.
[12] Park J H,Park K J,Kim Y S,et al. Serum angiopoietin-2 as a clinical marker for lung cancer[J]. Chest,2007,132:200-206.
[13] 李成德,蔡健梅,陈 珊,等. 血清血管生成素-2 定量检测在肺癌患者诊断应用中的价值[J]. 中华临床医师杂志(电子版),2012,6(10):2585-2588.
[14] Nishimura M,Miki T,Yashima R,et al. Angiopoietin-3,a novel member of the angiopoietin family[J].FEBS lett,1999,448(2-3):254-256.
[15] Yin Xu,Yaojuan Liu,Qin Yu. Angiopoietin-3 is tethered on the cell surface via heparan sulfate proteoglycans[J]. Cancer Res,2004,279(39):41179-41188.
[16] Yancopoulos G D,Davis S,Gale N W,et al. Vascular- specific growth factors and blood vessel formation[J]. Nature,2000,407(6801):242-248.
[17] Yin Xu,Yaojuan Liu,Qin Yu. Angiopoietin-3 inhibits pulmonary metastasis by inhibiting tumor angiogenesis[J]. Cancer Res,2004,64(17):6119-6126.
[18] Thijssen V L,Brandwijk R J,Dings R P,et al. Angiogenesis gene expression profiling in xenograft models to study cellular interactions [J]. Exp Cell Res,2004,299:286-293.
[19] 许学亮,邵红玲. STAT5、VEGF 和EGFR 在非小细胞肺癌中表达的相关性研究[J]. 中国免疫学杂志,2012,6(17):555-559.

