甘蓝型油菜WRI1 基因cDNA 的克隆与序列分析
施春霖,刘聪,肖旦望,陈社员,官春云,熊兴华
(作物基因工程湖南省重点实验室,湖南 长沙 410128)
植物油不仅是人类饮食的主要组成部分,还在工业和生物能源上有很好的应用和发展前景[1]。由于种子含油量是受多基因控制的,长期以来利用调控种子脂肪酸代谢中的关键酶基因来达到提高含油量的效果并不理想,但通过转录因子对相关代谢途径的1 组基因进行遗传修饰,可以更有效地达到提高含油量的目的[2]。种子的胚胎发育和脂肪酸代谢途径涉及许多复杂的过程,这些过程都受到许多转录因子的调控[3–7],这些转录因子相互之间存在联系,形成1 个调控网络,共同调控种子胚的发育和成熟以及油脂的形成[8]。Focks 等[9]采用梯度离心筛选出了1 个低含油量、种皮发皱的突变体wri1,图位克隆发现,控制该性状的基因WRI1 编码1 个DNA 结合转录因子,功能缺失时致使含油量降低80%,而过表达却使含油量提高20%左右。对WRI1 突变体进行生物化学分析显示,突变体中几种糖酵解酶,比如质体丙酮酸激酶、酰基载体蛋白(ACP)、3–酮酯酰–ACP 合成酶、烯酯酰–ACP 还原酶等活性明显低于野生型水平的。这些在WRI1 突变体中表达水平低的基因,多数是参与脂肪和糖酵解的基因,而且它们的积累模式与种子油的一致,这说明WRI1 很可能调控这些基因的表达。Cernac 等[6]和Masaki 等[10]的研究都证明了这一假设。Baud 等[11]的研究还发现了WRI1 新的靶基因,包括脂肪酸合成酶基因、硫辛酸和生物素合成途径相关酶基因,但内质网的脂肪酸脱氢酶和延伸酶基因不受WRI1 的调控,暗示着WRI1 基因可能在控制种子发育和油脂积累过程中起着关键性作用。后来一系列的研究[12–16]发现,WRI1 基因确实在油脂的合成方面起着重要作用。To等[13]的研究发现,拟南芥中存在多拷贝WRI1 基因,且部分WRI1 基因拷贝对油脂的合成调控作用不明显。另外,由于甘蓝型油菜(B. napus,2n=38,AACC)起源于白菜(B. rapa,2n=20,AA)和甘蓝(B.oleracea,2n=18,CC)的天然杂交和染色体组自然加倍,因此,甘蓝型油菜中可能存在不同WRI1 基因,且对含油量的影响可能不同。笔者以甘蓝型油菜湘油15 号为材料,克隆甘蓝型油菜的WRI1 基因,并对序列进行分析,旨在有目的地调控该转录因子基因,为培育高含油量的油菜品种提供便利。
1 材料与方法
1.1 供试材料
甘蓝型油菜湘油15 号(Brassica napus,2n=38,AACC),由国家油料改良中心(湖南)提供;矮脚小白菜(B. rapa,2n=20,AA)、强夏甘蓝(B.oleracea,2n=18,CC),由植物病虫害防治湖南省重点实验室提供;大肠杆菌DH5α 由作物基因工程湖南省重点实验室保存。
1.2 主要试剂及仪器
主要试剂:EASYspin 植物RNA 快速提取试剂盒及TUREscript 1stStrand cDNA Synthsis Kit 试剂盒,购自北京艾德莱生物科技有限公司;高保真Pfu及EasyPure Quick Gel Extraction Kit 切胶回收试剂盒,购自北京全式金生物科技有限公司;连接载体pMD18–T Simple Vector 及相关限制性内切酶,购自Takara 生物技术有限公司。
主要仪器:Eppendorf Centrifuge 5804R 台式冷冻高速离心机;MiKRO 220R 高速离心机;UV–1700 PharmaSpec 紫外分光光度计;Pharmacia MultiTemp Ⅲ恒温水浴锅;HIRAYAMA 全自动高温灭菌锅;MJ Research PTC–200 PCR 仪。
1.3 总RNA 提取和第一链cDNA 合成
按EASYspin植物RNA快速提取试剂盒的操作说明从供试材料单株单片新鲜叶中提取总RNA。按照TUREscript 1stStrand cDNA Synthsis Kit 的操作说明,以提取的总RNA 为模板,反转录合成第一链cDNA。
1.4 引物设计与PCR 扩增
以 GenBank WRI1 mRNA 全长编码序列(DQ370141)为参考,利用Primer 5.0 设计引物FW:下划线部分分别为Bam HI 位点和Sac I 位点。分别以3 种供试材料的第一链cDNA 为模板,进行PCR 扩增。PCR反应体系为20 μL,包括cDNA 模板2 μL,10×Buffer 2 μL,2.5 mmol/L dNTPs 2 μL,引物各1 μL,5 U/μL 高保真Pfu 0.5 μL,ddH2O11.5 μL。PCR 扩增程序为:94 ℃预变性3 min,94 ℃变性40 s,50 ℃退火40 s,72 ℃延伸100 s,30 个循环,72 ℃延伸10 min。反应终止后,取PCR 产物在1.0%的琼脂糖凝胶上电泳检测。用切胶回收试剂盒回收目的条带,用于载体连接反应。
1.5 载体连接与测序
将回收产物连接至pMD18–T Simple Vector,连接体系为10 μL,包括回收产物3 μL,pMD18-T Simple Vector 1 μL,Solution I 5 μL,ddH2O 1 μL,16 ℃连接1 h。采用热激法将连接产物转化至大肠杆菌,筛选阳性克隆。取阳性克隆送北京六合华大基因科技股份有限公司测序。
1.6 序列分析与酶切检测
采用DNAman 进行序列比对,分析WRI1 基因编码序列的单核苷酸变异;采用CLUSTAL X,MEGA5.0 软件进行聚类系谱分析;采用Primer 5.0进行酶切位点分析;采用DNAman 进行可以识别A和C 基因组来源WRI1 的特异性酶切位点分析,用所得到的该内切酶酶切检测3种供试材料的PCR产物;采用双酶切检测酶切位点变异的真实存在。
2 结果与分析
2.1 WRI1 基因mRNA 全长编码序列的克隆
3 种供试材料均扩增出大小约为1.3 kb 的PCR产物,与目的片段大小一致(图1)。将PCR 产物连接到PMD18–TSimple Vector 载体上,转化大肠杆菌DH5α,阳性菌落经PCR 检测,从湘油15 号筛选出 5 个阳性克隆,分别命名为 BnWRI1–1,BnWRI1–2,BnWRI1–3,BnWRI1–4 和BnWRI1–5;矮脚小白菜与强夏甘蓝各筛选出1 个阳性克隆,分别命名为BraWRI1 和BoWRI1。测序结果显示,BnWRI1–1 和 BraWRI1 的大小为 1 248 bp,BnWRI1–2 和 BnWRI1–3 的大小为 1 254 bp,BnWRI1–4、BnWRI1–5 和BoWRI1 的大小为1 242 bp。重复测序1 次,结果一致。
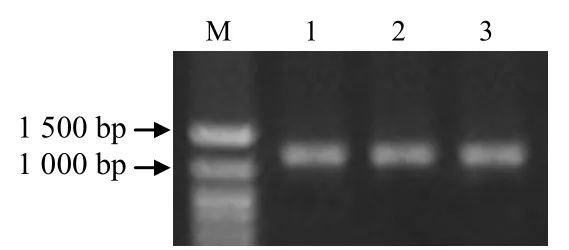
图1 白菜、甘蓝、甘蓝型油菜WRI1 基因编码序列PCR 扩增结果Fig.1 PCR amplification of WRI1 cDNA from Brassica rapa,Brassica oleracea and Brassica napus
2.2 WRI1 基因cDNA 序列的比对结果
序列比对分析结果(表1)显示,克隆所得的WRI1 基因编码序列共发现41 个单核苷酸的变异。BnWRI1–4、BnWRI1–5 在826 位和870 位分别存在9 个碱基和3 个碱基的缺失,BnWRI1–1 在1 217 到1 222 位存在6 个碱基的缺失。通过对测序结果所编码的氨基酸序列进行分析,发现这些碱基的缺失导致BnWRI1–4、BnWRI1–5 所编码的氨基酸序列存在4 个氨基酸的缺失,BnWRI1–1 存在2 个氨基酸的缺失。这种序列上的变化是否会造成该蛋白存在调控方面的差异,还有待进一步研究。

表1 WRI1 编码序列单核苷酸变异位点分布Table 1 SNPs in the coding sequences of the cloned WRI1
2.3 WRI 基因cDNA 序列系谱聚类分析
系谱聚类分析结果(图2)显示,所克隆WRI1 基因cDNA 在进化关系上同拟南芥AtWRI1 (At3G54320)同处1 个分支,进化关系最近,且BnWRI1–1、BnWRI1–2、BnWRI1–3 与克隆自矮脚小白菜的BraWRI1 被聚为一类,BnWRI1–4、BnWRI1–5 与克隆自强夏甘蓝的BoWRI1 被聚为另外一类,且白菜和甘蓝均存在和拟南芥其他几个WRI1 基因拷贝相似的基因序列。由此可见,甘蓝型油菜湘油15 号中可能有分别来源于A 基因组和C 基因组的WRI1基因,并且A 基因组与C 基因组也可能存在不同WRI1 基因拷贝。
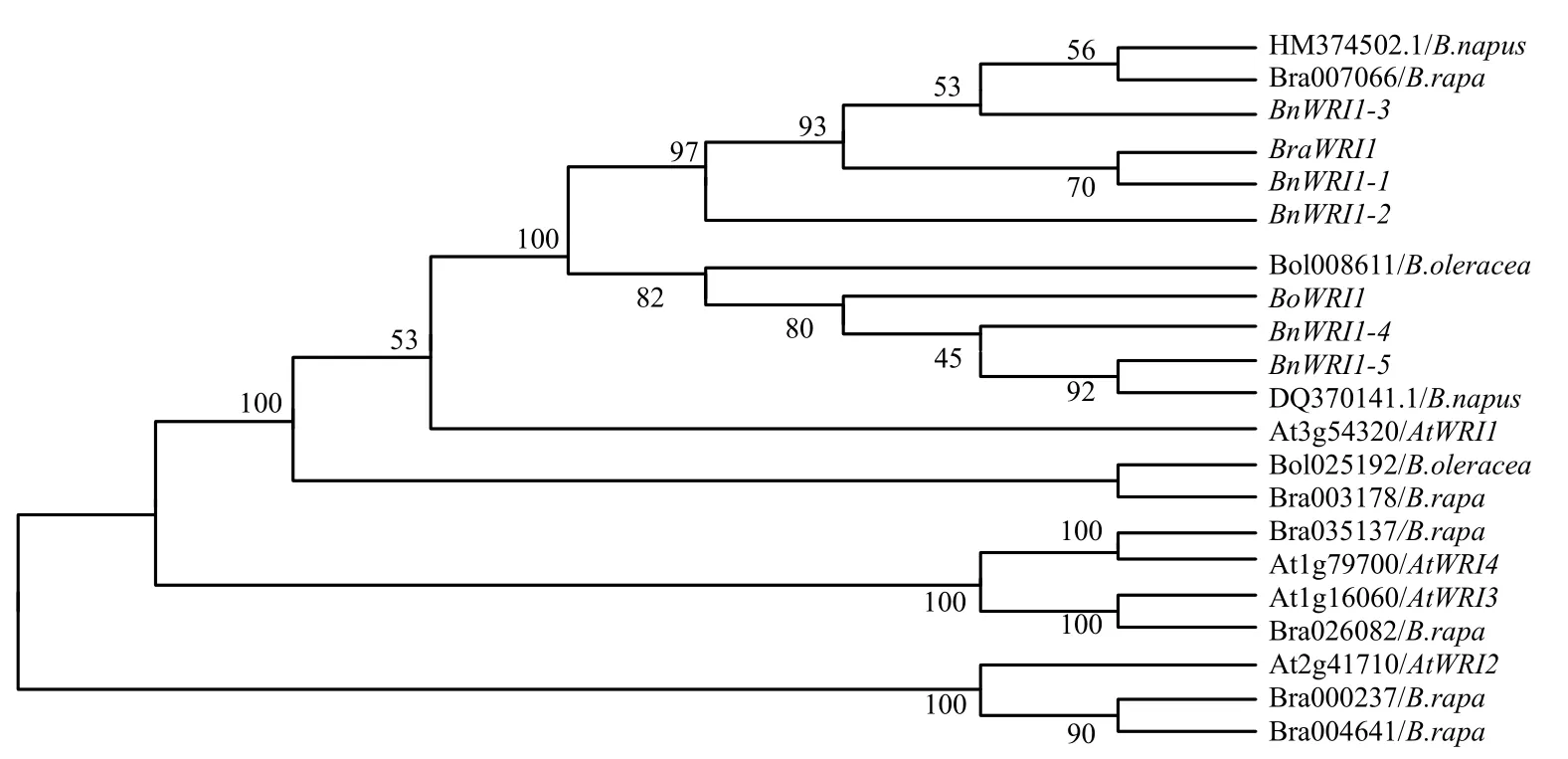
图2 白菜、甘蓝、甘蓝型油菜和拟南芥AP2–Like WRI1 基因编码序列的聚类系谱Fig.2 Cladogram of AP2–Like WRI1 coding sequences from Brassica rapa,Brassica oleracea,Brassica napus and Arabidopsis thaliana
2.4 WRI1基因cDNA特异性酶切位点分析及酶切检测结果
序列比对和酶切位点分析结果显示,来源于A基因组的 BraWRI1、BnWRI1–1、BnWRI1–2 和BnWRI1–3 第892 位核苷酸为鸟嘌呤(G),而来源于C 基因组的BoWRI1、BnWRI1–4 和BnWRI1–5 第880位核苷酸为腺嘌呤(A)。该变异导致甘蓝和甘蓝型油菜 C 基因组 WRI1 基因编码序列中有 Bcl I (TGATCA)识别位点,而白菜和甘蓝型油菜A 基因组WRI1 编码序列没有BclI 识别位点(图3)。以内切酶BclI 酶切3 种供试材料纯化后的PCR 产物,1.5%琼脂糖凝胶电泳检测显示,湘油15 号的WRI1 基因编码序列 PCR 产物被切成3 个片段,强夏甘蓝的WRI1 基因编码序列PCR 产物被切成2 个片段,而矮脚小白菜的WRI1 基因编码序列PCR 产物没有被切开(图4)。提取阳性克隆质粒(连接至pMD18–T Simple vector)并依照图5 示意方法作双酶切检测,结果如图 6 所示。由此证明了不同基因组AtWRI1–Like WRI1 基因突变位点的真实存在,并且可以利用核酸内切酶Bcl I 区分甘蓝型油菜A 和C基因组AtWRI1–Like WRI1 基因。

图4 甘蓝型油菜、甘蓝、白菜WRI1 的PCR产物Bcl I 酶切检测结果Fig.4 Digestion of WRI1 cDNAs from Brassica napus,Brassica oleracea and Brassica rapa by Bcl I
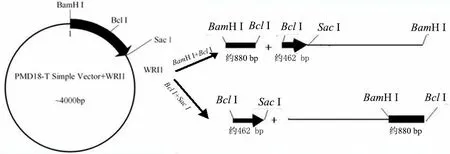
图5 双酶切检测示意图Fig. 5 Schematic diagram of double digests
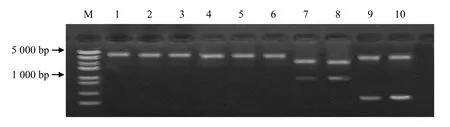
图6 阳性克隆的双酶切检测结果Fig.6 Identification of WRI1 cDNAs from Brassica napus with double digests
3 结论与讨论
提高油菜种子含油量是现今乃至将来育种工作的重要目标。通过常规育种手段选育出了许多高含油量、高品质的油菜品种[17–21]。笔者从现今广泛推广种植的甘蓝型双低油菜品种湘油15 号中克隆出的WRI1 基因编码序列是以GenBank WRI1 全长编码序列DQ370141 为模板设计得到的引物,经PCR 扩增。扩增产物序列与拟南芥AtWRI1 相似。序列分析发现,BnWRI1–1、BnWRI1–2、BnWRI1–3与矮脚小白菜WRI1 基因编码序列BraWRI1 来源相同。另外,BnWRI1–4、BnWRI1–5 与强夏甘蓝WRI1基因编码序列BoWRI1 来源相同。不同来源的WRI1序列上存在差异。聚类分析结果显示,分属A 基因组和C 基因组的白菜和甘蓝均存在和拟南芥另外3个WRI1 基因拷贝相似的基因序列,而甘蓝型油菜含有A 组和C 组2 种基因型的染色体,由此推测甘蓝型油菜也可能存在不同的WRI1 基因拷贝,并且有不同的基因组来源,对脂肪酸合成调控作用也可能各有不同;因此,获得并区分能高效提高含油量的WRI1 基因具有重要的现实意义。限制性内切酶Bcl I 的酶切结果不仅证实了突变位点的真实存在,还为区分甘蓝型油菜AtWRI1–Like WRI1 基因的A和C 基因组的来源提供了新的方法。然而,对基因功能的研究还需进一步利用转基因手段来验证。WRI1 基因的克隆和序列分析将对甘蓝型油菜该转录因子的研究提供素材,并为进一步的转基因研究和应用打下基础。
[1]Rogalski M,Carrer H.Engineering plastid fatty acid biosynthesis to improve food quality and biofuel production in higher plants[J].Plant Biotechnology Journal,2011,9(5):554–564.
[2]夏晗,王兴军,李孟军,等.利用基因工程改良植物脂肪酸和提高植物含油量的研究进展[J].生物工程学报,2010,26(6):735–743.
[3]Meinke D W,Franzmann L H,Nickle T C,et al.Leafy cotyledon mutants of Arabidopsis[J].The Plant Cell Online,1994,6(8):1049–1064.
[4]Stone S L,Kwong L W,Yee K M,et al.LEAFY COTYLEDON2 encodes a B3 domain transcription factor that induces embryo development[J].Proceedings of the National Academy of Sciences , 2001 , 98(20) :11806–11811.
[5]Gazzarrini S,Tsuchiya Y,Lumba S,et al.The transcription factor FUSCA3 controls developmental timing in Arabidopsis through the hormones gibberellin and abscisic acid[J].Developmental Cell,2004,7(3):373–385.
[6]Cernac A,Andre C,Hoffmann-Benning S,et al.WRI1 is required for seed germination and seedling establishment[J]. Plant Physiology,2006,141(2):745– 757.
[7]Parcy F,Valon C,Raynal M,et al.Regulation of gene expression programs during Arabidopsis seed development:Roles of the ABI3 locus and of endogenous abscisic acid[J].The Plant Cell Online,1994,6(11):1567–1582.
[8]Santos-Mendoza M,Dubreucq B,Baud S,et al. Deciphering gene regulatory networks that control seed development and maturation in Arabidopsis[J].The Plant Journal,2008,54(4):608–620.
[9]Focks N,Benning C.Wrinkled1:A novel,low-seed-oil mutant of Arabidopsis with a deficiency in the seed- specific regulation of carbohydrate metabolism[J]. Plant Physiology,1998,118(1):91–101.
[10]Masaki T,Mitsui N,Tsukagoshi H,et al.Activator of spomin:LUC1/WRINKLED1 of Arabidopsis thaliana transactivates sugar-inducible promoters[J].Plant and Cell Physiology,2005,46(4):547–556.
[11]Baud S,Mendoza M S,To A,et al.WRINKLED1 specifies the regulatory action of LEAFY COTYLED- ON2 towards fatty acid metabolism during seed maturation in Arabidopsis[J].The Plant Journal,2007,50(5):825–838.
[12]Maeo K,Tokuda T,Ayame A,et al.An AP2 type ‐transcription factor,WRINKLED1,of Arabidopsis thaliana binds to the AW-box sequence conserved among proximal upstream regions of genes involved in fatty acid synthesis[J].The Plant Journal,2009,60(3):476–487.
[13]To A,Joubès J,Barthole G,et al.WRINKLED transcription factors orchestrate tissue-specific regulation of fatty acid biosynthesis in Arabidopsis[J].The Plant Cell Online,2012,24(12):5007–5023.
[14]柴国华,白泽涛,蔡丽,等.油菜基因 BnWRI1 的克隆及 RNAi 对种子含油量的影响[J].中国农业科学,2009,42(5):1512–1518.
[15]Shen B,Allen W B,Zheng P,et al.Expression of ZmLEC1 and ZmWRI1 increases seed oil production in maize[J].Plant Physiology,2010,153(3):980–987.
[16]Pouvreau B,Baud S,Vernoud V,et al.Duplicate maize wrinkled1 transcription factors activate target genes involved in seed oil biosynthesis[J].Plant Physiology,2011,156(2):674–686.
[17]官春云,王国槐.油菜品质育种的研究Ⅱ.双低油菜湘油 11 号的选育[J].湖南农业大学学报(原湖南农学院学报):自然科学版,1989,15(2):20–24.
[18]陈社员,官春云.双低油菜品种湘油 13 号选育及品种特性研究[J].湖南农业大学学报:自然科学版,1998,24(4):277–281.
[19]陈社员,官春云,王国槐,等.双低油菜新品种湘油 15 号的选育[J].湖南农业大学学报:自然科学版,2003,29(2):103–105.
[20]侯国佐,杜才富,侯燕,等.“三高两低”杂交油菜油研九号的选育与推广应用[J].贵州农业科学,2009,37(2):1–4.
[21]鲁坤存,刘淑艳,郭家保,等.芥甘杂交选育甘蓝型黄籽油菜的研究[J].湖南农业大学学报:自然科学版,2006,32(2):116–119.

