盐酸利多卡因纳米高分子脂质体的制备与体外透皮实验研究*
李雨辰 曹 岩 王 悦 王汉杰 李 芹 李长义 张连云
镇痛是牙科治疗的基础,目前通过表面涂布的方法以达到无痛局麻的相关研究少见。盐酸利多卡因起效快、维持时间长,但渗透力较差,不能直接作为表面麻醉剂使用。本课题组前期已成功制备了新型阳离子赖氨酸壳聚糖十八烷基季铵盐(OQLCS)/胆固醇(chol)纳米高分子脂质体[1],制备方法简单,稳定性好[2],药物包封率高,具有良好的控释功能[3]。目前国内外亦少见应用OQLCS包载盐酸利多卡因进行牙科无痛治疗的相关报道。本研究使用OQLCS/chol包载盐酸利多卡因制备纳米高分子脂质体(LID-PLs),并比较其与盐酸利多卡因注射液(LID-IJ)和盐酸利多卡因传统脂质体(LID-CLs)体外透皮渗透情况的差异,初步探讨盐酸利多卡因纳米高分子脂质体作为口腔表面麻醉剂的可能性。
1 材料与方法
1.1 材料 SPF级昆明种小鼠24只,雌雄不拘,体质量(25±2)g,由天津医科大学动物实验中心提供。Agilent 1100高效液相色谱仪(美国Agilent),RYJ-6A型药物透皮扩散实验仪(上海黄海药检仪器有限公司),RE-52A型旋转蒸发仪(上海亚荣生化仪器厂),透射电子显微镜(JEOL2100CXⅡ,日本),激光粒度仪/Zeta电位仪(BI90plusBrookhaven Instruments Cor⁃poration,美国),PB153-S精密分析天平(METTLER TOLE⁃DO,瑞士)。盐酸利多卡因(纯度>99.0%,山西新宝源医药有限公司,批号:20110520),OQLCS(天津大学材料学院纳米生物技术研究所自制),胆固醇(天津市光复精细化工研究所),盐酸利多卡因注射液(规格:0.1 g/5 mL,批号20110312,上海禾丰制药有限公司),甲醇为色谱纯,二氯甲烷、磷酸二氢钾均为市售分析纯。
1.2 LID-PLs的制备 参照文献[4]采用反相蒸发法。用激光粒度仪/Zeta电位仪测试载药纳米粒子的粒径为(61.2±8.14)nm,多分散性指数为0.184±0.023,Zeta电位为(6.51±2.05)mV,采用葡萄糖凝胶柱层析法测定包封率为(70.5±3.2)%(n=5)。
1.3 LID-CLs的制备 仅使用磷脂替代OQLCS,其他方法同上。测得的粒径为(219±7.51)nm,多分散性指数为0.30±0.03,Zeta电位为(0.75±0.78)mV(n=5)。采用葡萄糖凝胶柱层析法测定包封率为(62.1±4.3)%(n=5)。
1.4 高效液相色谱法(HPLC)测定盐酸利多卡因浓度的方法学建立 (1)色谱条件。色谱柱:Agilent zorbax SB-C18色谱柱(150 mm×4.6 mm,5 μm);流动相:甲醇-0.01M磷酸二氢钠(V∶V=75∶25);流速:1.0 mL/min;柱温:35 ℃;检测波长:260 nm;进样量20 μL。(2)专一性考察。分别将空白纳米高分子脂质体、盐酸利多卡因对照品溶液、盐酸利多卡因纳米高分子脂质体、空白透皮接收液、透皮接收液样本进样,在上述色谱条件下测定,考察该HPLC检测方法的专一性。(3)标准曲线的制备。精密称取干燥的盐酸利多卡因25 mg于25 mL容量瓶中,加双蒸水溶解并稀释到刻度,制成浓度为1 g/L的储备溶液。采用倍半稀释法,精密配制0.5、1、5、10、50、100 及500 mg/L的盐酸利多卡因系列标准溶液,按照上述色谱条件进行测定。以盐酸利多卡因的峰面积为横坐标,浓度为纵坐标进行线性回归,求得盐酸利多卡因的标准曲线方程。(4)精密度实验。使用标准曲线项下制备的盐酸利多卡因储备溶液,分别配制1、50、500 mg/L的低、中、高3个浓度的盐酸利多卡因标准溶液,分别于同日内测定5次,计算日内精密度;每日测定1次,连续测定5日,计算日间精密度。其日内精密度0.51%~1.01%,日间精密度0.86%~1.35%。(5)回收率实验。使用标准曲线项下制备的盐酸利多卡因储备溶液,分别配制1、50及500 mg/L的低、中、高3个浓度的盐酸利多卡因标准溶液,分别测定5次,将峰面积代入标准曲线计算出药物浓度,与理论浓度比较,计算回收率。其回收率为99.5%~102.2%。
1.5 体外透皮实验 (1)离体皮肤的制备。取24只小鼠脱颈处死后剥离皮肤,立即用电推剃除腹部毛,注意不伤及角质层,按扩散池大小(外直径2.75 cm)剪取脱毛后皮肤,除尽皮下黏膜及脂肪组织,用蒸馏水、生理盐水反复洗至无白色混浊,浸于生理盐水中,置冰箱4 ℃保存,24 h内使用[5]。(2)实验分组。按干预方式不同分为空白组、LID-PLs组、LID-CLs组及LID-IJ组,每组6只小鼠。(3)体外透皮实验。将离体鼠皮恢复至室温,用生理盐水冲洗后,用滤纸吸干表面液体,置于Franz扩散池(有效释药面积为2.27 cm2,接收室容积为7 mL)的供给室与接收室之间,角质层朝向供给室。接收室中加满pH值为6.8的PBS溶液作为接收介质,排尽气泡,使接收液与皮肤紧密接触。接受介质温度为(37±0.5)℃,磁力搅拌速度为400 r/min。各组分别在供给室中加入0.5 mL双蒸水、LID-PLs、LID-CLs或 LID-IJ,分别于实验开始后5 min、10 min、30 min、1 h、1.5 h、2 h、4 h、6 h、8 h、12 h、24 h从接收室取样管精密吸取400 μL接收液(同时补充等量等温PBS溶液),接收液经0.45 μm微孔滤膜过滤后,取20 μL滤液进样测定,将峰面积代入标准曲线计算药物浓度,按以下公式计算各时间点的单位面积累积透过量(Q,μg/cm2)[6]。
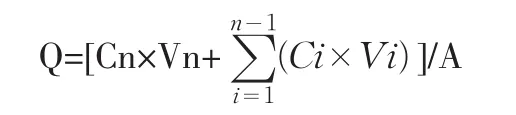
式中Cn为第n个取样点测得的药物浓度,单位为mg/L;Ci为第i个取样点的药物浓度,单位为mg/L;Vn为接收室中接收液的总体积;Vi为取样体积,本实验取值为0.4 mL;A为透皮面积。
1.6 统计学方法 采用SPSS 16.0软件进行统计学分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间的两两比较:方差齐采用LSD-t法,方差不齐采用Dunnett’s T3检验,P<0.05为差异有统计学意义。
2 结果
2.1 HPLC专一性检测及标准曲线计算结果 盐酸利多卡因峰形良好,无杂质峰干扰。盐酸利多卡因的保留时间为3.899 min,空白纳米高分子脂质体、空白透皮接收液对盐酸利多卡因的测定均无影响,见图1。以盐酸利多卡因的峰面积为横坐标,浓度为纵坐标进行线性回归,得到盐酸利多卡因的标准曲线方程为=0.051X-2.701,r=0.999 9,在(0.5~500)mg/L线性关系良好。
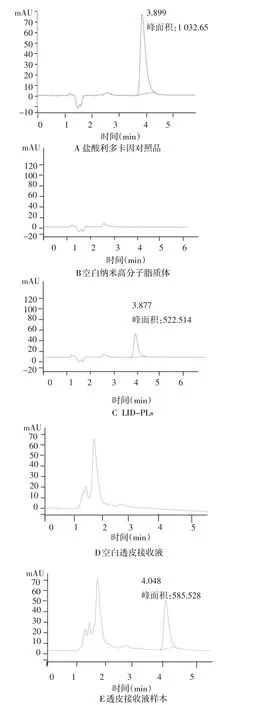
Figure 1 HPLC chromatograms of lidocaine hydrochloride图1 盐酸利多卡因高效液相色谱图
2.2 体外透皮实验 空白组体外透皮各时间点的接收液中均无盐酸利多卡因的特征吸收峰。各组在各时间点的体外透皮平均累积透过量差异均有统计学意义(P<0.05)。LID-PLs组在各时间点的平均累积透过量均高于LID-IJ组(P<0.05或P<0.01)。LID-PLs组在5 min、10 min、30 min、2 h、4 h、6 h、8 h、12 h及24 h的平均累积透过量均高于LID-CLs组(P<0.05或P<0.01)。LID-CLs组在10 min、30 min、1.5 h、2 h、4 h、6 h、8 h、12 h、24 h的平均累积透过量均高于LID-IJ组(P<0.05或P<0.01),见表1。
Table 1 The mean cumulative permeation of lidocaine in LID-PLs,LID-CLs and LID-IJ groups表1 LID-PLs、LID-CLs及LID-IJ组的平均累积透过量 (n=6,μg/cm2±s)
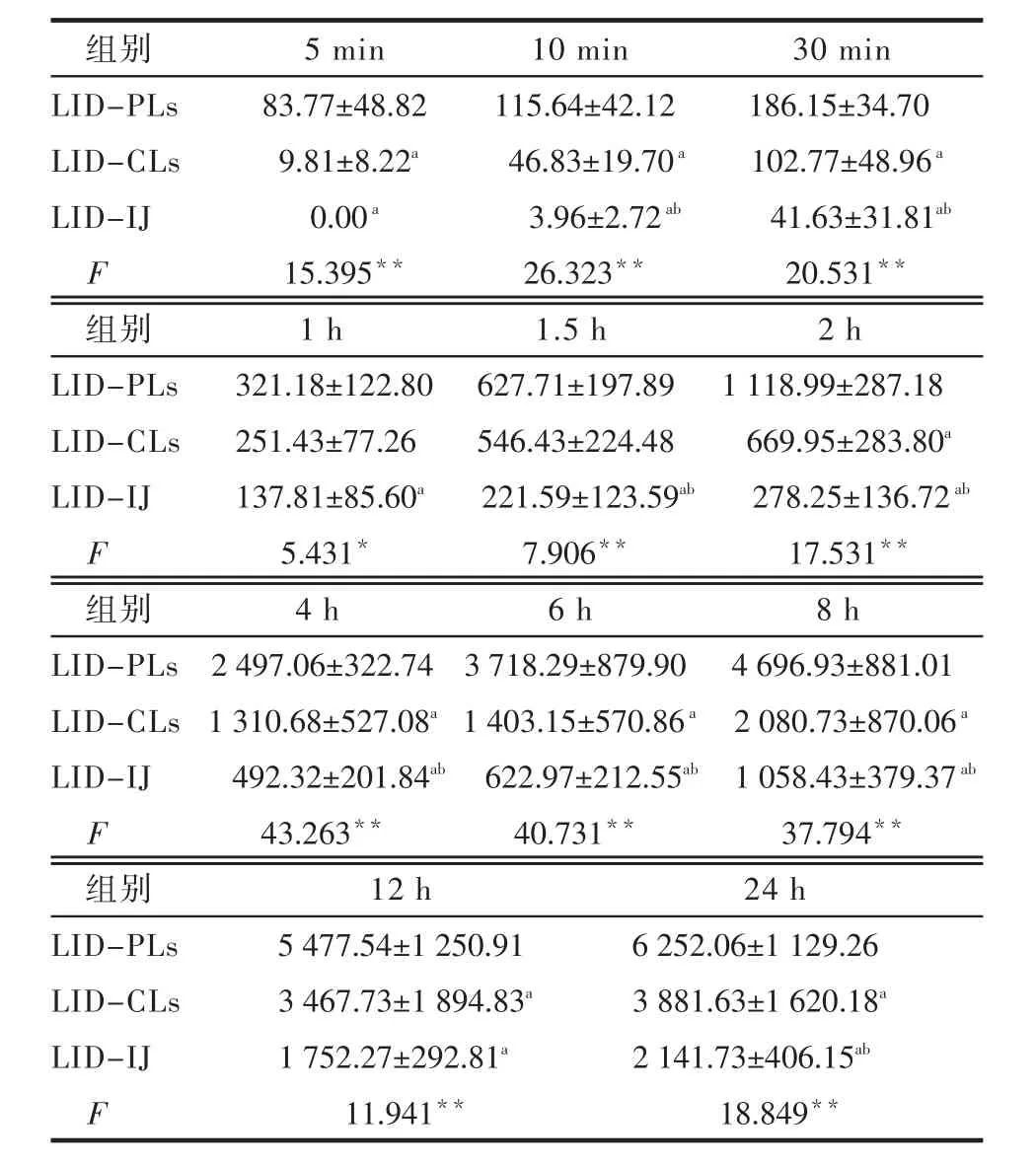
Table 1 The mean cumulative permeation of lidocaine in LID-PLs,LID-CLs and LID-IJ groups表1 LID-PLs、LID-CLs及LID-IJ组的平均累积透过量 (n=6,μg/cm2±s)
*P<0.05,**P<0.01;a与LID-PLs组比较P<0.05,b与LID-CLs组比较P<0.05
组别LID-PLs LID-CLs LID-IJ F 5 min 83.77±48.82 9.81±8.22a 0.00a 15.395**10 min 115.64±42.12 46.83±19.70a 3.96±2.72ab 26.323**30 min 186.15±34.70 102.77±48.96a 41.63±31.81ab 20.531**组别LID-PLs LID-CLs LID-IJ F 1 h 321.18±122.80 251.43±77.26 137.81±85.60a 5.431*1.5 h 627.71±197.89 546.43±224.48 221.59±123.59ab 7.906**2 h 1 118.99±287.18 669.95±283.80a 278.25±136.72ab 17.531**组别LID-PLs LID-CLs LID-IJ F 4 h 2 497.06±322.74 1 310.68±527.08a 492.32±201.84ab 43.263**6 h 3 718.29±879.90 1 403.15±570.86a 622.97±212.55ab 40.731**8 h 4 696.93±881.01 2 080.73±870.06a 1 058.43±379.37ab 37.794**组别LID-PLs LID-CLs LID-IJ F 12 h 5 477.54±1 250.91 3 467.73±1 894.83a 1 752.27±292.81a 11.941**24 h 6 252.06±1 129.26 3 881.63±1 620.18a 2 141.73±406.15ab 18.849**
3 讨论
OQLCS/chol纳米高分子脂质体是本课题组前期研究中制备的新型阳离子纳米高分子脂质体。壳聚糖是一种生物黏附性材料,具有生物可降解性、低细胞毒性以及独特的跨细胞膜能力,但在中性和生理pH值条件下不溶。利用赖氨酸对壳聚糖进行修饰,合成生理条件下水溶的赖氨酸壳聚糖,壳聚糖主链上引入了赖氨酸分子,增加了分子中氨基(-NH2)含量[7]。OQLCS是赖氨酸修饰的壳聚糖衍生物,因其表面带有正电荷,可增加与生理条件下带负电的细胞和皮肤表面的亲和力,增强药物渗透能力[8]和药物控释能力[9],是制作透皮给药的理想材料。
本研究显示随着透皮时间越长,3种药物的平均累积透过量总的趋势LID-PLs>LID-CLs>LID-IJ,表明LID-PLs较LID-CLs、LID-IJ在渗透量方面有明显的优势,且透皮速度较快,给药后5 min即有较多药物透过,而LID-IJ在5 min时没有药物透过,或可忽略不计,LID-PLs 24 h累积透过总量也高于LID-CLs和LID-IJ,表明OQLCS包载盐酸利多卡因可促进盐酸利多卡因的透皮速度和透皮量。粒径可影响药物的透皮量。有研究报道,使用包载荧光物质的脂质体研究透皮渗透情况结果显示,粒径为120 nm左右的脂质体,透皮作用比粒径为250 nm左右的脂质体明显增强[10]。本研究使用纳米技术,将OQLCS替代磷脂,LID-PLs和LID-CLs相比,其粒径更小(61.2±8.14 nm vs 219±7.51 nm),包封率更高,更有利于药物的透皮渗透。本研究使用的HPLC方法专一性高,高分子纳米脂质体材料OQLCS/chol以及空白鼠皮的透过物质不干扰药物的测定,盐酸利多卡因在0.5~500 mg/L之间线性关系良好,精密度及回收率高,操作简便,满足了定量分析要求。
综上所述,本研究初步研究的LID-PLs的体外透皮情况结果表明,与LID-CLs和LID-IJ相比,LID-PLs更容易透皮,且透皮速度快,利多卡因的透过量高,可为进一步研究经皮肤或黏膜给药的新型表面麻醉剂提供参考。
[1]Wang H,Zhao P,Liang X,et al.Construction of a novel cationic polymeric liposomes formed from PEGlatedoctadecyl-quaternized lysine modified chitosan/cholesterol for enhancing storage stability and cellular uptake efficiency[J].Biotechnol Bioeng,2010,106(6):952-962.
[2]李双艳,郝丽娟,韩磊,等.赖氨酸修饰壳聚糖磁性超微载体的制备和表征[J].高分子通报,2007,20(7):32-40.
[3]Liang XF,Wang HJ,Tian H.Properties of novel quaternizedcarboxy⁃methl chitosan with moisture absorption-retention abilities and drug loading capacity[J].Acta Phys Chim Sin,2008,24(2):223-229.
[4]赵明,李安民,常津,等.改性壳聚糖包载的磁性紫杉醇纳米微粒的制备及对恶性脑胶质细胞瘤的抑制作用[J].生物医学工程学杂志,2011,28(3):513-516.
[5]申明乐,王刚,李建成,等.司来吉兰贴片的制备及其体外透皮释放量的研究[J].中国新药杂志,2010,19(20):1907-1910.
[6]Ntimenou V,Fahr A,Antimisiaris SG.Elastic vesicles for transder⁃mal drug delivery of hydrophilic drugs:a comparison of important physicochemical characteristics of different vesicle types[J].J Biomed Nanotechnol,2012,8(4):613-623.
[7]He W,Guo X,Zhang M.Transdermal permeation enhancement of N-trimethyl chitosan for testosterone[J].Int J Pharm,2008,356(1-2):82-87.
[8]Wang H,Zhang S,Liao Z,et al.PEGlated magnetic polymeric lipo⁃some anchored with TAT for delivery of drugs across the blood-spi⁃nal cord barrier[J].Biomaterials,2010,31(25):6589-6596.
[9]Hasanovic A,Zehl M,Reznicek G,et al.Chitosan-tripolyphosphate nanoparticles as a possible skin drug delivery system for aciclovir with enhanced stability[J].J Pharm Pharmacol,2009,61(12):1609-1616.
[10]Santos CM,de Oliveira RB,Arantes VT,et al.Amphotericin B-load⁃ed nanocarriers for topical treatment of cutaneous leishmaniasis:de⁃velopment,characterization,and in vitro skin permeation studies[J].J Biomed Nanotechnol,2012,8(2):322-329.
