草鱼C–反应蛋白基因上游调控序列的扩增与分析
苏建明,伍小松,朱鑫,陈韬
(湖南农业大学动物医学院,湖南 长沙 410128)
C–反应蛋白(C–reactive protein,CRP)是一种急性时相血清蛋白,属于Pentraxin 蛋白家族,与动物的天然免疫和炎症反应有密切的关系[1–2]。CRP能与细菌、真菌以及寄生虫细胞膜上的磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)以及凋亡坏死细胞膜脂质双层结构破坏时暴露的磷脂、脂蛋白、脂多糖、染色质、半乳糖和胆固醇等多种配体结合,具有与IgG 和补体相似的调理和凝集作用[3–5],能提高巨噬细胞的吞噬功能[6–8],刺激单核细胞表面的组织因子表达及其他免疫调节功能[9–11],因此,血清CRP 水平的高低取决于炎症刺激的强度[2]。
由于鱼类的免疫系统比哺乳动物低等,天然免疫在机体的免疫保护中所起的作用更加重要。但到目前为止,人们对于CRP 在鱼类免疫过程中的作用以及鱼类CRP 基因表达调控的机制了解不够深入,相关的研究报道也很少。唐春华等[12]采用RACE 方法克隆了CRP 基因全长cDNA,并利用RT–PCR 半定量法对健康及被嗜水产气单胞菌(Aeromonas hydrophila)人工感染的草鱼的不同组织 CRP 的mRNA 表达水平进行检测,结果显示CRP 基因在草鱼的心脏、脑、前肠、肾脏、肝胰脏、肌肉、脾等组织中均有表达,表达水平差异不明显。但在人工感染24 h 后,各组织中CRP 的mRNA 水平均有显著升高,与哺乳动物和一些鱼类在炎症反应中血清CRP 水平升高一致,表明CRP 基因的转录调控是可诱导的。基因上游调控序列包含的启动子是基因的组成部分,控制基因表达的起始时间和表达的程度。有研究[13]表明,不同物种的相同基因在启动子序列结构上存在的差异,可能直接影响基因的转录活性,因此,鉴定草鱼CRP 基因的上游调控序列,是研究上游调控序列在CRP 基因转录水平表达调控过程中的作用,探讨CRP 基因转录调控的模式的前提。
1 材料与方法
1.1 供试草鱼
Ⅰ龄草鱼成鱼购自湖南农业大学水产养殖基地,平均体长(20 ± 2) cm,平均体质量(112 ± 11) g。
1.2 试 剂
基因组DNA 提取试剂盒、Genome Walker 试剂盒购自大连宝生物公司;Advantage® 2 PCR 试剂盒购自Clontech 公司;DNA 凝胶回收试剂盒购自Qiagene 公司;1 kb Plus DNA Ladder 购自BIONOVAS Biotechnology 公司;MarkerⅢ DNA Ladder 购自北京索莱宝生物科技有限公司。
1.3 方 法
1.3.1 草鱼肝脏基因组DNA 的提取
取20 mg 新鲜草鱼肝脏组织,剪成碎块后用基因组DNA 提取试剂盒提取基因组DNA,并进行电泳检测。
1.3.2 草鱼CRP 基因上游序列扩增
按照Genome Walker 试剂盒说明,根据CRP基因的cDNA序列设计特异性引物:SP1(5′–GGAAAC AGAAGTACTTTACC–3′)用 于 第1 轮 扩 增,SP2 (5′–CAAGACCCACTTCAGCAGCC–3′)用于第2轮扩 增,SP3(5′–CCAGCATCTTGCTGCAGGTG–3′)用于第3轮扩增。扩增方法参照试剂盒说明,根据引物的退火温度对PCR条件稍作修改:第1轮PCR程序为:92 ℃预变性3 min;95 ℃预变性1 min;5个循环(94 ℃变性30 s,64 ℃退火1 min,72 ℃延伸2 min),1个循环(94 ℃变性30 s,25 ℃退火3 min,72 ℃延伸2 min),10个循环(94 ℃变性30 s,44 ℃退火1 min,72 ℃延伸2.5 min),15个循环(94 ℃变性30 s,64 ℃退火1 min,72 ℃延伸2.5 min),1个循环(94 ℃变性30 s,44 ℃退火1 min,72 ℃延伸2.5 min);72 ℃延伸5 min。第2轮PCR程序为:92 ℃预变性3 min,95 ℃预变性1 min,15个循环(94 ℃变性30 s,62 ℃退火1 min,72 ℃延伸2.5 min,94 ℃变性30 s,62 ℃退火1 min,72 ℃延伸2.5 min,94 ℃变性30 s,44 ℃退火1 min,72 ℃延伸2.5 min)。第3轮PCR程序与第2轮相同。3轮PCR扩增的产物,用于琼脂糖凝胶电泳分析,并将PCR目的条带回收纯化后送生工生物工程(上海)股份公司测序。
1.3.3 序列分析
将测序结果整理后利用在线启动子预测软件PLACE(http://www.Dna.affrc.go.jp/PLACE/signalsca n.html)和 BDGP(http://www.fruitf ly.org/seq_tools/ promoter.html)分析CRP 上游调控序列中的核心启动子各组成部分以及相关的转录因子结合位点。
2 结果与分析
2.1 CRP 基因上游序列Genome Walker 扩增结果
利用0.8%琼脂糖凝胶电泳分析草鱼肝脏基因组DNA(图1),DNA条带清晰,无明显降解。Genome Walker扩增结果电泳分析(图2)表明,第1轮PCR扩增产物出现多个条带,而第2轮PCR出现条带相对较少,第3轮PCR得到1条长度约稍大于1 000 bp的清晰条带。目的条带在3轮PCR中长度依次变小,这是由于巢式PCR中后一轮PCR的产物比前一轮要小。将第3轮PCR产物回收纯化后送测序,得到长度为1 055 bp的序列。

图1 草鱼基因组DNA 电泳结果Fig. 1 Electrophoresis of Genomic DNA from grass carp (Ctenopharyngodon idellus)
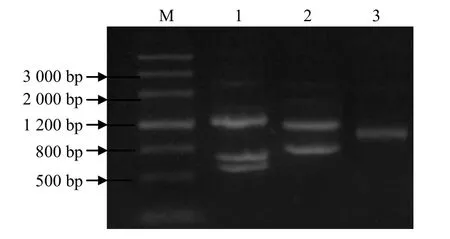
图2 Genome Walker 扩增草鱼CRP 基因上游序列Fig. 2 Up–stream sequence of CRP gene from grass carp (Cteno- pharyngodon idellus) amplified by Genome Walker
2.2 序列分析
将测序得到的序列与CRP全长cDNA序列进行比较,发现其中仅包括57 bp的CRP 5′–UTR序列,其余部分均为非转录的上游序列。启动子元件和转录起始位点的预测结果(图3)显示,在CRP上游序列中起始子序列为“TCAGATC”与草鱼CRP保守起始子序列(PyPyA+1NT/A PyPy)[14]一致,其中的G为转录起始位点。在–41~ –35 bp处发现高度保守的RNA聚合酶II的结合位点TATAA–box;在–54~ –5 bp处发现1个高度保守的核心启动子序列;在–94~–91 bp处发现1个CAAT–box。此外,还发现一些转录因子结合位点,包括4个E–box元件(CANNTG),其位置分别在–924~ –919 bp、–438~ –433 bp、–349~ –344 bp、–202~ –197 bp;3 个GT1 共 有 序 列(GT1 consensus,GRWAAW),分别位于–606~ –601 bp,–594~ –589 bp,–131~ –126 bp;2个GT1–core元件(GGTTAA),分别位于–391~ –386 bp,–268~ –263 bp;2个I–box–core元件(GATAA),分别位于–606~ –602 bp,–142~ –138 bp。

图3 草鱼CRP基因上游调控序列分析Fig. 3 Analysis of up–stream regulatory sequence of CRP
3 讨 论
Genome Walker方法是利用已知序列(如cDNA ) 从基因组中获得基因的上游(如启动子) 或下游序列的方法[15]。由于基因组DNA 较复杂,如果在PCR反应的最初阶段退火温度较低,容易造成非特异性扩增。Genome Walker 先采用较高退火温度,再采用较低退火温度的扩增方式,称为降落PCR,在此PCR 的最初几个循环,扩增效率不高,但扩增的特异性较高,从而积累特异性PCR 产物,随后通过降低退火温度而提高扩增的效率。本研究用Genome Walker 法,经3 轮巢式PCR 扩增CRP 上游序列,确保了扩增产物的特异性。
和哺乳动物一样,鱼类CRP基因的表达是可诱导的。在正常情况下,CRP以较低水平表达(组成型表达),这种表达主要是由遗传因素决定的。当鱼类受到病原体的感染或其他诱导物刺激时,血清中CRP的水平可以在24~48 h内迅速升高,如用嗜水产气单胞菌可以诱导鲤鱼血清CRP 水平升高[16],用重金属镉可以诱导鲤科鱼类的CRP表达升高[17]。类似的研究在斑马鱼[18]和虹鳟[19–20]中也有报道,其CRP表达升高的调控主要是发生在转录水平。真核生物转录的调控,主要是通过一些反式调控因子与位于基因上游的一些顺式调控元素结合,从而提高转录起始频率来实现的。Szalai 等[21–22]的研究表明,人类CRP基因的内含子区域和启动子区域中的一些重复出现的二核苷酸能影响CRP的基础表达。最近的研究表明,人类CRP基因3′端非翻译区域和外显子2中核苷酸的多态性也能影响CRP的组成型表达[23],但这些不是主要的调控模式。通过对草鱼CRP基因上游序列的分析可以看出,除了含有TATA–box、CAAT–box这些真核生物中基因组成型表达启动子所必须的序列以外,还含有大量的转录因子结合位点,包括E–Box元件、GT1共有序列、GT1核心序列、I–box核心序列等。这些转录因子结合位点对于CRP基因受到诱导后的高水平表达具有十分重要的作用。Stalberg等[24]将具有诱导调控作用的基因上游序列中重复出现的E–box突变以后,其可以导致所控制的基因的转录明显降低,意味着这些E–box可能通过和某些转录因子结合来增强转录。而GT1共有序列、GT1–core元件、I–box–core元件则都是诱导调控的必要元件,如GT1能通过与DNA的结合后经GT1与TFIIA的相互作用,稳定TFIIA–TBP–DNA (TATA box) 复合体,从而提高转录效率[25],而I–box核心序列则是存在于很多光诱导表达的植物基因的上游序列中的保守序列[26]。
由于本次扩增获得的上游调控序列只有1 055 bp 左右,或许还有其他一些顺式作用元件位于更远的上游,这些元件可能在草鱼CRP基因转录的诱导调控中同样重要。本研究所获得的上游序列,可经引入报告基因和缺失突变,从细胞水平确定所预测的顺式作用元件的功能。
[1]Tillett W S,Francis T.Serological reactions in pneumonia with a non–protein somatic fraction of pneumococcus[J].The Journal of Experimental Medicine,1930,52(6):561–571.
[2]Du Clos T W,Mold C.C–reactive protein [J]. Immuno- logic Research,2004,30(3):261–277.
[3]Szalai A J,VanCott J L,McGhee J R,et al.Human C–reactive protein is protective against fatal salmonella enterica serovar typhimurium infection in transgenic mice [J].Infection Immunity,2000,68(10):5652–5656.
[4]Kaplan M H,Volanakis J E.Interaction of C–reactive protein complexes with the complement system I. Consumption of human complement associated with the reaction of C–reactive protein with pneumococcal C–polysaccharide and with choline phosphatides,lecithin and sphingomyelin [J].The Journal of Immunology,1974,112(6):2135–2147.
[5]Siegel J,Rent R,Gewurz H.Interactions of C–reactive protein with the complement system I. Protamine–induced consumption of complement in acute phase sera [J].The Journal of Experimental Medicine,1974,140(3):631–647.
[6]Robey F A,Liu T Y.Limulin:A C–reactive protein from Limulus polyphemus [J].Journal of Biological Chemistry,1981,256(2):969–975.
[7]Lin L,Liu T Y.Isolation and characterization of C–reactive protein (CRP) cDNA and genomic DNA from Xenopus laevis:A species representing an intermediate stage in CRP evolution[J]. Journal of Biological Chemistry,1993,268(9):6809–6815.
[8]Volanakis J E.Human C–reactive protein:Expression,structure,and function[J].Molecular Immunology,2001,38(2/3):189–197.
[9]Tilg H,Vannier E,Vachino G,et al.Anti–inflammatory properties of hepatic acute phase proteins:Preferential induction of Interleukin 1 (IL–1) receptor antagonist over IL–1β synthesis by human peripheral blood mononuclear cells[J].The Journal of Experimental Medicine,1993,178(5):1629–1636.
[10]Ballou S P,Lozanski G.Induction of inflammatory cytokine release from cultured human monocytes by C–reactive protein[J].Cytokine,1992,4(5):361–368.
[11]Galve–de R B,Wiktorowicz K,Kushner I,et al. C–reactive protein increases production of IL–1 alpha,IL–1 beta,and TNF–alpha,and expression of mRNA by human alveolar macrophages[J].Journal of Leukocyte Biology,1993,53(4):439–445.
[12]唐春华,左振华,陈韬,等.草鱼CRP 基因全长cDNA 的克隆及其表达分析[J].湖南农业大学学报:自然科学版,2009,35(6):673–678.
[13]赵发兰,周瑞雪,成嘉,等.鳜鱼与鲢鱼肌球蛋白轻链2 启动子的克隆及其序列比较分析[J].湖南师范大学自然科学学报,2011,34(1):75–79.
[14]Smale S T.Core promoter architecture for eukaryotic protein–coding genes[C]// Conaway R C,Conaway J W. In Transcription:Mechanisms and Regulation.New York: Raven Press,1994:63–81.
[15]Siebert P D,Chenchik A,Kellogg D E,et al.An improved PCR method for walking in uncloned genomic DNA [J].Nucleic Acids Research,1995,23(6):1087–1088.
[16]MacCarthy E M,Burns I,Irnazarow I,et al.Serum CRP–like protein profile in common carp Cyprinus carpio challenged with Aeromonas hydrophila and Escherichia coli lipopolysaccharide[J].Developmental and Comparative Immunology,2008,32(11):1281– 1289.
[17]Sinha S,Mandal C,Allen A K,et al.Acute phase response of C–reactive protein of Labeo rohita to aquatic pollutants is accompanied by the appearance of distinct molecular forms[J].Archives of Biochemistry and Biophysics,2001,396(2):l39–150.
[18]Lin B,Chen S,Cao Z,et al.Acute phase response in zebra fish upon Aeromonas salmonicida and Staphylococcus aureus infection:Striking similarities and obvious differences with mammals [J].Molecular Immunology,2007,44(4):295–301.
[19]Kodama H,Matsuoka Y,Tanaka Y,et al.Changes of C–reactive protein levels in rainbow trout (Oncorhynchus mykiss) sera after exposure to anti–ectoparasitic chemicals used in aquaculture [J].Fish & Shellfish Immunology,2004,16(5):589–597.
[20]Kodama H,Yamada F,Murai T,et al.Activation of trout macrophages and production of CRP after immunization with Vibro anguillarum[J].Developmental and Compara- tive Immunology,1989,13(2):123–132.
[21]Szalai A J,McCrory M A,Cooper G S,et al.Association between baseline levels of C–reactive protein (CRP) and a dinucleotide repeat polymorphism in the intron of the CRP gene[J].Genes Immunology,2002,3(1):14–19.
[22]Szalai A J,Wu J,Lange E M,et al.Single–nucleotide polymorphisms in the C–reactive protein (CRP) gene promoter that affect transcription factor binding,alter transcriptional activity,and associate with differences in baseline serum CRP level [J].Journal of Molecular Medicine,2005,83(6):440–447.
[23]Russell A I,Cunninghame–Graham D S,Shepherd C,et al.Polymorphism at the C–reactive protein locus influences gene expression and predisposes to systemic lupus erythematosus [J].Human Molecular Genetics,2004,13(1):137–147.
[24]Stalberg K,Ellerstom M,Ezcurra I,et al.Disruption of an overlapping E–box/ABRE motif abolished high transcription of the napA storage–protein promoter in transgenic Brassica napus seeds[J].Planta,1996,199:515–519.
[25]Villain P,Mache R,Zhou D X.The mechanism of GT element–mediated cell type–specific transcriptional control[J].The Journal of Biological Chemistry,1996,271:32593–32598.
[26]Terzaghi W B, Cashmore A R.Light–regulated transcription[J].Annual Review of Plant Physiology and Plant Molecular Biology,1995,46:445–474.

