BMSC“s归巢”在AMI后心肌重塑中的作用及活血化瘀药的干预研究*
赵海滨,张秀静,王 帅,郭 梦,马 迪,许晓英
急性心肌梗死(AMI)后的心肌重塑与心脏破裂、室壁瘤形成及心力衰竭等严重并发症密切相关,在AMI病死率及预后中起至关重要的作用[1]。AMI后心肌重塑机制复杂,后果严重,疗效不理想,相关研究亟待深入。目前研究证实[2],在AMI时自体骨髓间充质干细胞(BMSCs)可自发地向损伤心肌归巢,并在梗死部位特定的微环境诱导作用下,分化成新的心肌细胞,达到修复和再生心肌的目的,且能与宿主细胞在结构和功能上进行整合,实现“无创性”组织再生,抑制/减缓心肌重塑的发生。但目前对其归巢缺乏有效的动员手段。活血化瘀中药以中医“祛瘀血、生新血”为理论基础,对AMI后心肌重塑疗效肯定,本课题组通过研究祛瘀生新法在大鼠急性心梗后心肌重塑中的干预作用及对BMSCs“归巢”动员的影响,探讨祛瘀生新法对急性心梗后心肌重塑的效应机制,为活血化瘀药治疗急性心梗后心肌重塑提供实验依据。
1 材料与方法
1.1 材料 成年清洁级Wistar大鼠80只,体质量(250±10)g,由北京中医药大学东直门医院动物实验中心提供(合格证号0240574);试剂用药血塞通软胶囊由昆明圣火制药有限责任公司提供(批号Z19990022),基质细胞衍生因子-1受体阻断剂(AMD3100)由北京启维益成科技有限公司提供(批号239820-5MG),荧光素藻红蛋白(PE)标记的骨髓基质干细胞抗原1抗体及心肌c-kit抗体均由北京博奥森生物科技有限公司提供;多媒体生物信号记录分析系统MS2000型(广州市龙飞科技有限公司)。
1.2 方法
1.2.1 动物模型制作 用随机数字表法将大鼠分为正常组、假手术组、模型组、中药组、西药组,每组16只,分笼饲养。
模型组:参照文献[3-4]制备AMI大鼠模型。盐酸戊巴比妥钠(30 mg/kg)腹腔注射麻醉。经口气管插管行小动物呼吸机辅助呼吸,有氧正压通气,潮气量 5~6 mL,呼吸比 1∶2,呼吸频率 80 次/min。连接标准12导联,记录大鼠心电图。经左前胸廓旁第3、4肋间逐层开胸,暴露心脏,分离心包,在肺动脉圆锥和左心耳交界处用5-0号丝线结扎左冠状动脉前降支(LAD)近端制成心肌梗死模型,以心电图出现坏死性Q波判断为可能心肌梗死,若无病理性Q波,则再次结扎,以提高心肌梗死模型成功率,然后逐层缝合心腔。术后常规抗感染治疗。
中药组:制备AMI大鼠模型,术后立即灌胃给药,给药量按《药理实验方法学》所示剂量换算法计算[5]:200g大鼠剂量(g/kg)=成人的剂量[1g/(kg·d)×0.018]。每日灌胃 1 次,共用 7 d。
西药组:制备AMI大鼠模型,第6天腹腔注射AMD3100(5 mg/kg),余同模型组大鼠。
假手术组:大鼠经历上述手术过程,丝线从冠状动脉下穿过但不结扎。
正常组:不做造模处理。
1.2.2 病理形态学检查 于上述各组处死大鼠,取心肌组织,用4%多聚甲醛固定,石蜡包埋,切片苏木-伊红(H-E)染色。常规H-E染色在光镜下进行病理观察。
1.2.3 心肌梗死面积硝基四氮唑蓝(N-BT)染色 参照Shatney等[6]的N-BT组化染色方法造模1周后,处死动物,取出心脏,以结扎线为标志,每隔3 mm取心脏横断面,每只大鼠心脏取材3块,生理盐水冲洗,N-BT染色后,微距照相,像片输入图像处理系统,每只大鼠心脏取5个横断面,分别记录梗死区占心脏横截面的面积百分比,取其平均值。
1.2.4 流式细胞仪检测 大鼠麻醉后,腹主动脉采血,肝素抗凝。Ficoll-Hypaque密度梯度离心法分离外周血单个核细胞,稀释至1×106个/mL,分别加入PE标记的c-kit受体单克隆抗体,流式细胞仪检测。
1.2.5 免疫组化检测 采用S-P法,DAB显色,在400倍显微镜下计数单位面积内阳性细胞数量,每张切片随机取9个视野,取其均值作为测定值,具体步骤参照试剂盒说明书。
1.2.6 统计学处理 采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,计量资料组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 心肌组织病理学观察 H-E染色结果显示:正常组及假手术组整体均呈现正常心肌膜组织(见图1A、图1B)。模型组:心肌细胞数量较少且散在,结缔组织整片广布,炎性细胞聚集,成纤维细胞多,整体呈现心肌梗死(重症)心肌膜组织(见图1C)。中药组:心肌细胞间有大量炎性细胞聚集,整体呈现心肌炎心肌膜组织(见图1D)。西药组:结缔组织整片占据切片较大区域,炎性细胞散在,浅粉红色胶原成分较多,红细胞聚集且多,整体呈现心肌梗死(轻症)心肌膜组织(见图1E)。
2.2 各组大鼠心肌梗死面积检测结果 模型组、中药组、西药组均高于假手术组(P<0.01),中药组与西药组均低于模型组(P<0.05),中药组与西药组无明显差异(P>0.05)。见表1。
表1 各组大鼠心肌梗死面积检测结果(±s)

表1 各组大鼠心肌梗死面积检测结果(±s)
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05;与中药组比较,△P>0.05。
组别 n 心肌梗死面积(%)假手术组 10 2.60±1.67模型组 10 21.18±2.29*中药组 10 16.40±3.11*#西药组 10 15.23±2.12*#△
2.3 流式细胞仪检测结果 模型组、中药组、西药组均高于假手术组(P<0.01),中药组与西药组均高于模型组(P<0.05),中药组与西药组无明显差异(P>0.05)。见表2。
表2 各组外周血PE标记CD117细胞数流式细胞仪检测结果(±s)
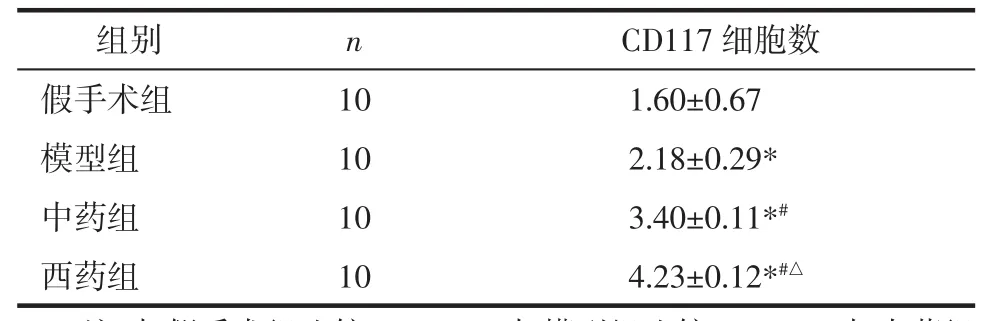
表2 各组外周血PE标记CD117细胞数流式细胞仪检测结果(±s)
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05;与中药组比较,△P>0.05。
组别 n CD117细胞数假手术组 10 1.60±0.67*模型组 10 2.18±0.29*中药组 10 3.40±0.11*#西药组 10 4.23±0.12*#△
2.4 免疫组化检测 见图2。模型组、中药组、西药组均高于假手术组(P<0.01),中药组与西药组均高于模型组(P<0.05),中药组与西药组无明显差异(P>0.05),见表3。

图1 各组心肌组织病理图像(H-E染色×200)

图2 各组心肌组织免疫组化检测图像(×400)
表3 各组免疫组化c-kit标记细胞检测结果(±s)
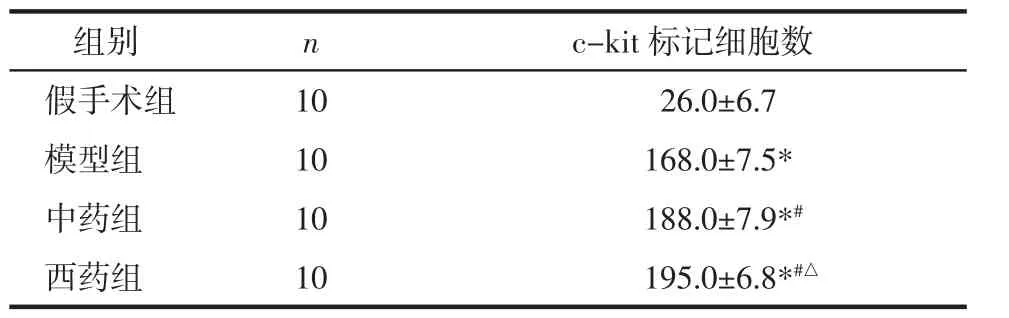
表3 各组免疫组化c-kit标记细胞检测结果(±s)
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05;与中药组比较,△P>0.05。
组别 n c-kit标记细胞数假手术组 10 26.0±6.7模型组 10 168.0±7.5*中药组 10 188.0±7.9*#西药组 10 195.0±6.8*#△
2.5 非梗死区胶原蛋白测定 结果显示:模型组与假手术组相比较,非梗死区胶原沉积明显(P<0.05),活血化瘀组与模型组相比较胶原沉积降低(P<0.05)。见表4。
表4 各组非梗死区胶原蛋白测定结果(±s)
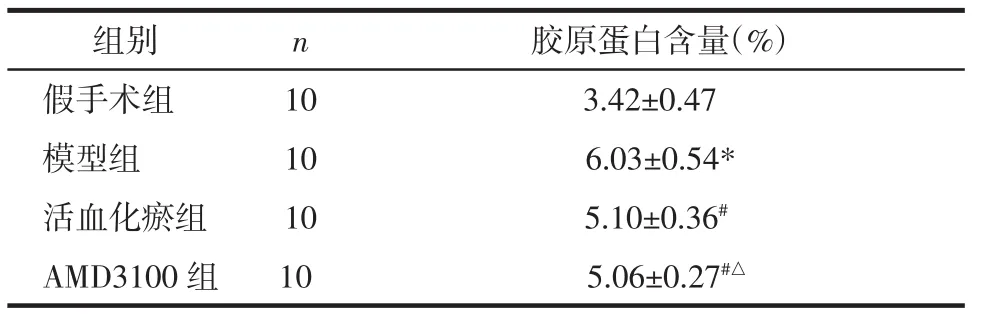
表4 各组非梗死区胶原蛋白测定结果(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与活血化瘀组比较,△P>0.05。
组别 n 胶原蛋白含量(%)假手术组 10 3.42±0.47模型组 10 6.03±0.54*活血化瘀组 10 5.10±0.36#AMD3100 组 10 5.06±0.27#△
3 讨论
BMSCs是一种来源于骨髓的多能干细胞,BMSCs不仅可向多种组织细胞分化,表现出很强的可塑性,而且还存在广泛迁移现象,即“干细胞循环”,指干细胞通过机体的调控不断地由原组织位点向新的组织位点迁移,并不断进行自我更新和分化的过程,在生理或病理情况下参与多种组织的更新和修复,维持机体组织形态完整性和功能稳定性[7]。最近研究表明[8-9],BMSCs“归巢”在AMI后心肌重塑保护效应中疗效确切,因而也应是较佳的治疗靶点,然而正常情况下外周血中干细胞含量很低,达不到修复坏死心肌所需的浓度。西医学治疗AMI后心肌重塑,主要使用粒细胞集落刺激因子、AMD3100、粒巨细胞集落刺激因子等作为心肌梗死后干细胞“归巢”的有效动员剂。本实验证实心梗后,外周血及梗死心肌区BMSCs明显增多,可能和ADM3100对干细胞循环有动员效应。
心肌梗死属中医“胸痹、真心痛”的范筹,是血道闭塞,血脉不通,瘀血滞塞脉络所致,以“血气不至”、“血凝而不流”、“血瘀滞不行”等为主要病理机制,以胸闷胸痛、心悸气短等为主要症状。“祛瘀生新”亦称化旧生新、除旧生新,一方面通过祛瘀、化旧、或去腐等方法来祛除体内沉积的瘀血及其他陈旧性的病理产物,另一方面强调应用生新方法来生新血、生新络、生新物,“祛瘀”与“生新”相辅相成,不可偏废[10],因此王清任推崇逐瘀活血[11]。范英昌等[12]证实活血化瘀丹参提取物能增加心肌梗死区的血供。本实验通过活血化瘀药对大鼠急性心梗后心肌重塑的作用干预后,药物组较模型组胶原含量明显降低(P<0.05),心肌梗死面积也有所减轻,这可能与活血化瘀中药祛瘀通络有关,也证实了活血化瘀药能减轻大鼠心肌梗死面积。流式细胞仪及免疫组化检测发现,中药组较模型组BMSCs均明显增多,说明活血化瘀药能改善大鼠心肌梗死区的BMSCs数量,也是“生新血”的具体体现。至于活血化瘀法对提高大鼠心肌梗死区BMSCs数量的活化调控机制,还有待进一步深入研究。
[1]Weir R A,Clements S,Steedman T.Plasma TIMP-4 predicts left ventricular remodeling after acute myocardial infarction[J].Card Fail,2011,17(6):465-471.
[2]Chiu R C.Adult stem cell therapy for heart failure[J].Expert Opin Biol Ther,2003,3(2):215-225
[3]Ueda S,Yamagishi S,Matsui T,et al,Administration of pigment epithelium-derived factor inhibits left ventricular remodeling and improves cardiac function in rats with acute myocardial infarction[J].Am J Pathol,2011,178 (2):591-598.
[4]侯春丽,张冬梅,侯学红,等.大鼠急性心肌梗死模型制备及对心功能影响的实验研究[J].宁夏医科大学学报,2010,32(9):967-970.
[5]徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2001:202-204.
[6]Shatney,YinKeYang,Kimber L,et al.Transplantation of embryonic stem cells improves cardiac function in postinfarcted rats[J].J Appl Physiol,2002,92:288-296.
[7]张海啸,史载祥.转化生长因子-β信号传导通路与心肌纤维化[J].中日友好医院学报,2007,21(2):110-112.
[8]Martin-Rendon E,Brunskill S J,Hyde C J,et al.Autologous bone marrow stem cells to treat acute myocardial infarction:a systematic review[J].Eur Heart J,2008,29(15):1807-1818.
[9]Brunskill S J,Hyde C J,Doree C J,et al.Route of delivery and baseline left ventricular ejection fraction,key factors of bone-marrow-derived cell therapy for ischaemic heart disease[J].Eur J Heart Fail,2009,11(9):887-896.
[10]赵海滨,张秀静.祛瘀生新——心肌梗死中医药干预的新思考[C].北京中医药协会心血管病专业委员会年会论文集,2011,63.
[11]田 虎,王素改.试论王清任活血化瘀法及其成就[J].天津中医药大学学报,2006,25(4):4-5.
[12]范英昌,华声瑜,郭茂娟,等.丹酚酸B干预骨髓间充质干细胞移植对AMI大鼠心梗区血管新生的影响[J].天津中医药大学学报,2007,26(3):3-4.

