131 I 联合左旋甲状腺素对分化型甲状腺癌术后患者骨代谢的影响
刘 勇,周 珍,彭小春
甲状腺癌是常见的恶性肿瘤,其中包括乳头状癌和滤泡状癌的分化型甲状腺癌(Differentiated thyroid carcinoma,DTC)约占90%以上[1]。且近年来该病发病率在全球范围内呈现出明显的增高趋势。该病病因目前尚未完全清楚,但有研究认为,桥本甲状腺炎与甲状腺乳头状癌的发生存在较为密切的关系[2]。关于本病的治疗,外科手术切除无疑是最为重要的步骤,而术后的放射性131I 治疗与甲状腺激素替代或抑制治疗目前已成为国际公认的理想方案。但目前关于DTC 患者术后使用放射性131I 联合左旋甲状腺素是否会对患者的骨代谢产生影响,尚存在较大分歧[3]。笔者回顾性分析80 例DTC 患者的临床资料,以探讨术后放射性131I 联合左旋甲状腺素对患者骨代谢的影响,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取我院2007 年1 月至2010 年5 月收治的DTC 患者80 例,其中男21 例,女59例,年龄46 ~67 岁,平均年龄(55.4 ±9.7)岁。上述患者因健康体检或自觉发现甲状腺肿块,行外科手术治疗,术后病理结果为DTC。所有患者均无颈部淋巴结转移或远处转移,且术后均使用放射性131I 清除手术残留甲状腺组织。131I 清甲治疗后均需长期口服左旋甲状腺素(LT4)替代或抑制治疗。本研究经我院伦理委员会讨论通过,患者或家属签署知情同意书。所有患者按照入院先后顺序随机分为替代组与抑制组,每组40 例。替代组男10 例,女30 例,平均年龄(55.8 ±9.9)岁,肿瘤大小平均(2.1 ± 0.6)cm,术后131I 用量平均(102.4 ±10.4)mCi;抑制组男11 例,女29 例,平均年龄(56.2 ±9.4)岁,肿瘤大小平均(1.9 ±0.8)cm,术后131I 用量平均(101.7 ±9.8)mCi。两组患者在性别、年龄、肿瘤大小及术后131I 用量等方面比较差异均无统计学意义(P >0.05),具有可比性。另外选取40 例健康体检人员作为正常对照组,本组对象均无甲状腺疾病病史,无甲状腺制剂或抗甲状腺药物使用史,无心、肝、肾等重要器官功能障碍或其他内分泌疾病病史。
1.2 方法 所有患者均于全麻下行双侧甲状腺及峡部切除术,术后1 个月行131I 清除残余甲状腺组织,之后给予左甲状腺素钠片(商品名:优甲乐,规格:50 μg × 100,德国默克公司生产,批号:H20100523)口服。替代组2.0 μg/kg,维持血清FT3、FT4、TSH 在正常范围内;抑制组2.5 μg/kg,维持TSH 水平<0.30 mIU/L,而FT3、FT4 维持在正常高限左右,即使患者处于亚临床甲亢状态。所有患者均经上述治疗2 ~5 年。
1.3 观察指标 于清晨抽取研究对象空腹静脉血5 mL,分离血清,采用BAYER 公司生产的ACS180SE 自动化学发光分析仪检测FT3、FT4、TSH,并使用美国BECKMAN 公司生产的生化试剂盒及自动生化分析仪对血清钙、磷、碱性磷酸酶(ALP)进行检测;骨密度(BMD)检测:使用美国LunarDPX-L 型双能X 线骨密度仪进行测定。
1.4 统计学分析 使用SPSS 13.0 统计软件。计量资料采用±s 表示,数据比较采用t 检验;率的比较采用χ2检验,P <0.05 为差异有统计学意义。
2 结果
2.1 三组甲功结果比较 治疗后抑制组FT3、FT4均高于替代组与对照组(P <0.01),且TSH 低于替代组与对照组(P <0.01)。见表1。

表1 治疗后三组甲功结果骨代谢指标比较
2.2 骨代谢指标比较 治疗后,三组血清钙、磷及ALP 比较差异无统计学意义(P >0.05)。见表1。
2.3 三组BMD 比较 三组研究对象4 个部位BMD 比较差异均无统计学意义(P >0.05),见表2。
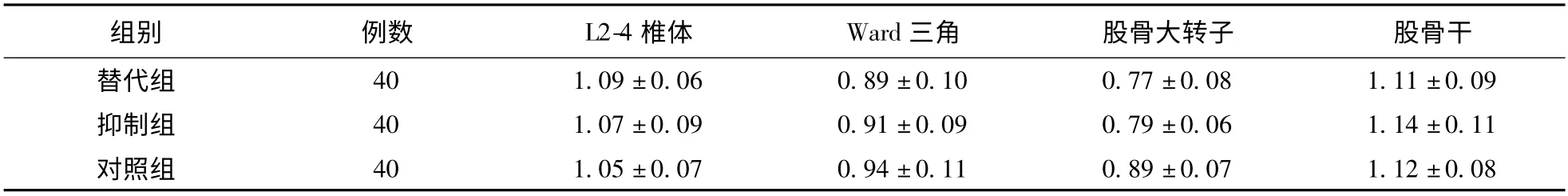
表2 三组BMD 比较(g/cm2)
3 讨论
甲状腺功能亢进或减低造成的骨骼代谢改变及其相关机制已得到相关研究的证实,但DTC 患者术后甲状腺素服用剂量对骨代谢的影响目前尚存在分歧[4-5]。相关研究发现,对DTC 术后131I 治疗后的绝经前女性患者采用抑制剂量的左旋甲状腺素治疗时,未发现BMD 的明显减低[6]。同时,刘斌等[7]认为,给予<2.6 μg/kg 剂量的左旋甲状腺素治疗,同样不会影响雌激素水平正常女性DTC 患者的骨代谢指标。但在Sijanovic 等[8]的研究中,绝经前开始使用左旋甲状腺素抑制剂量治疗且疗程相对较长的DTC 术后女性患者,可能导致其绝经后骨质疏松的发生。
本研究结果显示,抑制组FT3、FT4 均显著高于替代组与对照组,且TSH 显著低于替代组与对照组。结果表明,抑制组患者在接受抑制剂量的优甲乐治疗过程中,能够维持甲状腺功能在亚临床甲亢状态,而替代剂量则仅维持生理需求。在骨代谢生化指标的检测中发现,三组研究对象在血清钙、磷及ALP 等方面比较差异均无统计学意义;而三组L2-4 椎体、Ward 三角、股骨大转子及股骨干等4 个部位的BMD 比较差异亦无统计学意义。上述结果说明,无论DTC 患者术后131I 治疗后采用抑制剂量或替代剂量的左旋甲状腺素进行治疗,均未对骨代谢产生明显影响,与国内陈立波等[9]研究结果较为相似。
综上所述,笔者认为,手术+131I +甲状腺素的综合治疗过程中,左旋甲状腺素的剂量对于患者骨代谢影响较小。
[1] 关海霞,滕卫平.分化型甲状腺癌的研究新进展[J]. 中华内科杂志,2012,51(1):61-63.
[2] Kim KW,Park YJ,Kim EH,et al.Elevated risk of papillary thyroid cancer in Korean patients with Hashimoto's thyroiditis[J].Head Neck,2011,33(5):691-695.
[3] Lakatos P.Thyroid hormones:beneficial or deleterious for bone[J].Calcif Tissue Int,2003,73(3):205-209.
[4] 徐先发,邵姗.分化型甲状腺癌的治疗策略[J].中国耳鼻咽喉头颈外科杂志,2008,15(6):331-334.
[5] 陶新全,王明明.131I 治疗分化型甲状腺癌转移灶疗效观察[J].蚌埠医学院学报,2009,34(2):114-116.
[6] 马峻峰,唐波,李铁汉,等.促甲状腺激素抑制疗法在分化型甲状腺癌治疗中的作用[J]. 中国普外基础与临床杂志,2009,16(5):348-350,355.
[7] 刘斌,王建涛,牟达,等.131I 治疗分化型甲状腺癌血液和骨髓的吸收剂量及剂量学导向治疗法[J]. 中华核医学杂志,2010,30(2):142-144.
[8] Sijanovic S,Karner I. Bone loss in premeno pausal women on long-term suppressive therapy with thyroid hormone[J]. Med Scape Womens Health,2001,6(5):3.
[9] 陈立波,朱瑞森,余永利,等.131I 联合左旋甲状腺素对分化型甲状腺癌术后患者骨代谢的影响[J].中华内分泌代谢杂志,2006,22(1):81-83.

