大鲵尾部鱼油的酶法提取工艺
张佳婵, 薛 玲, 王昌涛
(北京工商大学植物资源研究开发北京市重点实验室,北京 100048)
大鲵俗称“娃娃鱼”,是我国珍稀名贵特产,属国家二级保护动物,分布于贵州、四川、湖北、湖南、陕西、河南等17个省区[1].大鲵栖息在山区溪流中,所需水质清澈、含沙量小、水流湍急,自然繁殖率低,生长缓慢,人工养殖大鲵成本较高[2].传统中医和现代医学理论都认为大鲵有很高的药用价值,长期食用大鲵肉可以聪明益智、延缓衰老、提高造血和免疫功能[3].因此,对大鲵的开发利用和深加工极为重要.目前对大鲵的研究主要集中在对其资源状况[4]、生物学习性[5-6]、繁殖[7]、病害[8]以及功能基因[2,9-10]方面,有关大鲵营养价值和食用价值的研究也有部分报道[11-15].杨代勤[16]和权清转等[17]详细介绍了大鲵肉氨基酸组成,刘绍等[15]研究了大鲵软骨与肌肉中几种重要矿物质的含量.杨红生等[18]研究分析了大鲵组织中的游离脂肪酸,并分析得到了8种常见脂肪酸的含量.大鲵脂肪富含多种不饱和脂肪酸,无胆固醇,而且大量文献报道大鲵脂肪具有预防心血管疾病的作用,因此利用大鲵脂肪进行深加工生产大鲵油具有重要科学价值[19-23].并且大鲵脂肪多分布在尾部及腹腔内,分离简单,更为大鲵油的生产提供有利条件.
传统动物油的提取方法有蒸煮法、淡碱水解法、压榨法,由于提取过程中的操作条件常常会破坏这些功能成分,从而影响鱼油的质量.酶解法是利用蛋白酶对蛋白质进行水解,破坏蛋白质和脂肪的结合,从而释放出油脂.由于酶解法提取动物油脂的工艺条件温和,提取效率高,且蛋白酶水解产生的酶解液能被充分利用,是提取动物油脂的较好方法.目前在动物油脂提取方面,应用最多的是鱼油.洪鹏志等[24]利用蛋白酶酶解法从黄鳍金枪鱼鱼头中提取鱼油,并通过正交试验获得了最佳的提取工艺参数.本研究利用蛋白酶酶解提取大鲵油,具有污染小、操作条件温和、提油率高的特点.为大鲵尾部脂肪组织的开发利用找出了可靠的途径并避免了传统提取方法二次污染的问题.
1 材料与方法
1.1 材料与设备
大鲵尾部组织由浙江永强养殖公司提供;alcalase碱性蛋白酶购于Novozymes(北京)酶制剂公司,经测定碱性蛋白酶酶活为7.38×104U/mL;其他试剂均为分析纯,购于国药集团化学试剂有限公司.
ZN-048型小型粉碎机,上海安亭科学仪器厂;TB-214型电子天平,北京赛多利斯仪器系统有限公司;PHS-3C型 pH计,上海雷磁仪器厂;UV mini-1240型紫外分光光度计,日本岛津;SCR20BC型高速冷冻离心机,日本立牌;HQ45型恒温摇床,中国科学院武汉科学仪器厂;6890N型气相色谱仪,美国Agilent公司;5975C inert XL MSD型质谱仪,美国Agilent公司.
1.2 方法
1.2.1 大鲵油的提取工艺
大鲵尾部组织→清洗→绞碎→按物料质量比1∶10加水匀浆→pH值为6.0,50℃alcalase碱性蛋白酶酶解1 h→沸水浴灭酶15 min→5 000 r/min离心20 min→分离→提取称重→计算提油率.
1.2.2 提油率的计算

1.2.3 碱性蛋白酶提取粗大鲵油的单因素实验
以提油率为指标,分别考察pH值、温度、加酶量(占匀浆前大鲵组织质量的百分比)、酶解时间对提取大鲵油工艺的影响,每个因素设定5个梯度,进行单因素实验.每组实验进行3次.
1.2.4 碱性蛋白酶提取粗大鲵油的正交试验
在单因素实验的基础上,选择对实验影响较大的pH、温度、加酶量和酶解时间4个因素为考察对象进行正交试验设计,以提油率为指标,确定大鲵油的最佳酶解工艺.
1.2.5 粗大鲵油理化指标的测定
水分及挥发物的测定按GB/T 5528—2008规定执行.其中空气烘箱法的烘干温度为100±2℃,烘干时间为30 min,复烘时间为15 min.酸价的测定按GB/T 5530—2005规定执行.过氧化值的测定按GB/T 5538—2005规定执行.不皂化物的测定按GB/T 5535.1—2008、GB/T 5535.2—2008 规定执行.碘价的测定按GB/T 5532—2008规定执行.杂质的测定按GB/T 15688—2008规定执行.
1.2.6 大鲵油脂肪酸组成分析
取油试样0.6 mL于离心试管中,加入5 mL正己烷,摇匀,再加入0.25 mL 2 mol/L氢氧化钾的甲醇溶液,充分振摇30 s,放入离心机内离心1 min后,取上层液体,进行GC-FID-MS色谱脂肪酸成分含量测定.
GC-FID-MS分析条件为采用DB-WAX毛细柱(30 m ×250 μm ×0.25 μm),进样量 1 μL,FID 检测器氢气流量40.0 mL/min,空气流量450 mL/min.尾气吹扫是He气,45 mL/min.程序升温范围是80~290℃,升温速率4℃/min,290℃保持30 min.采用质谱仪,溶剂延迟1 min,扫描质量数范围m/z 50~550u,前进样口250℃,色谱柱流量1.2 mL/min,MS四极杆150℃,离子源230℃.利用面积归一化法将所得数据进行分析.
2 结果与分析
2.1 碱性蛋白酶制备粗大鲵油的单因素实验
2.1.1 酶解温度的影响
温度对酶的催化活性及效率有重要的影响.一般高温有利于提高酶促反应速率,但却能够降低酶的稳定性,进而酶活力降低.本实验保持pH值为7,酶添加量1%,酶解1 h不变,分别考察30,40,45,50,55,60,65℃温度下alcalase碱性蛋白酶对大鲵油提取率的影响,如图1.图1表明,酶解温度控制在45~55℃附近大鲵油的提油率较高,可达到60%以上.
2.1.2 pH 值的影响
在温度为55℃,水解时间为1 h,酶添加量为1%的条件下,考察了pH值范围为5~10时对提油率的影响,结果见图2.从图2可以看出,pH值在6~9均保持较高的提油率,pH值高于9时,提油率有明显下降.可能是由蛋白酶最适pH值所致.但由于碱性环境可能会促使所得大鲵油的进一步水解,不利于大鲵油质量的保持,故选择pH值为6作为后续试验条件.
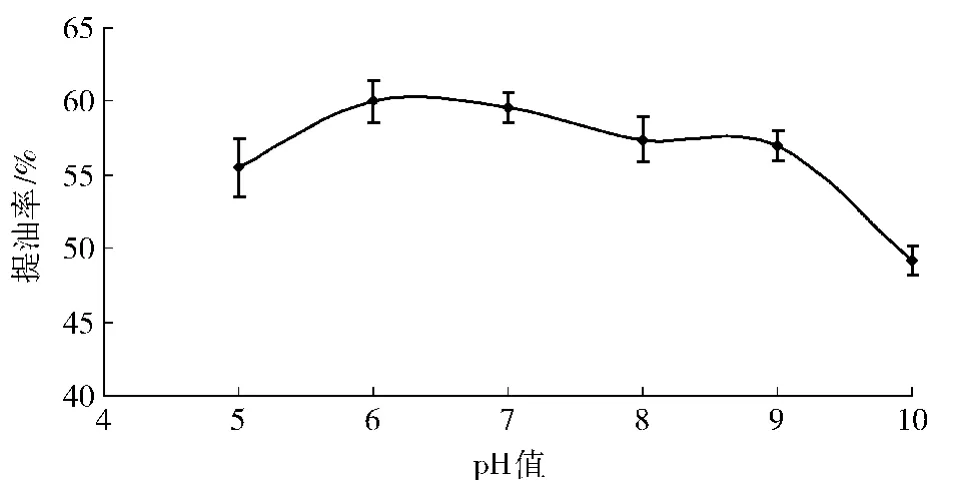
图2 pH值对提油率的影响Fig.2 Effects of pH on yield of oil
2.1.3 加酶量对提油率的影响
保持酶解温度55℃,水解时间1 h和pH值为7,观察酶添加量对提油率的影响,结果见图3.由图3可知,随着酶添加量的增加,大鲵油的提取率越高.但是,提油率并非随着酶添加量增加而一直保持增长趋势.当酶的质量分数达到1.5%时,提油率不再随着酶添加量的增大而增大(p>0.05),这可能是由于底物已全部与酶形成酶-底物复合物,没有多余的底物与酶接触.因此,从反应程度及经济方面考虑,酶的最适添加量为质量分数1.5%.
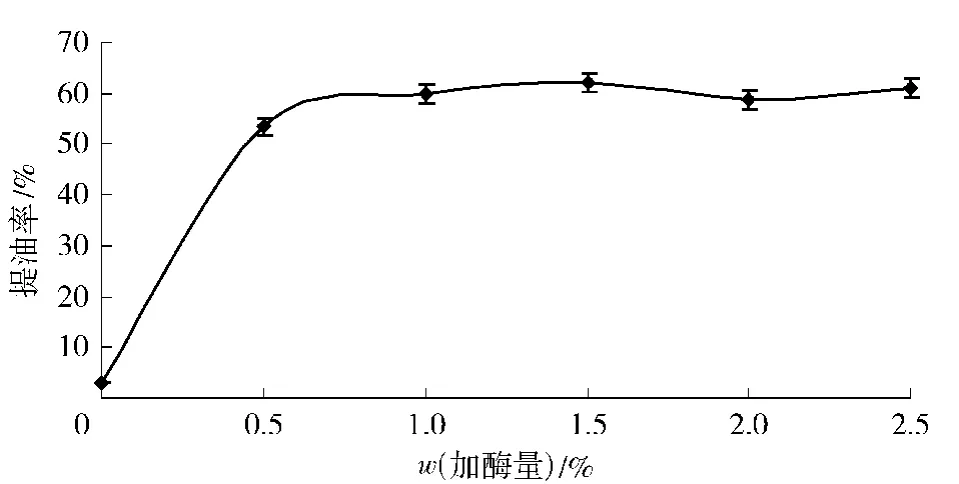
图3 加酶量对提油率的影响Fig.3 Effects of enzyme amounts on yield of oil
2.1.4 酶解时间对提油率的影响
在酶解温度为55℃,酶添加量为质量分数1%,pH值为6的条件下,在酶解时间分别为10 min,20 min,0.5 h,1 h,1.5 h,2 h,2.5 h时进行酶解,结果见图4.酶解时间低于0.5 h(30 min)时,提油率误差较大,随着酶解时间的延长,提油率也随之增加,主要是酶解时间的增加使得酶与底物的相互作用比较充分,能够充分破坏脂肪和蛋白质的关系,释放出脂肪分子.随着时间的进一步增加,大鲵油的提取率并没有进一步增加,反而颜色有变深趋势,可能是由于大鲵油中不饱和脂肪酸发生氧化,不利于营养物质的保持,因此酶解时间为1 h最为合适.
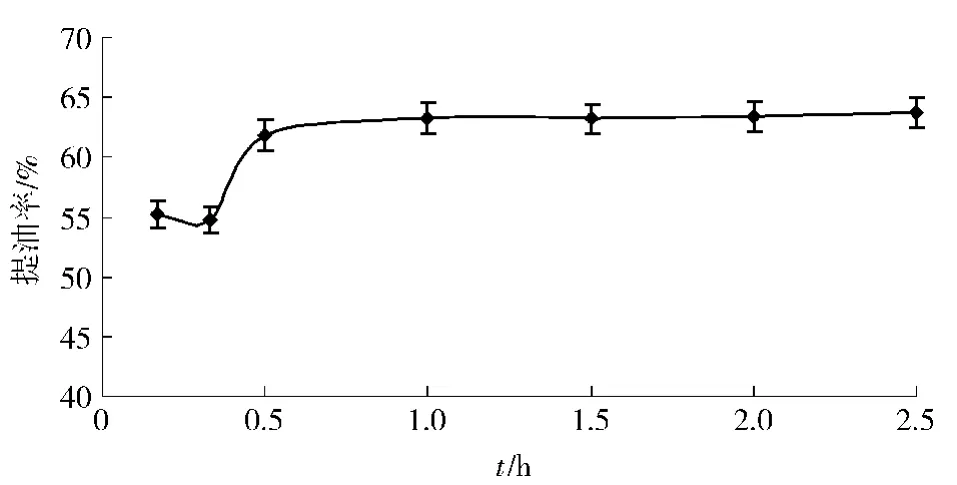
图4 酶解时间对提油率的影响Fig.4 Effects of reaction time on yield of oil
2.2 正交试验分析
根据以上单因素实验结果,选取pH值、加酶量、反应温度、反应时间4因素,采用正交试验设计优化大鲵油提取条件,其结果见表1.极差R分析发现R(C)>R(B)>R(D)>R(A),因此4种因素对大鲵油提取率影响主次顺序为温度>加酶量>反应时间>pH.对于pH值,K2>K3>K1,因此选择水平2为较优水平.同理可得加酶量、反应温度和反应时间的较优水平.因此较优水平条件为A2B3C2D2,即pH值为6,加酶量1.5%,时间为1 h,温度为50℃.

表1 正交试验设计结果分析Tab.1 Orthogonal experimental design and analysis
2.3 优化反应条件的结果验证
将以上优化的反应条件(pH=6,加酶量1.5%,时间为1 h,温度为50℃),进行3组平行试验验证,3组实验结果无明显差异,提油率为(63.9±1.0)%,表明试验优化的工艺条件是可行的.
2.4 理化指标的测定
所得粗大鲵油的各种理化指标与水产行业标准SC/T 3502—2000所规定的不同等级粗鱼油指标的对照见表2.实验所得粗大鲵油符合我国规定的二级粗鱼油标准.
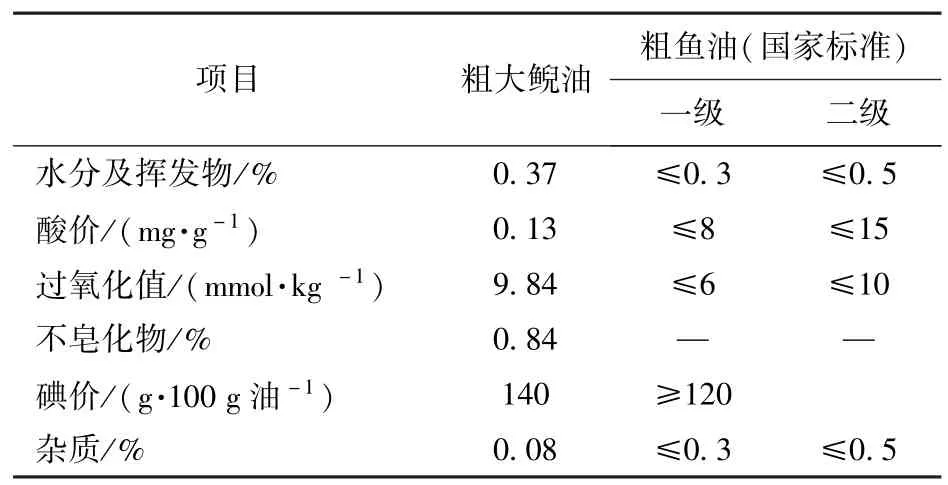
表2 粗鱼油的理化指标Tab.2 Physicochemical indexes of raw fish oil
2.5 粗大鲵油脂肪酸组成分析
按照GC-MS条件将甲酯化粗大鲵油样品进行测定,采用计算机检索和人工解析各峰相应的质谱图,用面积归一化法分析计算相对含量,结果见表3.
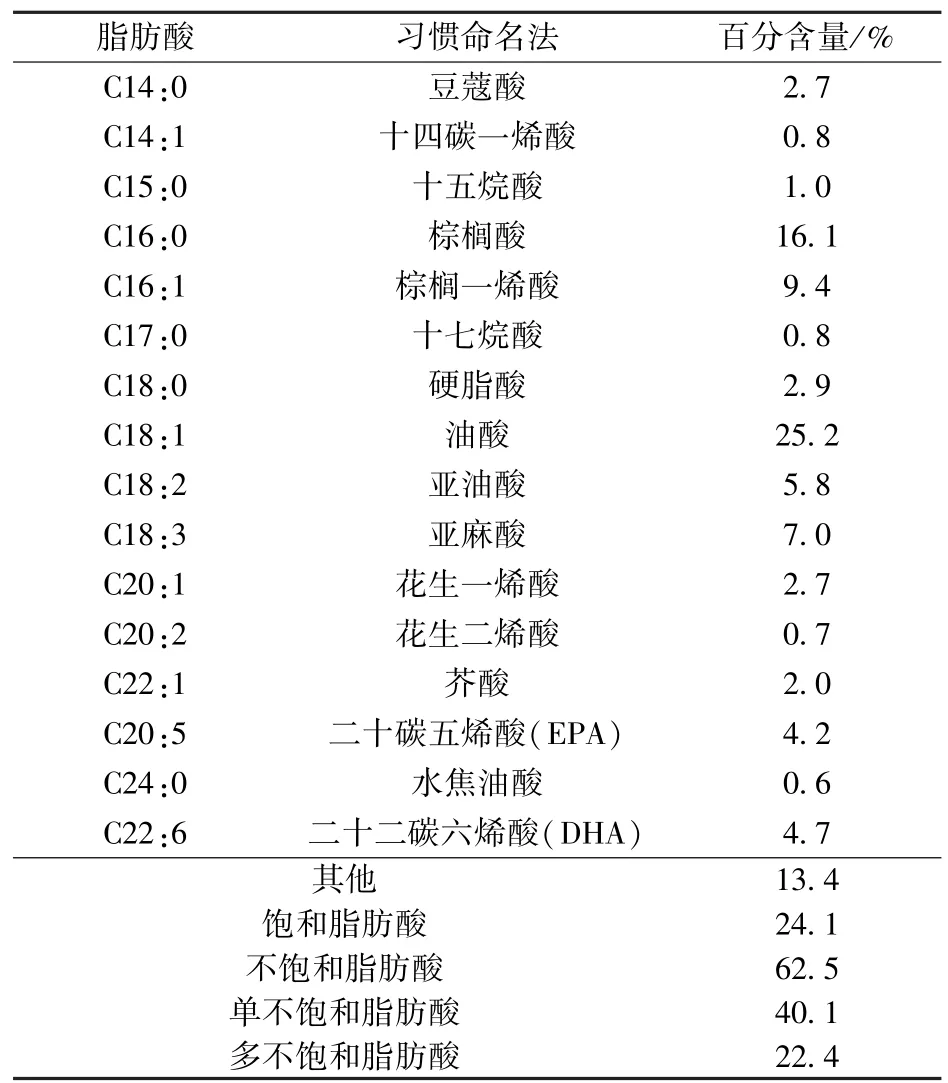
表3 脂肪酸组成分析Tab.3 Fatty acids compositions and contents
粗大鲵油甲酯化后,共检测到16种脂肪酸甲酯,其中,饱和脂肪酸占24.1%,棕榈酸最高为16.1%;不饱和脂肪酸占 62.5%,其中油酸占25.2%.单不饱和脂肪酸占40.1%,其中主要为油酸(25.2%),多不饱和脂肪酸为22.4%,主要为棕榈一烯酸(9.4%),其次为亚麻酸(7.0%);其中DHA、EPA分别为4.2%,4.7%.此外,还有一些非脂肪酸类物质,占13.4%.
3 结 论
以大鲵尾部脂肪组织为原料,采用碱性蛋白酶酶解工艺,利用正交试验法得到了大鲵油提取的最佳工艺,其碱性蛋白酶水解条件为温度为50℃,时间为1 h,加酶量1.5%,pH值为6,在该工艺条件下理论提油率为64.9%.通过3组平行试验验证,3组试验结果无明显差异,平均提油率为63.9%,表明优化后的实验条件可行.经过理化指标的测定发现所得粗大鲵油符合国家二级粗鱼油标准.对所得粗大鲵油进行脂肪酸组成和含量的测定,大鲵油中共检测到16种脂肪酸,饱和脂肪酸占37.5%,不饱和脂肪酸为62.5%,其中DHA为4.7%,EPA为4.2%.
参考文献:
[1] 李林强,昝林森,田万强,等.大鲵脂肪组织分布及其理化特性[J].西北农业学报,2010,19(2):7--10.
[2] Zhang Peng,Chen Yueqin,Liu Yifei,et al.The complete mitochondrial genome of the Chinese giant salamander,Andrias davidianus(Amphibia:Caudata)[J].Gene,2003,311(5):93--98.
[3] 张神虎.大鲵的药用价值及人工养殖[J].广西农业生物科学,2001,20(4):309-310.
[4] 宋鸣涛.秦岭太白山北坡两栖爬行动物[J].动物学杂志,1986(5):9--12.
[5] Chan S T H,Sandor T,Lofts B.A histological,histochemical,and biochemical study of the adrenal tissue of the Chinese giant salamander(Andrias davidianus Blanchard)[J].General and Comparative Endocrinology,1975,25(4):509-516.
[6] Lan Shucheng,Li Dongfeng,Jiang Jinchang,et al.Call and skin glands secretion induced by stimulation of midbrain in urodele(Andrias davidianus)[J].Brain Research,1990,528(1):159-161.
[7] 杨楚彬,罗凯坤,周海燕,等.大鲵输卵管的基本组织结构及其发育变化[J].湖南师范大学自然科学学报,2003,26(1):64--68.
[8] 王高学,白占涛.大鲵赤皮病病原分离鉴定及防治试验[J].西北农业大学学报,1999,27(4):71-74.
[9] Rafael Z,Edward M,Michael V,et al.Complete nucleotide sequence of the mitochondrial genome of a salamander,Mertensiella luschani[J].Gene,2003,317(23):17-27.
[10] Yang Liping,Meng Zining,Liu Yun,et al.Growth hormone and prolactin in Andrias davidianus:cDNA cloning,tissue distribution and phylogenetic analysis[J].General and Comparative Endocrinology,2010,165(2):177-180.
[11] 王军,于月英,李林强,等.中国大鲵油脂肪酸成分及流变性分析[J].食品科学,2009,30(24):405-408.
[12] 李林强,昝林森.中国大鲵肌内脂肪酸组成及其抗氧化研究[J].食品工业科技,2010(1):364-366.
[13] 黄世英,郭文韬,杨志伟,等.人工养殖大鲵肉营养成分分析[J].时珍国医国药,2009,20(5):1--2.
[14] 刘绍,孙麟,阳爱生,等.饲养中国大鲵氨基酸组成分析[J].氨基酸和生物资源,2007,29(4):53-55.
[15] 刘绍,阳爱生,彭国平,等.饲养中国大鲵软骨与肌肉中几种重要矿物质的ICP-AES法测定与分析[J].食品工业科技,2007,28(8):225-226.
[16] 杨代勤.大鲵可食部分水解,游离氨基酸的初步研究[J].水生生物学报,1990,14(3):286--288.
[17] 权清转,郭亮侠,蒋志武.大鲵肉氨基酸成分分析[J].淡水渔业,1987(4):39-40.
[18] 杨红生,杨干荣,王辉.大鲵六种组织中游离脂肪酸的分析[J].河南师范大学学报:自然科学版,1992,20(1):115-117.
[19] 罗庆华.中国大鲵营养成分研究进展及食品开发探讨[J].食品科学,2010,31(19):390-393.
[20] 王文莉,张伟,于新莹,等.大鲵肉酶解产物的制备及其抗氧化性的研究[J].河北渔业,2012,9:1-4.
[21] 李伟,于新莹,佟长青.大鲵黏液酶解产物的制备及其抗疲劳作用研究[J].食品工业科技,2011(6):146-148.
[22] 张神虎.大鲵的药用价值及人工养殖[J].特种经济动植物,2003,6(2):16-17.
[23] 陈德经,陈曦,方斌,等.大鲵不同部位的抑菌效果研究[J].安徽农业科学,2011,39(23):14109-14110.
[24] 洪鹏志,刘书成,章超桦,等.金枪鱼油的精炼及其脂肪酸组成特征[J].中国油脂,2006,31(6):90-93.

