类肝素酶、MMP-9在大鼠肺动脉高压模型肺组织中的表达及意义
王利梅
1 材料与方法
1.1 实验动物 雄性SD大鼠20只,体重250g~400g,由山西医科大学实验动物中心提供。
1.2 主要试剂 野百合碱(MCT),SABC试剂盒,基质金属蛋白酶抗体,DAB显色剂及苏木精,二抗(生物素化的羊抗兔IgG)。
1.3 主要器材 电子天平,彩色多普勒超声仪(philips iE33型),探头(L11-3线阵,频率3MHz~11MHz),压力传感器(YL-3和 YL-4型),生理记录仪(SJ-42型),显微镜,微波炉,电冰箱,恒温孵箱,BI-2000图像分析仪。
1.4 方法
1.4.1 大鼠肺动脉高压(PAH)模型的建立和分组 雄性(SD)大鼠,称取体重后,以2%野百合碱(MCT)按60mg/kg剂量一次性在大鼠背部脊柱旁皮下注射,诱导肺动脉高压模型。正常对照组则同期皮下注射等体积生理盐水。于注射后第21天(3周末)做彩色多普勒超声检查。随后测量平均肺动脉压(mPAP)和平均颈动脉压(mCAP)的变化。肺部组织做病理切片HE染色观察肺动脉结构的改变,确定肺动脉高压动物模型的成功建立。大鼠注射MCT后移于笼中,于清洁级环境,每笼饲养5只大鼠,自由进食。标准鼠食和饮自来水,室温调节在21℃±1℃。
1.4.2 大鼠肺动脉根部内径、肺动脉峰值流速的测量 大鼠称重,3%戊巴比妥钠腹腔注射麻醉,仰卧固定后,彩色多普勒超声测量各组大鼠肺动脉峰值流速、肺动脉根部内径。
1.4.3 平均肺动脉压和平均颈动脉压的测量 超声检测后,取胸骨正中切口,自右侧颈外静脉插管至肺动脉,同时行左侧颈总动脉插管,分别连接YL-3和YL-4型压力传感器,输入SJ-42型生理记录仪测定mPAP和mCAP。
1.4.4 右心室肥厚指数的测量 完成肺动脉压测量后,放血处死大鼠后,暴露心脏和肺,将完整心脏、肺一同取出,冷生理盐水冲洗干净,分离肺、右心室(RV)和左心室(包括室间隔,LV+S),滤纸蘸干称重,计算右心室肥厚指数:(RVHI)=RV/(LV+S)。
1.4.5 肺组织标本制备 在右心游离壁切取5mm厚的横截面标本,在左肺门处横断取一10mm×10mm×5mm大小的肺组织,10%的甲醛固定48h~72h。固定的标本经充分水洗,酒精脱水和二甲苯透明后,以石蜡包埋,连续切片,切片厚度5 μm。经HE染色(苏木素/伊红)后做病理组织形态学检查。并在100倍的光学显微镜下,观测直径100μm~200μm的呼吸性细支气管的终末小肺动脉的中膜厚度。
1.4.6 用免疫组化法检测类肝素酶、基质金属蛋白酶(MMP-9)肺组织切片厚约5μm,采用SABC法(北京博奥森生物技术有限公司即用型SABC试剂盒)在石蜡切片上测肺组织中类肝素酶、MMP-9的免疫组化表达,操作步骤按试剂盒说明书进行。一抗为基质金属蛋白酶抗体(北京博奥森生物技术有限公司),二抗为生物素化的羊抗兔IgG(北京中衫金桥生物有限公司),3,3-二氨基联苯胺(DABH2O2)显色,苏木素复染,封片。阴性对照以磷酸盐缓冲液(PBS)代替一抗,其他条件相同。染色判断标准:阴性为不着色,阳性呈棕黄色或棕色。
1.4.7 光镜观察标本 每只大鼠做2张HE染色切片用于观察肺小动脉的病理形态学改变情况,切片做常规HE染色后在显微镜下放大400倍观察。
免疫组织化学法检测两组肺组织类肝素酶、MMP-9的表达。采用计算机图像处理软件测定两组肺组织类肝素酶和基质金属蛋白酶MMP-9含量以免疫组织化学染色阳性单位(PU)表示。
1.5 统计学处理 采用SPSS 14.0软件完成,所有数据均进行正态性检验。数据以均数±标准差(x±s)表示,采用t检验和单因素方差分析检验,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠一般情况 对照组大鼠正常饮食、体毛光滑、体重增加,反应灵活。模型组逐渐减少饮食,体毛无光泽,体重减轻,反应迟钝,体毛无光泽。各组大鼠饲养过程中未出现死亡,行多普勒超声心脏检测和肺动脉测压过程中均顺利。
2.2 两组大鼠的肺动脉根部内径、肺动脉峰值流速变化(见表1)

表1 两组间肺动脉峰值流速、肺动脉根部内径比较(x±s)
2.3 两组mPAP、RVHI、mCAP比较 模型组的平均肺动脉压和右心室肥厚指数较对照组明显增高(P<0.01),而平均颈动脉压力差异无统计学意义(P>0.05)。详见表2。

表2 两组mPAP、RVHI、mCAP比较(x±s)
2.4 病理学观察 模型组可见肺组织表面凹凸不平,弹性很差,还可见到局灶性瘀血。在显微镜下观察,对照组大鼠肺动脉血管内皮细胞扁平连续,细胞分布均匀,无内皮细胞水肿坏死,肺动脉管壁结构正常。模型组大鼠肺小动脉管内皮细胞明显肿胀、坏死损伤明显,中层平滑肌细胞增生,胶原纤维增多,管壁呈不规则增厚、变形,管腔明显狭窄。管壁可见淋巴细胞浸润。
2.5 免疫组化结果 模型组MMP-9的表达显著高于对照组(P<0.01);类肝素酶模型组和对照组比较差异无统计学意义(P>0.05)。详见表3。
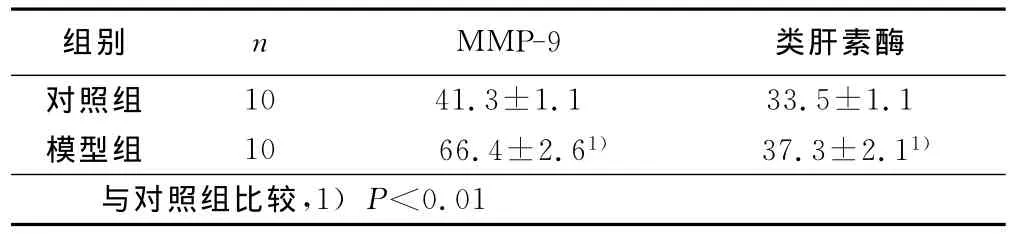
表3 两组间MMP-9、类肝素酶的比较(x±s)
3 讨 论
肺动脉高压分为原发性和继发性,原发性肺动脉高压发病机制不明,多数学者认为该病可能与家族遗传性有关,目前研究发现,PAH患者肺血管周围有大量的淋巴细胞和巨噬细胞浸润,这些炎性细胞释放的炎性因子能促使肺血管平滑肌细胞增殖、肺血管构型重建以及微血栓形成[1]。动物实验表明,无论是低氧还是野百合碱诱导形成的慢性肺动脉高压模型,其肺组织中都出现大量炎性细胞。在免疫反应的过程中,炎性细胞要通过血管内皮进入炎性反应部位的细胞外基质(ECM)。目前研究更倾向于强调ECM成分的改变对免疫反应的影响。ECM是由不同类型的蛋白聚糖、糖蛋白、糖胺多糖组成的复合物,在支撑和维持组织的完整性方面发挥着重要作用[2]。根据其作用特点有的学者也称它为机体的“第二道屏障”,除了结构上的重要性,ECM中所存在的一些细胞还能够释放调控因子,对免疫系统进行调控。这样ECM就成为了一个调控因子的特殊储藏库,其中包括大分子(如:胶原蛋白、纤连蛋白、硫酸乙酰肝素、蛋白多糖等)、蛋白酶及其抑制物、细胞因子等。这些因子成分的改变影响着免疫反应的结果。ECM成分改变受基质金属蛋白酶及其抑制物等进行调控[3]。
类肝素酶的主要的生物学作用表现在可以降解细胞外基质和基膜中的硫酸乙酰肝素蛋白多糖、弹性纤维以及胶原等成分,通常情况下与促进细胞外基质增生的因子之间维持动态平衡,从而保证了细胞外基质成分的稳定[4]。类肝素酶在细胞外基质中含量的变化都将会通过影响细胞外基质成分的改变而导致机体发生病理改变。在PAH的发病过程中,类肝素酶可能通过以下两种机制发挥作用:一方面类肝素酶分解肝素侧链后释放如表皮生长因子、血管内皮细胞生长因子、肝素结合的表皮生长样因子及其他生长因子与细胞因子促进细胞外基质的增生和血管生成,另一方面类肝素酶降解了肺组织细胞外基质中一些成分,使得细胞外基质和基膜的稳定性受到影响,间质组织变得疏散,有利于炎细胞通过血管内皮和基膜进入细胞外基质参与免疫反应[5]。
基质金属蛋白酶是一个大家族,因其需要Ca2+、Zn2+等金属离子作为辅助因子而得名,其家族成员具有相似的结构,一般由5个功能不同的结构域组成:疏水信号肽序列;前肽区,主要作用是保持酶原的稳定。当该区域被外源性酶切断后,MMPs酶原被激活;催化活性区,有锌离子结合位点,对酶催化作用的发挥至关重要;富含脯氨酸的铰链区;羧基末端区,与酶的底物特异性有关。其中酶催化活性区和前肽区具有高度保守性。各种MMP间具有一定的底物特异性,但不是绝对的。同一种MMPs可降解胞外基质成分,而某一种细胞外基质成分又可被多种MMPs降解,但不同酶的降解效率可不同。目前MMPs家族已分离鉴别出26个成员,编号分别为 MMP-1~26[6]。根据作用底物以及片断同源性,将MMPs分为4类。Ⅳ型胶原酶为其中重要的一类,它主要有两种形式,一种被糖化,分子量为92kD,命名为MMP-9;另一种非糖化,分子量为72kD,被称为MMP-2[7]。当前对 MMP-2、MMP-9的研究较深入。
MCT以往被学者们用来制作肺动脉高压动物模型。MCT单次注射后4周,大鼠可出现肺动脉内皮肿胀,内皮细胞凋亡,引起显著的进行性肺动脉中层增厚及外膜炎性改变,进而产生重度肺动脉高压[7]。这种肺动脉高压是注射野百合碱后引起的肺小血管的进行性器质性改变 。本实验尤其采用彩色多普勒超声方法测量各组大鼠肺动脉峰值流速、肺动脉根部内径。进一步肯定了野百合碱单次注射的方法建立肺动脉高压模型具有操作简便、对动物损伤小及成功率高等优点,尤其适用于啮齿类小动物,极大地降低了科研成本。因此,本模型可作为肺动脉高压相关研究的经济 、简便及可靠的动物模型,具有良好的实用性和可复制性。
本实验发现模型组肺动脉峰值流速、肺动脉根部内径显著高于对照组(P<0.01),对照组、模型组大鼠均无发现有肺动脉梗阻,均发现有大鼠三尖瓣返流现象发生;模型组的平均肺动脉压和右心肥厚指数较对照组明显增高(P<0.01),对照组、模型组平均颈动脉压力差异无统计学意义(P>0.05),提示野百合碱可以诱导肺动脉高压形成,对体循环压力无明显影响,即对肺动脉压力具有选择性抑制作用。光镜下发现由野百合碱引起的肺细小动脉内皮损伤和中膜平滑肌增生以及胶原的堆积,提示影响肺动脉管壁弹力纤维的异常堆积的因素除生成增加外,还有降解的方面。MMP-9、类肝素酶与它们的抑制物是调控肺动脉胶原纤维降解的主要分子。MCT引起的肺血管壁胶原纤维的异常沉积也可能是通过改变MMP-9、类肝素酶与它们的抑制物间的平衡,使胶原纤维降解减少所致[8]。在维持肺血管正常结构与功能的过程中,胶原纤维在肺血管中的沉积与降解之间保持平衡状态,一旦这种平衡状态被打破,肺血管胶原的产生增加或胶原的降解下降,甚至两种情况同时存在,都将导致肺血管重建。本研究发现模型组MMP-9的表达显著高于对照组(P<0.01),模型组类肝素酶的表达和对照组比较差异无统计学意义(P>0.05),提示可能通过抑制 MMP-9合成或降低 MMP-9活性,减少了平滑肌细胞周围基质成分的降解,平滑肌细胞分裂和增殖降低,使血管弹性增加,从而达到对肺动脉高压的防治作用,是否可能通过抑制类肝素酶合成或降低类肝素酶活性,达到对肺动脉高压的防治作用的机制有待于进一步研究。
综上所述,在肺动脉高压高危人群,早期采用某些药物干预MMP-9、类肝素酶的生成,可能具有保护肺血管和延缓肺动脉高压发生的作用,但由于动物模型肺动脉高压并不能完全反映人肺动脉高压情况,故对肺动脉高压高危人群防治作用的理论依据有待于进一步试验研究。
[1] Brenes GA.Anxiety and chronie obstructive pulmonary disease:Prevalene,impact,and treatment[J].Psychosom Med,2003,65:963-970.
[2] Vlodavsky I,Friedmann Y,Elkin M,et al.Mammalian heparanase:Gene cloning,expression and function in tumor progression and metastasis[J].Nat Med,1999,5(7):793-802.
[3] 陈瑞芬,周光德,曹文军,等.野百合碱诱导实验性肺动脉高压病理形态观察[J].电子显微学报,2008,21(1):1-4.
[4] Pan LC,Lame MW,Morin D,et al.Red blood cells augment transport of reactive metabolites of monocrotaline from liver to lung in isolated and tandem liver and lung preparations[J].Toxicol Appl Pharmacol,1991,110(2):336-346.
[5] Harrison W,Loscalz J.Pulmonary arterial hypertension[J].NJEM,2004,351:1655-1665.
[6] Estep JE,Lame MW,Morin D,et al.[14C]monocrotaline kinetics and metabolism in the rat[J].Drug Metab Dispos,2009,19 (1):135-139.
[7] Antoine VB,Frisdal E,Raffestin B et al.Inhibition of matrix metallo Proteinases by lung TIMP-1gene transfer limits monocrotaline-induced pulmonary vascular remodeling in rats[J].Human Gene Therapy,2008,14:861-869.
[8] Fanburg BL,Lee SL.A new role for an old molecule:Serotonin as a mitogen[J].Am J Physiol,2009,272:795-806.

