肺部肿瘤CT 引导下射频消融治疗及近期疗效分析
关利君 贾广志 崔宇 马和平
关利君, 贾广志, 崔宇, 等. 肺部肿瘤CT 引导下射频消融治疗及近期疗效分析[J/CD].中华介入放射学电子杂志,2013, 1(2): 114-118.
恶性肿瘤的发病率呈逐年上升趋势,其中肺癌居男性肿瘤发病率之首。目前最好的治疗方法是外科手术切除,由于患者年龄、心肺功能等原因失去手术机会,导致患者生存期缩短、治疗痛苦增加,是临床面临的现实问题。以局部瘤体细胞灭活为主要手段的肺癌射频消融(radiofrequency ablation,RFA)、经皮无水乙醇注射(percutaneous ethanol injection therapy,PEIT)等微创技术日趋成熟[1-5],笔者回顾分析32 例肺部肿瘤RFA 治疗结果并就其近期疗效进行探讨。
资料与方法
一、一般资料
2010 年10 月至2012 年10 月内蒙古医科大学附属第一医院32 例肺部肿瘤患者经病理证实后行RFA 治疗,其中11 例联合无水乙醇行化学消融治疗。患者中男性21 例,女性11 例;年龄27~85 岁,中位年龄69.5 岁,其中>75 岁患者10 例,有陈旧性心梗病史5 例,心脏冠脉支架植入治疗2 例;合并糖尿病11 例。32 例共38 个病灶,包括鳞状细胞癌7 例,腺癌(包括细支气管肺泡癌)19 例,腺鳞癌2 例,转移瘤4 例(原发肿瘤包括结肠癌2例4个病灶,胰腺癌1例,骨巨细胞瘤1例5个病灶);32 例共38 个病灶中近肺部周围者27 个,靠近肺门、心脏者11 个,其中累及纵隔或纵隔淋巴结转移者4 个。病灶直径为2.5~10.8 cm,平均5.8 cm。
二、消融治疗标准
患者治疗按照美国国立综合癌症网络(National Comprehensive Cancer Network ,NCCN)2011 年非小细胞肺癌(non-small cell lungcancer,NSCLC)临床实践指南(中国版)[6]进行,Ⅰ、Ⅱ期老年患者合并有心肺功能不全不能耐受手术或不愿手术患者,采取RFA 治疗;Ⅲ、Ⅳ以序贯化疗或同步化疗为主,治疗后3 个月复查病灶残留或无效,经穿刺病理确诊有肿瘤残留;对于重要脏器附近残留肿瘤和肺门区肿瘤或合并淋巴结转移的肿瘤,后期联合PEIT 或生物靶向药物治疗。
三、治疗方法
术前完善辅助检查,签署由该院伦理委员会批准的患者知情同意书,禁食水4 h,中央型肿瘤或合并淋巴结转移肿瘤,术前CT 增强扫描,建立静脉通路、心电监护、吸氧,腰背部或股骨外侧粘贴负极板,对于消融时间较长患者应注意负极板处皮肤降温,静脉镇痛麻醉+穿刺点局部表面麻醉。
根据病变位置选择合适体位,应用美国GE 公司LightSpeed VCT(64 排CT)病变区域扫描,扫描中嘱患者平静呼吸,扫描层厚及层间距5 mm,螺距0.625~1.5 mm,120 kV,80 mA;依据术前影像学检查及CT 扫描结果确定穿刺点并标记皮肤进针点,再次扫描核实进针点并确定穿刺深度及角度。穿刺点局部麻醉(1%利多卡因),避开肋骨、大血管、肺大疱,使用RITA 射频针(StarBurstTM XL)按穿刺计划快速穿刺到瘤体近端边缘;然后再次行CT 扫描,观察针尖位置;若针尖位置最佳时,从穿刺鞘内张开子电极,依据病灶大小逐级张开子电极,使子电极在肿瘤内成“伞”状分布(图1)。再次CT 监测张开子电极在病灶中的位置是否理想,位置不合适时,收回子电极,调整位置,重新张开。RFA 针尾部连接射频发生器开始消融治疗。RFA 治疗中采用多点温控监测,既要保证肿瘤治疗效果,也要避免局部病灶的过度消融而引起组织炭化,治疗温度设在90~100℃,单次消融时间15 min。对于消融电极不能一次覆盖的肿瘤,采用球型叠加方法进行消融治疗[7]。消融范围要在保证安全的基础上向病灶边缘外扩0.5~1.0 cm,以保证肿瘤周围形成无血管区域的环状保护带[7]。病灶消融结束后行穿刺针道消融,CT 复查观察病灶变化及有无气胸、出血等并发症,确定患者无异常后,穿刺点局部包扎,返回病房。
术后静卧2~3 h,常规补液量>1000 ml,如治疗时间较长适量增加补液量,对发热、咳嗽、咯痰及痰中带血等给予对症处理。部分靠近肺门、心脏大血管的残留肿瘤及纵隔淋巴结转移者,RFA 治疗后择期进行PEIT,对于可疑或存在远处转移的患者,后期辅助以化疗或生物靶向药物治疗。
四、随访
基于肺癌RFA 中的消融组织病理变化过程,近期疗效笔者采用实体肿瘤疗效评价标准[8](response evaluation criteria in solid tunmors,RECIST)及增强后肿瘤CT 值变化结合分析,复查时间为1、3、6 个月。
结 果
一、治疗效果
32 例肺部肿瘤患者接受RFA 治疗的病灶共38 个,病灶直径最小2.5 cm,最大10.8 cm,平均5.8 cm。瘤体直径≤4 cm 者均一次消融完成;瘤体直径>5 cm 或形态不规则者需要以球型叠加的方法行多次消融,最大一个直径10.8 cm 的肿瘤分7 个点叠加消融治疗(图2);RFA 消融时间15~105 min,平均消融时间45 min;RFA 结束后10 min内,CT 扫描显示所有病灶阴影较术前均有不同程度增大,平均体积增大约40%。密度不规则减低,出现液化坏死病灶21 个,病灶内气泡样改变12 个,病灶周围均出现磨玻璃样环状渗出影(图3)。
术后1 个月复查,肿瘤大小与术前基本相等,病灶密度由原来的动脉期及实质期增强转变为动脉期及实质期均无增强,病灶周围有“壁”样环状强化(图4),符合炎症强化征象。术后3.5 个月因心力衰竭死亡1 例,4、8 个月因脑转移各死亡1 例。术后3 个月CT 复查,病灶大小与原肿瘤相比,未出现肿瘤完全消失者(CR),肿瘤缩小者(PR)76.32%(29/38),肿瘤无变化者(SD)10.53%(4/38),肿瘤增大者(PD)13.16%(5/38)。病灶密度由术前的动脉期及实质期增强转变为动脉期及实质期无增强。11 例残留病灶后期进行经皮无水酒精化学消融(图5)。
二、并发症
患者术后未出现咯血、胸腔内出血及肋间动静脉出血;气胸2 例,约300 ml;反应性胸腔积液3 例,采用腹腔引流管闭式引流2~3 d 好转后拔管;术中剧烈咳嗽2 例,沿注水孔局部注入1%利多卡因后症状改善;胸痛5 例;对于术中出现的局部发热、出汗、心率加快未予特殊处理。治疗术后2~3 d 可有发热(体温37.5~38.5℃,以午后发热为主),术后3 d 内痰中少量带血、局部穿刺点疼痛等经对症处理后均缓解。围术期无死亡患者。
讨 论
一、RFA 治疗肺癌的循证医学
RFA 治疗是一种针对肿瘤局部的微创治疗手段,其目的是对肿瘤细胞进行局部灭活。NCCN2011 年NSCLC 临床指南[6]Ⅰ、Ⅱ期:适合手术者应该进行解剖学肺叶切除+纵隔淋巴结清扫或采样,不适合肺叶切除者应该采用亚肺叶切除(首选肺段切除,次选楔形切除),不适合手术者应该选择RFA 或立体定向放射治疗。近10 年来,肺叶切除作为早期肺癌的治疗标准已经受到挑战;一项回顾性研究比较了不适合肺叶切除的亚肺叶切除(25)例和RFA(22)例的治疗,结果显示总生存率和复发率差异无统计学意义[9]。RFA 治疗现已广泛用于无手术指征的肺癌治疗,甚至可以作为不能手术切除肺癌患者的替代或补充治疗,但是对于靠近肺门、心脏、大血管甚至是纵隔的肿瘤是相对禁忌证[5],RFA 治疗只起到瘤体部分灭活作用。
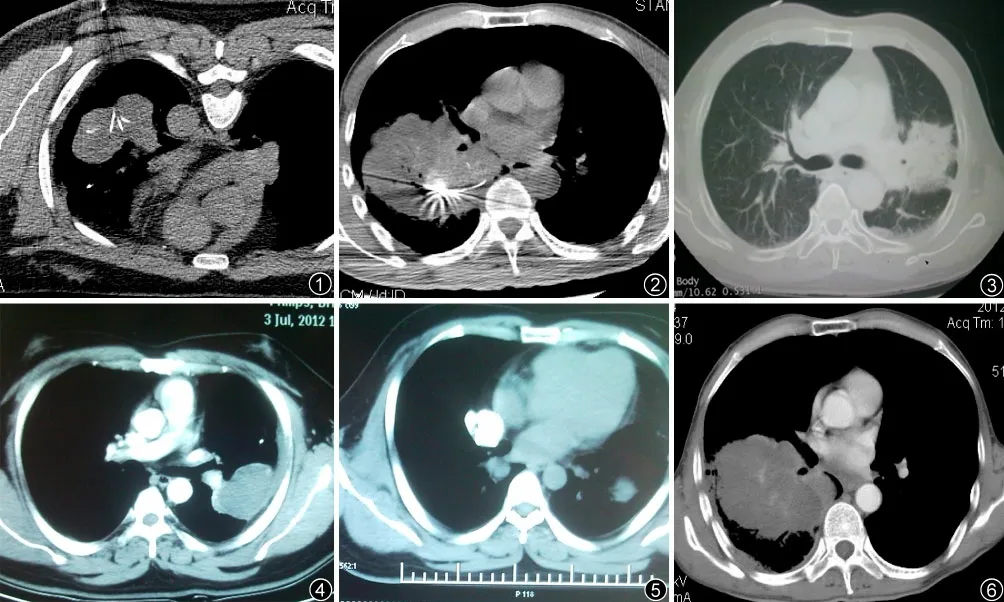
图1 骨巨细胞瘤术后2 年,双肺多发转移并化疗无效。对患者左肺下叶病灶行CT 引导下的RFA,右肺下叶靠近心脏病灶不能消融 图2 右肺下叶鳞状细胞癌,由于病灶大,分7 个不同点叠加RFA 图3 RFA 后病灶周围磨玻璃样渗出图4 RFA 术后3 个月复查,病灶缩小,实体肿瘤未见增强,边缘环状强化 图5 左肺下叶转移灶RFA 术后6 个月,右肺下叶靠近心脏病灶PEIT 后碘油沉积良好 图6 RFA 术后1 个月增强CT 复查,残留病灶明显强化,与消融区域有明显界线
RFA 是在传统经皮穿刺肺活检基础上,将射频电极精准刺入肿瘤组织内,施以射频电流,使电极针周围组织内极性分子处于一种激励状态,发生高速震荡,相邻分子相互撞击和摩擦,将射频能转化为热能。局部温度加热到39~40℃可导致癌组织停止分裂,41~42℃可杀死癌组织细胞或引起DNA的损伤,从而有效快速地杀死局部肿瘤细胞。细胞被加热到45~50℃,则细胞内的蛋白质变性、脂质层溶解、细胞膜被破坏、组织细胞凝固坏死;热量达到80~100℃,则可杀死局部肿瘤细胞+肿瘤周围的血管凝固形成一反应带,使之不能继续向肿瘤供血和肿瘤转移;同时治疗后的炎症反应可进一步导致肿瘤坏死,在1 个月进行影像学复查时病灶周围可见环状强化。RFA 治疗能降低非小细胞肺癌S期的比例[10]。正常肺组织解剖学结构决定了肺组织的散热特点,主要通过肺部大血管血液循环和呼吸散热,因此在肺部肿瘤RFA 治疗过程中,肿瘤周围正常肺组织起着隔热作用,加上肺部肿瘤血供较少,使得RFA 在肺部恶性肿瘤治疗中可以收到良好效果。
二、本组研究特点
本组中年龄>75 岁患者10 例,最大年龄85 岁,其中有陈旧性心梗病史5 例,心脏冠脉支架植入治疗2 例;32 例中合并糖尿病11 例。老年患者在手术中不仅要有适合RFA 治疗的体位,也要考虑到患者的舒适体位。射频电极产生的射频电流可以干扰心脏起搏器的正常电流,故装有心脏起搏器的患者是RFA 治疗的绝对禁忌证;而心脏冠脉支架和体内金属异物是相对禁忌证,其主要是担心射频电流通过金属异物会产生热量,导致局部器官损伤。本组有2 例患者为右肺肿瘤,笔者粘贴负极板时选择右侧肢体,并尽量缩短电流通过身体时间,以减少射频电流通过金属异物,避免在金属异物周围产生过多热量而引起局部组织坏死。
笔者采用CT 引导下行肺部肿瘤RFA,CT 扫描可以清楚地监测到穿刺针和消融子电极的位置、形态及其与重要脏器和肿瘤周围血管、细支气管的比邻关系,可以很好地预判消融效果和可能出现的并发症,同时可以随时发现并发症。本组32 例患者38 个病灶分别进行RFA 治疗,瘤体直径≤4 cm 肿瘤一次消融完成,较大肿瘤或形态不规肿瘤一次消融往往不能完全覆盖肿瘤,笔者借鉴大肝癌的RFA 治疗方法,采用球型叠加消融完成(图2);最大直径10.8 cm 的肿瘤分7 个点叠加消融治疗,术后1 个月增强CT 扫描可见右肺下叶肿瘤大部分坏死、未见影像学增强,与残留的纵隔肿瘤有明显的消融界线(图6)。对于最大直径5 cm 的周围性非小细胞癌,RFA 治疗可以一次性使肿瘤组织原位灭活,但靠近心脏、大血管、肺门区域肿瘤,或是较大肿瘤常合并有肺门淋巴结及纵隔淋巴结转移者,单纯RFA 治疗则病灶不能局部完全灭活,需要后期进行联合治疗,笔者采用肿瘤化学消融及化疗或靶向药物治疗收到良好效果。在RFA 治疗后,瘤体组织坏死、气化、反应性渗出及肿瘤周围正常组织的消融等原因,体积会增大,病灶密度减低。本组患者病灶消融后体积增大10%~50%不等,其中转移瘤和腺癌在RFA 治疗后体积增大更加明显,是否与其组织学特点有关有待进步研究。
三、并发症分析
本组32 例患者38 个病灶,在RFA 治疗后未出现咯血;痰中带血6 例,术中患者剧烈咳嗽1 例。结合文献[11]分析,此类症状是因为瘤体内或瘤体周围有细小支气管在RFA治疗中造成热损伤所致,对症处理或经注水孔局部注射利多卡因缓解;发生气胸2 例,与胸膜反复穿刺有关[12],预防或减少气胸需要患者呼吸配合(穿刺及治疗时切不可深呼深吸或频繁咳嗽),快速通过胸膜,减少胸膜穿刺次数,穿刺针道避开肺大疱。靠近胸膜的5 个病灶,患者在术中出现胸痛,调低治疗温度到70℃后耐受3~5 min,再次升温到90℃好转[11]。笔者在工作中发现,垂直于胸膜穿刺,在消融时推开胸膜可改善疼痛症状,此外改变体外穿刺针手柄方向使子电极与胸膜分离亦可改善症状;由于高温的电极针可以灼伤邻近病灶胸膜导致反应性胸腔积液,笔者采取放置胸腔引流管后引出血性胸腔积液,术后第二天胸腔积液不再继续增加,观察1 d 后可以拔管。
结 论
非小细胞肺癌CT 引导RFA 治疗是安全有效的微创方法,在治疗过程中要掌握一些技术要点,同时也存在一定的局限性。总结如下:①局麻+静脉镇痛麻醉,患者意识清醒、自主呼吸,在肺组织正常呼吸状态下如何能准确穿刺到肿瘤靶点是治疗的关键。②采用叠加消融时,注意肿瘤的全覆盖,不可有叠加的残留,同时应避免叠加区域的过度消融而引起组织炭化。③肿瘤周围的小血管、小气管及肺大疱可能会引发肺内出血、咯血、气胸等并发症,应充分认识图像,提前准备好处理预案。④对张开子电极位置的判断和消融范围的预判是减少并发症的关键。⑤邻近心脏、大血管、肺门等重要脏器的病灶及肺门、纵隔转移淋巴结,基于安全考虑消融治疗范围要远离重要脏器1 cm 以上。故肺部肿瘤RFA 治疗需合理有序联合其他治疗,如PEIT治疗、支气管动脉灌注化疗、放疗、全身静脉化疗、生物基因治疗、中医治疗等方法才能进一步提高恶性肿瘤的治疗效果。
1 Lencioni R, Crocetti L, Cioni R, et al. Response to radiofrequency ablation of pulmonary tumours: a prospective, intention-to-treat,multicentre clinical trial (the RAPTURE study). Lancet Oncol, 2008,9(7): 621-628.
2 Hiraki T, Gobara H, Iishi T, et al. Percutaneous radiofrequency ablation for clinical stage Ⅰnon-small cell lung cancer: results in 20 nonsurgical candidates. The Journal of thoracic and cardiovascular surgery, 2007, 134 (5): 1306-1312.
3 Simon CJ , Dupuy DE , DiPetrilloTA, et al. Pulmonary radiofrequency ablation: long-term safety and efficacy in 153 patients. Radiology,2007, 243(1): 268-275.
4 Lanuti M, Sharma A, DigumarthySR, et al. Radiofrequency ablation for treatment of medically inoperable stage Ⅰ non-small cell lung cancer. J thorac Cardiovasc Surg, 2009, 137(1): 160-166.
5 Pennathur A, Abbas G, Gooding WE, et al. Image-guided radiofrequency ablation of lung neoplasm in100 consecutive patients by a thoracic surgical service. Ann Thorac Surg, 2009, 88 (5): 1601-1608.
6 Xue C, Hu Z, Jiang W, et al. National survey of the medical treatment status for non-small cell lung cancer (NSCLC) in China. Lung Cancer 2012, 77(2): 371-375.
7 陈敏华, Goldberg SN.肝癌射频消融—基础与临床.北京: 人民卫生出版社, 2009.
8 Gaur SK, Friese JL, Sadow CA. Hepatic arterial chemoembolization using drug-eluting beads in gastrointestinal neuroendocrine tumor metastatic to the liver. Cardiovasc Intervent Radiol 2011 Jun, 34(3):566-572.
9 郑加生,李宁,袁春旺.CT 引导肝肿瘤消融治疗学. 北京:人民卫生出版社, 2011.
10 Zemlyak A, Moore WH, Bilf inger TV, et al. Comparison of survival after sublobar resections and ablative therapies for stage I non-small cell lung cancer. Stony Brook University Medical Center, Stony Brook, NY 11790, USA. J Am Coll Surg 2010, 211(1): 68-72.
11 谢强,邹冰心,刘颖,等. 射频消融治疗对非小细胞肺癌患者细胞凋亡及细胞周期的影响.广东医学, 2011, 32(5): 631-632.
12 刘宝东,支修益,刘磊,等.CT 引导下射频消融治疗中晚期非小细胞肺癌的期疗效观察.中国肺癌杂志, 2009, 12(7): 775-779.
13 关利君,关丽英,马和平. CT 引导经皮胸部病变切割针穿刺及常见并发症. 内蒙古医学杂志, 2007, 39(7): 819-821.

