外周血单核细胞TLR2、TLR4与急性胰腺炎肺损伤的关系
蒋海弦,李天舒,顾国宝,周鸣清,陆仁达
(上海闸北区中心医院,上海200070)
急性胰腺炎(acute pancreatitis,AP)是胰酶引起的一种化学炎症反应性疾病,其出血坏死型(acute necrotizing pancreatitis,ANP)病情凶险,预后差,病死率高达50%左右。急性胰腺炎相关性肺损伤(acute pancreatitis-associated lung injury,APALI)是AP最常见的并发症,是患者早期死亡的重要原因.炎症介质的互相激活和级联反应是APALI的重要发生机制之一。多种炎性因子参与了急性胰腺炎肺损伤的发生,如IL-6,TNF-α,p物质等,其中涉及多种细胞如内皮细胞、单核细胞等[1]。最近研究发现[2],toll样受体(toll-like receptor,TLR)参与了急性胰腺炎并发肺损伤的过程,敲除TLR4基因的小鼠,急性胰腺炎炎症程度减轻且肺损伤明显减少。但TLR是否与急性胰腺炎肺损伤的发生相关,仍缺乏临床资料。本研究拟回顾分析本院收治的急性胰腺炎患者外周血单核细胞TLR2、4的表达与急性胰腺炎合并肺损伤的关系。
1 资料与方法
1.1一般资料
选取2010年01月-2011年06月我科收治的急性胰腺炎患者30例,其中男性16例,女性14例;年龄21-62岁(平均45.9±12.2岁);并选择10例体检健康人群作为对照,其中男女性各5例,年龄35-64岁(平均51.1±12.6岁)。
1.2诊断标准
急性胰腺炎诊断标准:符合急性胰腺炎的临床征象(腹痛、腹胀、恶心呕吐、腹部压痛等);入院时血淀粉酶大于正常上限3倍或以上;有或无影像学诊断(B超或C T)者,无论病情轻重均纳入(参照1992年亚特兰大会议标准[3]或1996年中华医学会外科学会胰腺学组标准[4]。
1.3外周血单核细胞TLR mRNA表达检测
空腹肘静脉全血5ml,参考文献报道方法[5],采用Ficoll-Hypaque密度分离法分离外周血单核细胞,Trizol抽提总RNA,逆转录成cDNA(Promega公司),等量cDNA依照PCR Kit(Invitrogen公司)提供的步骤进行PCR。参考文献,其引物序列如下:TLR2(6)上游引物CCCAGGAAAGCTCCCAGCAG,下 游 引 物 GGAACCTAGGACTTTATCGCAGCTC;TLR4(7)上游引物CATTCAAGACCAAGCCTTTCAG,下 游 引 物 CCAGGTTTTGAAGGCAAGTTTT;GAPDH(7)上游引物 TGCACCACCAACTGCTTAG,下 游 引 物GGATGC AGGGATGATGTTC。反应条件为94℃预变性7min,94℃变性30s,60℃退火30s,72℃延伸1min,共33个循环。PCR产物加样于2%琼脂糖凝胶,电泳,紫外灯下观察,凝胶分析系统拍照。Quantity one软件分析,目的基因/GAPDH值为相对表达量。按TLR2与TLR4mRNA相对表达量,将急性胰腺炎患者分为TLR2、4高表达组(≥2倍健康组)与低表达组(<2倍健康组)。
1.4统计分析所有数据采用SPSS 17.0统计软件包处理,其中不同组别间计量资料比较采用t检验;不同分组中急性胰腺炎肺损伤的比较,采用卡方检验,P<0.05认为有统计学意义。
2 结果
与健康组相比较,急性胰腺炎患者外周单核细胞TLR2与TLR4mRNA表达明显升高(P<0.01)。(图1)
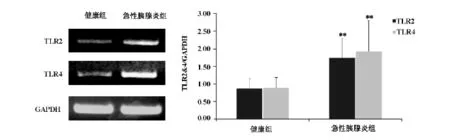
图1 急性胰腺炎TLR2与TLR4蛋白表达
按TLR2mRNA表达水平将急性胰腺炎患者分为两组:TLR2高表达组(≥2倍健康组)与TLR2低表达组(<2倍健康组),TLR2的表达与急性胰腺炎并发肺损伤无明显相关(P=0.105),不同TLR2mRNA表达组的急性胰腺炎患者发生肺损伤的OR值3.677倍,但无统计学意义(95%CI:0.733-18.332)(表1)。

表1 不同外周单核细胞TLR2表达急性胰腺炎肺损伤比较
按TLR4mRNA表达水平将急性胰腺炎患者分为两组:TLR4高表达组(≥2倍健康组)与TLR4低表达组(<2倍健康组),TLR4的表达与急性胰腺炎并发肺损伤明显相关(P<0.01),不同TLR4mRNA表达组的急性胰腺炎患者发生肺损伤的 OR 值为 18,有统计学意义 (95%CI:2.756-117.544)。

表2 不同外周单核细胞TLR4表达急性胰腺炎肺损伤比较
3 讨论
急性胰腺炎(AP)的发病机制复杂、病程凶险,病死率极高,在其胰外损伤中以急性肺损伤(ALI)最为突出,甚至可继发急性呼吸窘迫综合征(ARDS)。如何能早期发现或预测急性胰腺炎并发肺损伤的患者,争取早期的干预,对于减少急性胰腺炎病死率有着重要的临床意义。
研究发现,AP中常伴发肠源性内毒素血症,脂多糖(LPS)浓度常常增高[8]。TLR家族是LPS的受体,主要分布在单核/巨噬细胞表面的TLR4、TLR2对LPS炎症信号向胞内转导中起主要作用[9]。TLR2、TLR4与LPS结合后,通过激活单核细胞内的NF-κb信号通路,促进炎性因子如IL-1、TNF等的分泌,从而在急性胰腺炎发生中起着重要的作用[10]。本研究中,我们检测急性胰腺炎的单核细胞TLR2与TLR4的表达,发现TLR2及TLR4mRNA表达水平明显增高,这与前期的研究结果一致。
多项研究表明,AP肺损伤与肺组织内有大量炎性细胞浸润,包括中性粒细胞及单核细胞,单核/巨噬细胞在AP并发肺损伤的发生中起着重要作用[11]。AP发生时,肺部的炎症反应会促使LPS的大量增多,通过TLR受体激活肺部聚集的单核/巨噬细胞,导致肺血管内皮功能的损伤,并抑制Fas基因的表达,减少炎性细胞的凋亡[12,13],这提示 LPSTLR轴在单核细胞的激活可能是肺损伤发生的关键机制。本研究中,我们通过检测AP并发肺损伤患者单核细胞的LPS主要受体TLR2与TLR4表达,并将其分为(≥2倍健康组)与TLR2低表达组(<2倍健康组),发现TLR2的表达与AP肺损伤发生之间无明显相关;而TLR4的表达与AP并发肺损伤明显相关,高表达TLR4的患者AP并发肺损伤风险是低表达的18倍,这提示AP单核细胞TLR4的表达高低是AP并发肺损伤的危险因素。前期研究发现,尽管TLR2与TLR4均是LPS的受体,但TLR4主要介导革兰氏阴性菌引起的炎性反应,是LPS在单核细胞效应的主要介导者[9,14],这可能是TLR4而不是TLR2的在单核细胞的表达是AP并发肺损伤的危险因素。
值得注意的是,本研究虽然提示TLR4的单核细胞的表达是AP并发肺损伤的危险因素,但由于本研究样本量偏小,这可能会造成研究结果的偏倚;另外,由于研究条件的限制,本研究中没有排除患者基础的炎症及免疫状态对单核细胞TLR4预先激活的影响,这些均需要后续深入研究。尽管如此,本研究通过病例对照发现TLR4在单核细胞的表达是AP并发肺损伤的一个危险因素,为AP并发肺损伤的高危人群筛选提供了一个潜在的指标。
[1]许 威 夏,陈 虹.炎症介质与急性胰腺炎相关性肺损伤[J].世界华人消化杂志,2006,14(12):1188.
[2]Sharif R,Dawra R,Wasiluk K,Phillips P,Dudeja V,Kurt-Jones E,Finberg R,Saluja A.Impact of toll-like receptor 4on the severity of acute pancreatitis and pancreatitis-associated lung injury in mice[J].Gut,2009,58(6):813.
[3]Bradley EL,3rd.A clinically based classification system for acute pancreatitis.Summary of the international symposium on acute pancreatitis[J].Arch Surg,1993,128(5):586.
[4]中华医学会外科学会胰腺学组.急性胰腺炎的临床诊断及分级标准[J].中华外科杂志,1997,35(12):773.
[5]刘文佳,周 洪,王晓荣.体外诱导脐血单核细胞分化为破骨样细胞的研究[J].西安交通大学学报(医学版),2007,28(5):551.
[6]Lew BL,Sim WY,Kim NI.Expression of toll-like receptor 2in cultured human keratinocytes:The effect of bacterial antigens,cytokines and calcium concentration[J].Ann Dermatol,2009,21(4):337.
[7]Lim BJ,Lee D,Hong SW,et al.Toll-like receptor 4signaling is involved in iga-stimulated mesangial cell activation[J].Yonsei Med J,2011,52(4):610.
[8]Pascual JL,Khwaja KA,Ferri LE,et al.Hypertonic saline resuscitation attenuates neutrophil lung sequestration and transmigration by diminishing leukocyte-endothelial interactions in a two-hit model of hemorrhagic shock and infection[J].J Trauma,2003,54(1):121.
[9]Vabulas RM,Ahmad-Nejad P,Costa C,et al.Endocytosed hsp60s use toll-like receptor 2 (tlr2)and tlr4to activate the toll/interleukin-1receptor signaling pathway in innate immune cells[J].J Biol Chem,2001,276(33):31332.
[10]Pandey S,Agrawal DK.Immunobiology of toll-like receptors:E-merging trends[J].Immunol Cell Biol,2006,84(4):333.
[11]Misharin AV,Scott Budinger GR,Perlman H.The lung macrophage:A jack of all trades[J].Am J Respir Crit Care Med,2011,184(5):497.
[12]Chooklin S.Pathogenic aspects of pulmonary complications in acute pancreatitis patients[J].Hepatobiliary Pancreat Dis Int,2009,8(2):186.
[13]Yubero S,Ramudo L,Manso MA,De Dios I.Targeting peripheral immune response reduces the severity of necrotizing acute pancreatitis[J].Crit Care Med,2009,37(1):240.
[14]Re F,Strominger JL.Toll-like receptor 2(tlr2)and tlr4differentially activate human dendritic cells[J].J Biol Chem,2001,276(40):37692.

