桦褐孔菌中羊毛脂烷型三萜系列化合物的探讨
麦勤勤,陈寅生,程丽红,邵丽丽,吴花粉,孙明丽,武小红
(河南大学 药学院,河南 开封 475004)
桦褐孔菌(Inonotus obliquus)为多孔菌科的药用真菌,分布于北半球45°~50°的地区。在我国的黑龙江、吉林两省资源较为丰富,民间用于治疗一些恶性肿瘤[1]。药理实验[2-4]表明,桦褐孔菌能抑制HTC和ZHC肝癌细胞、瓦克癌肉瘤W256细胞、人MCF-7乳腺癌细胞、白血病P388细胞等多种癌细胞的生长,同时桦褐孔菌还具有抗病毒、抗炎及保肝等广泛生物活性。药效物质基础研究[5]发现,其主要有效成分为四环三萜类化合物,并有报道[6]对其中三萜进行生物转化的研究。
桦褐孔菌中羊毛脂烷型三萜类化合物大多数具有同一结构的母核,即羊毛甾母核,相同的母核决定了它们具有许多的相同之处,而不同的取代基又使它们呈现出不同的性质。我们的实验对桦褐孔菌中的羊毛脂烷型三萜系列化合物进行了分离制备,并总结了其色谱行为、理化性质、波谱数据等诸方面的一些规律。
1 仪器与试剂
AVANCE 400M型核磁共振仪(1H-NMR:300 MHz,13C-NMR:75 MHz,德国Bruker公司);Esquire LC质谱仪(德国Bruker公司);XT6显微熔点测定仪(北京市科技电光仪器厂);Agilent 1260型HPLC仪(美国Agilent公司);半制备HPLC 色谱柱为Sinochrom ODS-BP (10 mm ×250 mm,10μm),(大连依利特分析仪器厂);色谱甲醇(天津市四友精细化学品有限公司);Sephadex LH-20(Pharmacia公司);Rp-18柱层析材料、Rp-18高效薄层预制板(Merck公司);柱色谱用硅胶300~400目、薄层层析用硅胶GF254(青岛海洋化工厂);实验所用其他化学试剂均为分析纯。
2 提取及分离
取桦褐孔菌干燥子实体粉末1000g,用体积分数为95%乙醇回流提取3次,每次1h,合并3次提取液,减压回收溶剂后得乙醇提取物56g。用水将乙醇提取物均匀分散后,依次用石油醚、乙酸乙酯和正丁醇萃取,萃取用溶剂与水层体积比均为1∶1,各萃取4次,分别得到石油醚萃取物2.3g、乙酸乙酯萃取物26.8g、正丁醇萃取物17.0g和水层残留物8.7g。取乙酸乙酯萃取物10g,进行硅胶柱层析,用石油醚-乙酸乙酯(100∶0→0∶100)梯度洗脱,得到化合物1(37mg)和7个馏分Fr.1~Fr.7。将其中Fr.1馏分进行硅胶柱层析,用石油醚-乙酸乙酯(10∶1→3∶1)梯度洗脱,得到化合物2(134mg)和5个馏分Fr.1-1~Fr.1-5。将其中Fr.1-2馏分进行ODS开放柱层析,用甲醇-水(85%→100%)梯度洗脱,得到化合物3(56 mg)。将Fr.3馏分进行硅胶柱层析,用氯仿-丙酮(30∶1→8∶1)梯度洗脱,得到5个馏分Fr.3-1~Fr.3-5,继而将Fr.3-4进行半制备HPLC,甲醇-水(82∶18)洗脱,在保留时间41.9min和46.5min处分别得到化合物4(23mg)和化合物5(16mg)。将Fr.4馏分进行硅胶柱层析,用氯仿-甲醇(15∶1→8∶1)梯度洗脱,得到化合物6(106mg)。
3 结构鉴定
3.1 化合物1
白色针晶(MeOH),熔点137.2~137.8℃。1H-NMR(CDCl3):在高场区可见δ0.70(3H,s),0.82(3H,s),0.89(3H,s),0.99(3H,s),1.01(3H,s)5个角甲基的尖峰,这是四环三萜类化合物的典型特征;0.93(3H,d,J=6.4Hz)为21-CH3峰,被20- 位质子偶合而裂分为双峰,1.62(3H,s)和1.70(3H,s)为26-CH3和27-CH3两个烯丙位的甲基峰。另外可见3.26(1H,dd,J=4.8,11.6Hz,H-3),5.11(1H,t,J=1.2,6.4Hz)则是24位双键上的质子信 号。13C-NMR(CDCl3):δ79.007为C-3 信 号,134.38、134.38、130.97、125.25存在4个烯碳信号,其13C-NMR数据与文献[7]报道的羊毛甾醇对照一致。故鉴定化合物1为羊毛甾醇。
3.2 化合物2
白色针晶(MeOH),熔点182.1~182.9℃。1HNMR(CDCl3):在高场区可见δ0.69(3H,s),0.71(3H,s),0.84(3H,s),0.95(3H,s),0.96(3H,s)5个角甲基的尖峰;0.91(3H,d,J=6.6Hz)为21-CH3峰,1.62(3H,brs)和1.71(3H,brs)为26-CH3和27-CH3两个烯丙位的甲基峰,因发生烯丙偶合而使峰展宽。另外可见3.19(1H,dd,J=4.6,6.8Hz,H-3),3.63(1H,m,H-21),5.16(1H,t,J=6.8,7.0 Hz,H-24)。13C-NMR(CDCl3):δ78.83为C-3信号,73.44为侧链上与-OH相连的C-21信号,134.87、134.51、134.11、121.36存在4个烯碳信号,其13C-NMR数据与文献[8]报道的inotodiol对照一致。故鉴定化合物2为inotodiol。
3.3 化合物3
白色针晶(MeOH),熔点145~146℃。1H-NMR(CDCl3):在高场区可见δ0.69(3H,s),0.81(3H,s),0.91(3H,s),0.97(3H,s),1.00(3H,s)5个角甲基的尖峰;1.57(3H,s)和1.68(3H,s)为26-CH3和27-CH3两个烯丙位的甲基峰。5.06(1H,t,J=7.1Hz)是24位双键上的质子信号,9.47(1H,d,J=5.7Hz)则是20位上的质子信号。13C-NMR(CDCl3):δ78.96为C-3信号,134.72、133.93、132.46、123.54存在4个烯碳信号,206.29为与C-20相连的-CHO 上的碳信号,其13C-NMR数据与文献[9]报道的3β-hydroxy-lanosta-8,24-diene-21-al对照一致。故鉴定化合物3为3β-hydroxy-lanosta-8,24-diene-21-al。
3.4 化合物4
白色针晶(MeOH),熔点290~292℃。1H-NMR(CDCl3/CD3OD,2∶1):在高场区可见δ0.46,(3H,s),0.53(3H,s),0.61(3H,s),0.72(3H,s),0.72(3H,s)5个角甲基的尖峰;0.61(3H,d,J=5.4Hz)为21-CH3峰,0.93(3H,s)和0.95(3H,s)为26-CH3和27-CH3的甲基峰,另外可见2.92(1H,t,J=7.6,8.5 Hz,H-3),3.58(1H,m,H-24),4.00(1H,m,H-22)。13C-NMR(CDCl3/CD3OD,2∶1):δ78.12为C-3信号,134.21、133.74两个烯碳信号,其13C-NMR数据与文献[10]报道的inonotsuoxide A 对照一致。故鉴定化合物4为inonotsuoxide A。
3.5 化合物5
白色针晶(MeOH),熔点240~242℃。1H-NMR(CDCl3/CD3OD,1∶2):在高场区可见δ0.73(3H,s),0.78(3H,s),0.87(3H,s),0.96(3H,s),0.98(3H,s)5个角甲基的尖峰;0.92(3H,d,J=8.4Hz)为21-CH3峰,1.20(3H,s)和1.13(3H,s)为26-CH3和27-CH3的甲基峰。另外可见3.97(1H,m,H-24),4.00(1H,m,H-22)。13C-NMR(CDCl3/CD3OD,1∶2):δ77.57为C-3 信号,133.35、133.96 两个烯碳信号,其13C-NMR 数据与文献[10]报道的inonotsuoxide B 对照一致。故鉴定化合物5为inonotsuoxide B。
3.6 化合物6
白色针晶(MeOH),熔点244.8~246.7℃。1HNMR(DMSO):在高场区可见δ0.68(3H,s),0.69(3H,s),0.88(3H,s),0.90(3H,s),0.91(3H,s)5个角甲基的尖峰,是四环三萜类化合物的典型特征;1.53(3H,s)和1.63(3H,s)为26-CH3和27-CH3两个烯丙位的甲基峰。5.07(1H,t,J=7.2,7.0Hz)是24位双键上的质子信号,12.07 则是20位的质子信号。13C-NMR(DMSO):δ77.20为C-3 信号,134.72、133.80、131.61、124.28存在4个烯碳信号,177.52为与C-20相连的 -COOH 上的碳信号,其13C-NMR数据与文献[11]报道的trametenolic acid对照一致。故鉴定化合物6为trametenolic acid。
4 化合物结构及性质分析
4.1 光谱性质
化合物1~6母核(见图1)相同,只是17- 侧链结构不同。由于分子中均不存在共轭系统,故侧链上发生取代基变化时,均通过诱导效应影响其相邻的2~3个碳的化学位移。如化合物2与化合物1 比较,发生22-OH 取代后,17、20、21、23、24、25- 位化学位移均发生相应变化(见表1),其他化合物亦然。每一个有机化合物分子内部都是一个有机的整体,任何位置发生取代基的变化,都会使整个分子中的电子云密度发生变化,只是变化显著者才有明显的化学位移的变化。由表1可以看出,虽然化合物1~6的结构母核完全相同,但1~17位碳化学位移却不尽相同,因为化合物1~6结构中取代基不尽相同,整体分子中的电子云密度也不相同,故表现为相同结构母核上的碳化学位移略有差异。化合物4和5互为构型异构体,它们除了在22、25、26、27- 位碳处表现出较小的差异之外,其他位置均一致。故实验对其进行了HNMR、CNMR、HSQC、HMBC、DEPT、NOESY 等全面的核磁共振谱测定,以准确归属其C和H。
4.2 色谱行为
在硅胶色谱(正相色谱)中,化合物的极性越大,越易被固定相吸附,Rf越小,而基团的极性大小顺序为羧基>醛基>羟基,故表2中化合物1~6的Rf值依次减小,化合物4和5由于极性相近而难以分离。
4.3 颜色反应
由表2可以看出,化合物1~6显色后所呈现的颜色均为红色系,这也是三萜区别于甾体类化合物的显著特征之一。由于此类颜色反应过程主要是使羟基脱水,增加双键结构,再经双键移位、双分子缩合等反应生成共轭双烯系统,又在酸作用下形成阳碳离子而呈色,故化合物1~6中羟基较多者形成的共轭链就长,呈色也就越深,如化合物4和5。同理,结构中原有的不饱和键越多,呈色也越深,如化合物3和6,其中,化合物6的颜色最深,推测是因为其结构中含有的强极性基团羧基,对pH的影响更敏感,故在硫酸作用下更易呈色。
4.4 熔点
由于在碳原子数目相同的情况下,分子中的极性基团越多,则分子间作用力越大,熔点也越高,反之亦然。表2中化合物1的熔点最低,因为它只有一个羟基,而其他化合物的羟基数目多于1。其次,由于羟基中的活泼氢能与另一分子中的电负性原子O 形成氢键,而使熔点升高,故表2中化合物2的熔点高于化合物3,因为化合物3中少了一个羟基,而其醛基中虽有电负性原子O,但缺乏活泼氢,故形成氢键的能力降低。此外,分子的立体结构即分子的形状会影响其在固体晶格中排列的紧密程度,进而影响其熔点的高低,故表2中化合物4和5虽然所含极性基团的类型及数目均相同,但是由于它们的立体结构不同(为构型异构体),故熔点有差别。
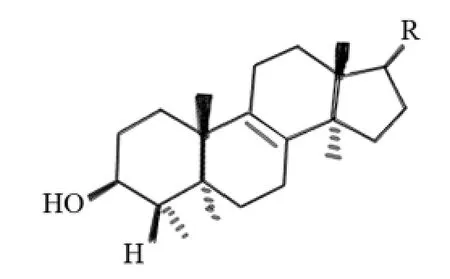
图1 化合物1~6的结构母核

表1 化合物1~6的13C-NMR数据(100 MHz)

表2 化合物1~6的结构及理化性质
5 首次报道化合物4、5的DEPT和HSQC谱
化合物4和5在文献[10]中被首次报道,并通过理化性质及IR、UV、NMR、MS等将其鉴定为inonotsuoxide A和inonotsuoxide B。我们在实验中补充测定了其DEPT和HSQC 谱,通过DEPT和HSQC的结合,更准确地归属每一个碳;此外,HSQC 协助解决了一些难以辨认的峰的归属。
5.1 化合物4的峰
化合物4中24-C(δ77.04)峰大部分隐藏于CDCl3溶剂峰中,很难被发现。在HSQC 谱中可以看到77.04碳峰与3.58(m 峰)氢峰的相关峰,结合HMBC,并与已知化合物对照,最后确定δ77.04为24-C。12-C(δ30.44)与15-C(δ30.45)极其接近,难以分辨,在HSQC谱中观察到其对应于3个相关峰,结合HMBC,将其区分为2个非常相近的峰。21-CH3的双峰中有一个峰完全隐藏于一个甲基尖峰中,不能发现,影响对化合物的结构判断。在HSQC谱中观察到21-C(δ11.56)的相关峰与0.61和0.62氢峰对应,而此2个氢峰为6个H,后又观察到27-C(δ20.36)与0.61氢峰相关,再结合HMBC,并与已知化合物对照,最后确定21-CH3的双峰有一个峰完全隐藏于27-CH3的单峰里。
5.2 化合物5的峰
化合物5中17-C(δ47.18)完全隐藏于CD3OD溶剂峰中,不能发现,会让我们少计算一个C。但在HSQC谱中,观察到δ47.18碳峰与δ1.42氢峰的相关峰,且在DEPT中能看到向下的δ47.18 碳峰,故判断CD3OD 溶剂峰中隐藏了一个δ47.18 碳峰。2-C与16-C的信号重叠(δ26.38),也可能在HSQC中发现其对应于不同H 峰而得到辨认。
我们的实验共分离得到了6个四环三萜类化合物,并在实践基础上对其理化性质、色谱行为和光谱性质进行了分析和总结。实验所分离的化合物为具有羊毛甾母核的同系物,为研究其生物活性成分并探讨其构效关系,奠定了坚实的基础。
[1]Kier L B.Triterpenes of Poria oblique[J].J Pharm Sci,1960,50(6):471-476.
[2]Xu H Y,Sun J E,Lu Z M,et al.Beneficial effects of the ethanol extract from the dry matter of a culture broth of Inonotus obliquus in submerged cultureon the antioxidant defence system and regeneration of pancreaticβ-cells in experimental diabetes in mice[J].Nat Prod Res,2010,24(6):542-553.
[3]Sun J E,Ao Z H,Lu Z M,et al.Antihyperglycemic and antilipidperoxidative effects of dry matter of culture broth of Inonotus obliquus in submerged culture on normal and alloxan-diabetes mice[J].J Ethnopharmacol,2008,118(1):7-13.
[4]Cha J Y,Jun B S,Yoo K S,et al.Fermented chaga mushroom (Inonotus obliquus)effects on hypolipidemia and hepatoprotection in Otsuka Long-Evans Tokushima fatty(OLETF)rats[J].Food Sci Biotechnol,2006,15(1):122-127.
[5]Nomura M,Takahashi T,Uesugi A,et al.Inotodiol,a lanostane triterpenoid,from Inonotus obliquus inhibits cell proliferation through caspase-3-dependent apoptosis[J].Anticancer Res,2008,28(5A):2691-2696.
[6]赵芬琴,陈寅生,许彩红,等.4种三萜类化合物的微生物转化探讨[J].河南大学学报:医学版,2011,30(3):177-181.
[7]孔令义,闵知大.大戟根化学成分的研究[J].药学学报,1996,31(7):524-529.
[8]Shin Y,Tamai Y,Terazawa M.Chemical constitents of Inonotus obliquus(Pers.:Fr.)Pil.(Aphyllophoromycetideae)III:a new triterpene,3β,22,25-trihydroxy-lanosta-8-ene from sclerotia[J].Int J Med Mushrooms,2000,2(3):322-329.
[9]Kahlos K,Hiltunen R,V Schantz M.3β-Hydroxy-lanosta-8,24-dien-21-al,a New Triterpene from Inonotus obliquus[J].Planta Med,1984,50(2):197-198.
[10]Nakata T,Yamada T,Taji S,et al.Structure determination of Inonotsuoxides A and B and in vivo anti-tumor promoting activity of inotodiol from the Sclerotia of Inonotus obliquus[J].Bioorg Med Chem,2007,15(1):257-264.
[11]赵芬琴,朴惠善.桦褐孔菌的化学成分研究[J].时珍国医国药,2006,17(7):1178-1181.

