普通菜豆抗白粉病基因SCAR标记鉴定
吴星波, 郝俊杰, 张晓艳, 万述伟, 李红卫, 邵 阳, 孙吉禄
1.青岛市农业科学研究院,山东青岛266100;
2.西南大学园艺园林学院,重庆400715
普通菜豆抗白粉病基因SCAR标记鉴定
吴星波1,2, 郝俊杰1∗, 张晓艳1, 万述伟1, 李红卫1, 邵 阳1, 孙吉禄1
1.青岛市农业科学研究院,山东青岛266100;
2.西南大学园艺园林学院,重庆400715
利用8个来自于普通菜豆抗白粉病基因SCAR标记(SAU5、SS18、SF6Em3、SF12R9、SF13R10、SF18R7、SF18R15和SMe1Em5)引物组,对78份普通菜豆资源进行抗白粉病分子标记的鉴定。结果表明:在这78份资源中,SF12R9、SF13R10、SF18R7、SF18R15和SMe1Em5均无扩增带。有52份资源含有SAU5标记,66份资源含有SF6Em3标记,76份资源含有SS18标记。76份资源含有2~3个标记。该研究明确了78份参试菜豆资源所含的抗白粉病基因类型,并筛选出抗白粉病基因聚合体的参试菜豆资源。
普通菜豆;SCAR;菜豆白粉病;抗病基因;分子标记
菜豆(Phaseolus vulgaris L.)白粉病(powdery mildew,PM)是由真菌病原体核盘菌(Sclerotinia sclerotiorum Lib.de Bary)侵染引起的,该致病菌多以菌丝体在多年生植株体内、花卉上或以闭囊壳在病株残体上越冬,在适宜条件下以子囊孢子对寄主进行初侵染,进而产生分生孢子进行再浸染[1]。菜豆发生白粉病会影响菜豆的产量,危害其种子和荚的质量,大大降低菜豆的经济效益[2]。随着生活水平的提高,药物防治菜豆白粉病因存在农药残留隐患已渐渐不为大众接受,培育抗病新品种成为菜豆防治白粉病主要的农业措施。
目前,分子标记已成为作物遗传育种的重要辅助手段,利用分子标记不仅能极大地缩短培育新品种的时间,实现多基因的聚合[3,4],还可用于品种的抗病基因鉴定[5]。国内关于普通菜豆抗炭疽病的SCAR标记研究较多,但对菜豆抗白粉病的SCAR标记较少。本研究利用与普通菜豆抗白粉病基因AU05、S18、F13R10、Me1Em5、F12R9、SF6Em3、SF13R15和SF18R7相关的SCAR标记,对来自国内普遍种植的78份普通菜豆种质进行检测,明确了其所含抗白粉病基因类型,以便在抗病育种中有效合理地利用。
1 材料与方法
1.1 材料
普通菜豆资源78份,由12份国外资源、56份国内资源及10份未知资源构成(表1)。
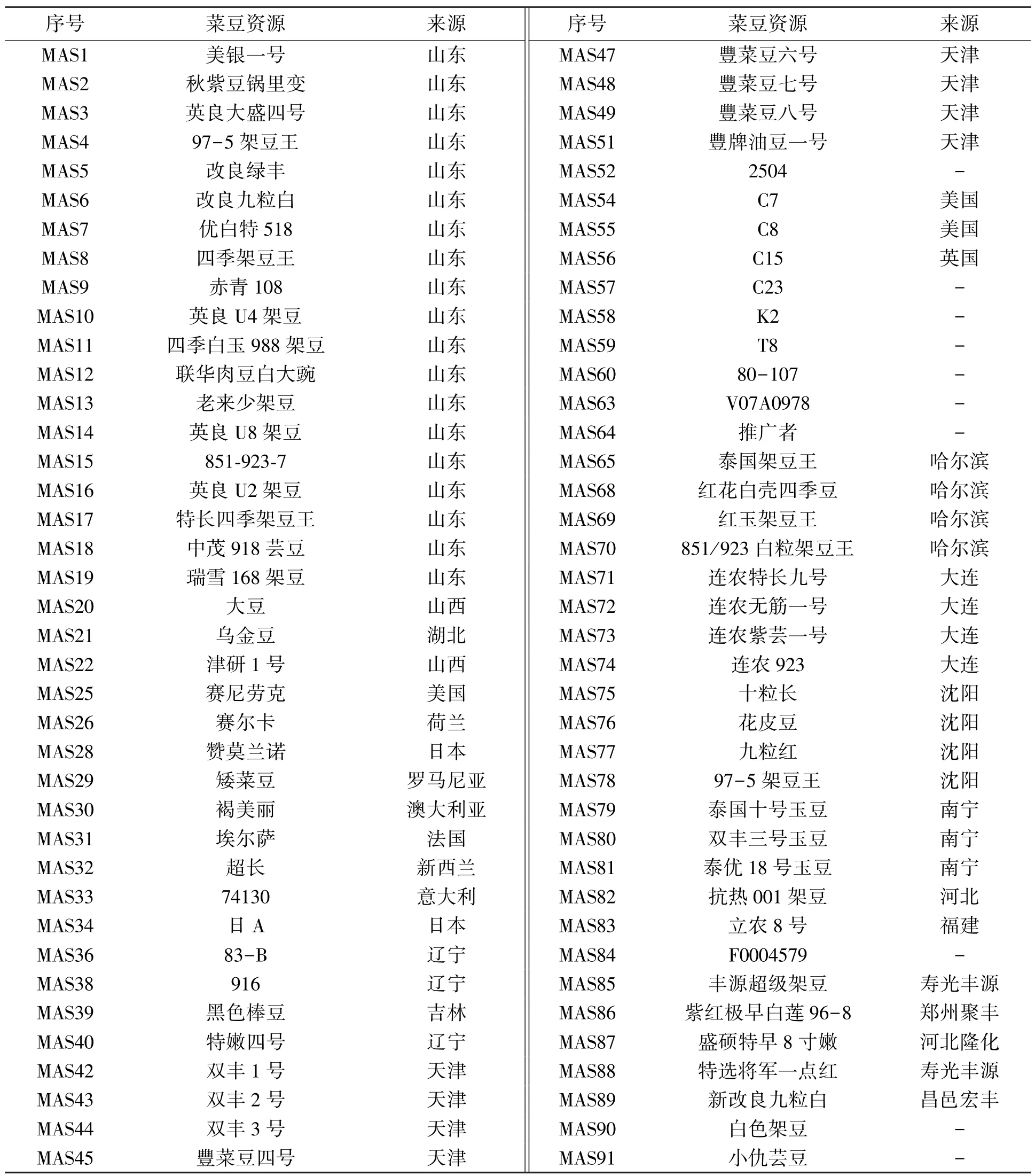
表1 供试普通菜豆资源Table 1 Common bean accessions used in the experiment.
1.2 SCAR标记引物序列
SCAR标记引物组共 8个:SAU5、SS18、SF6Em3、SF12R9、SF13R10、SF18R7、SF18R15和 SMe1Em5,分别是普通菜豆中8个抗白粉病基因AU05、S18、F13R10、Me1Em5、F12R9、SF6Em3、SF13R15和SF18R7的标记(表2)。

表2 来自普通菜豆抗白粉病基因的SCAR引物序列Table 2 SCAR primer sequences of powderymildew resistant genes derive from common beans.
1.3 方法
1.3.1 DNA的提取及浓度的测定 采用改良CTAB法[7]提取全基因组DNA,1%琼脂糖凝胶和ND⁃1000核酸测定仪(Nano Drop)测定其纯度和浓度,稀释到25 ng/μL用于PCR扩增。提取的基因组总DNA置于-20℃冰箱备用。
1.3.2 PCR扩增及产物检测 PCR反应体系(15μL):PCR MIX(Thermo Fisher)7.5μL,100 mmol/μL引物(上海生工)各0.06μL,25 ng/μL DNA模板1.2μL。采用ABIVeriti梯度PCR仪进行扩增,扩增程序视各引物而不同,扩增产物放置4℃冰箱备用。
PCR产物经1.5%琼脂糖凝胶电泳,在凝胶成像仪(Bio⁃Rad Gel DocTMXR)下观察照相,统计有扩增条带的材料序号。
2 结果与分析
2.1 群体抗性鉴定结果
8个抗白粉病基因引物组在78份菜豆资源中的扩增结果表明,3个引物组(SAU5、SS18及SF6Em3)能够在参试资源中得到差异性扩增片段(表3);其余5组引物在所有参试菜豆材料中均无扩增带,这5个引物不能有效用于参试菜豆抗白粉病基因的标记,未列入统计。
3对有效抗白粉病病基因引物组对参试资源的抗性基因鉴定结果显示,52份资源含有SAU5标记,66份资源含有SF6Em3标记,76份资源含有SS18标记。
2.2 抗白粉病基因聚合体的筛选
参试资源中普遍存在白粉病抗病基因,主要为单基因或多基因聚合的形式。78份参试资源仅有2份参试资源(MAS68、MAS77)含单个白粉病抗病基因(SF6Em3),其余76份资源均含2~3个抗白粉病基因,结果见表3。图1、图2为引物SAU5和SS18在24份参试资源中的扩增结果。
利用菜豆抗白粉病基因AU05、S18、F13R10的 SCAR标记,在 78份参试资源中,选择到AU05+S18基因聚合的资源6个;选择到 S18+F13R10基因聚合的资源18个;选择到AU 05+S18+F13R10基因聚合的资源46个。78份参试菜豆资源中,仅有2份资源未检测到抗白粉病基因,而筛选出3对有效的抗白粉病引物SAU5、SS18和SF6Em3,在参试菜豆资源中检测出含有其对应抗性基因的概率分别为67%、87%和97%,说明大部分参试菜豆资源均含有抗白粉病基因。引物SS18扩增的目的片段应为1 350 bp,但在参试资源中发现有900 bp单带和900/1 350 bp双带出现(图2),表明引物SS18在部分资源特异性扩增中出现假阴性,这与Mikleas等[1]的研究结果相同。
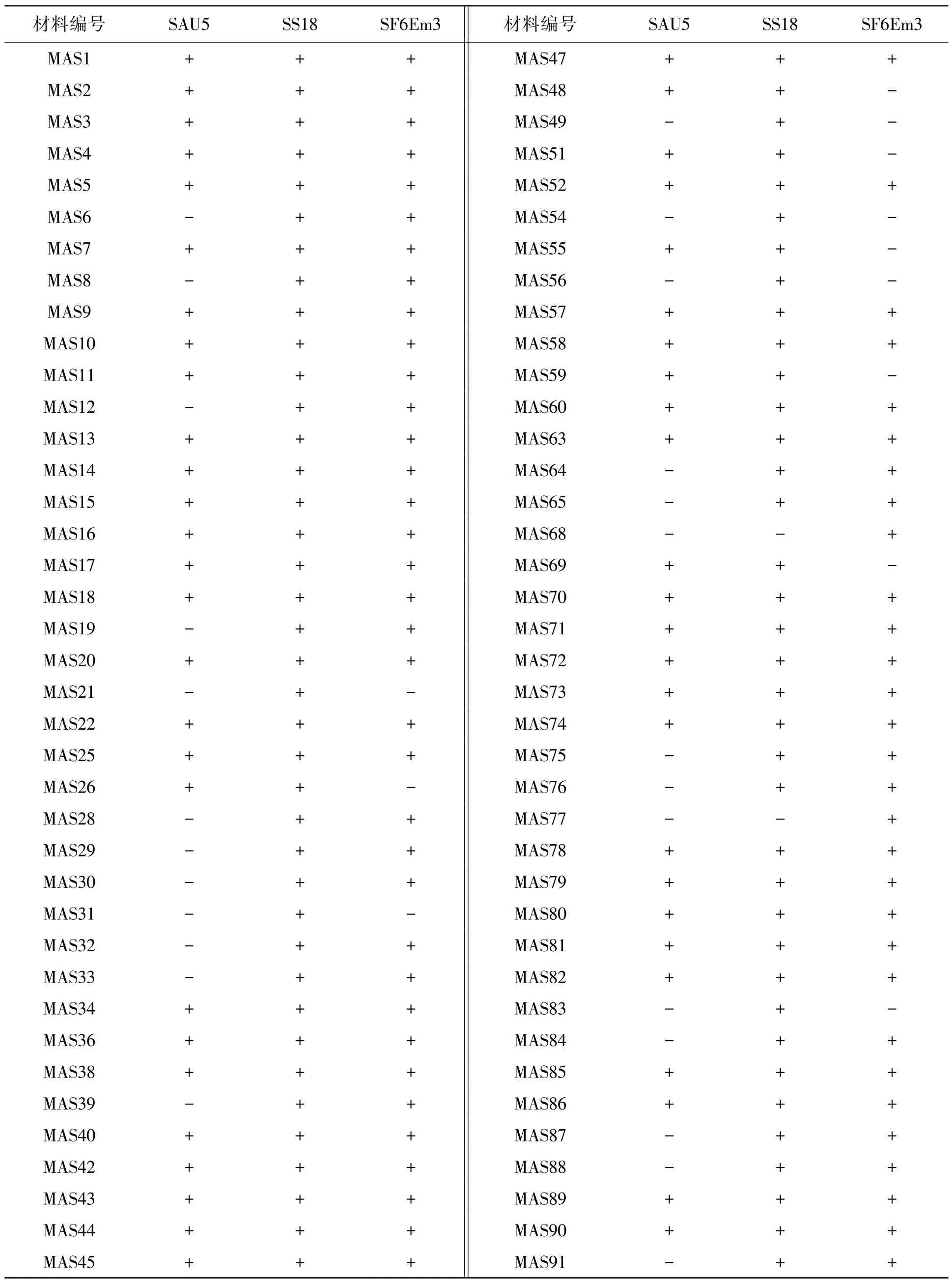
表3 78份材料SCAR标记鉴定结果Table 3 The identification results of SCAR markers in 78 common bean accessions.
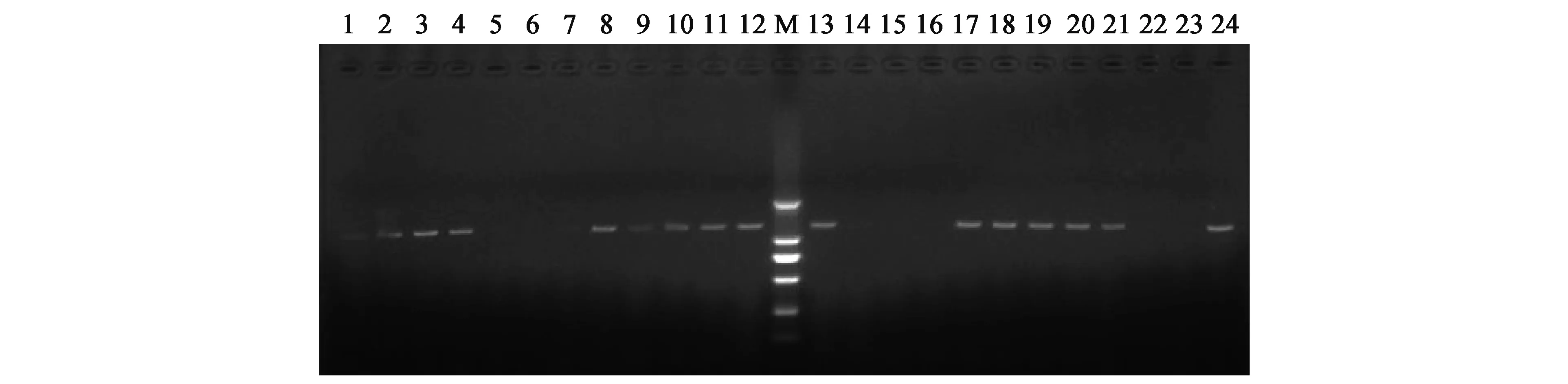
图1 引物对SAU5在24个样品中的扩增结果Fig.1 The amplification result of SS18 primer combination in 24 common bean samples.
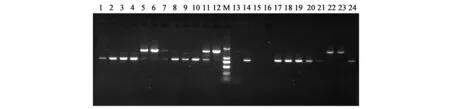
图2 引物对SS18在24个样品中的扩增结果Fig.2 The amplification result of SS18 primer combination in 24 common bean samples.
3 讨论
利用抗病品种防治菜豆白粉病已成为世界上一些主要菜豆生产国如美国、加拿大、澳大利亚、印度、英国、西班牙等普遍应用的方法。国外对菜豆白粉病的早期研究表明,普通菜豆对白粉病菌的侵染表现受单基因或两个协同基因控制[8,9]。Freyre等[10]利用QTL定位,先后在B7及B1连锁群上定位了菜豆抗白粉病基因;Park等[11]利用QTL定位在B7及B8连锁群上定位了菜豆抗白粉病基因,并发现这两个基因对植株的高度也有影响;Kolkman等[12]在B2和B7连续群上定位了两个菜豆抗白粉病基因。迄今为止,通过QTL方法在各连锁群上已定位了27个菜豆抗白粉病基因[13],这些抗病基因的发掘,促进了分子标记辅助育种(MAS)在育种中的应用,缩短了高抗白粉病菜豆品种的选育时间。
普通菜豆于15世纪从美洲直接引入中国,作为重要的食用豆类作物之一,在我国的许多地区广泛种植[14]。我国是世界上菜豆第二大生产国,菜豆的主要病害有菜豆炭疽病(anthracnose)、菜豆锈病(rust)、菜豆白粉病(powdery mildew)、菜豆角斑病(angular leaf spot)、菜豆黄花叶病毒病(bean golden mosaic)、菜豆花叶病毒病(bean common mosaic)和菜豆细菌疫病(bacterial blight)等,这些病害的抗病基因都已经有分子标记报道。国内对菜豆炭疽病的研究较为深入,如赵晓彦等[15]利用12个菜豆品种(鉴别寄主)评价了7个抗炭疽病基因SCAR标记的可靠性和实用性,并用5个可靠的菜豆炭疽病基因SCAR标记鉴定了127份普通菜豆抗炭疽病品种中抗炭疽病基因的类型;陈明丽等[16]利用SSR分子标记,定位了中国普通菜豆抗炭疽病基因等。
国内对菜豆抗白粉病基因研究比较落后,目前研究发现的8个菜豆抗白粉病基因全是来自国外的研究,因此,明确我国现有菜豆资源抗白粉病基因类型,并从国内抗白粉病资源中发掘新的抗病基因,对我国抗白粉病菜豆的选育具有深远意义。本研究明确了78份参试菜豆资源所含的抗白粉病基因类型,筛选出3个能够有效用于鉴定菜豆抗白粉病基因的标记,选择到含2个抗白粉病基因的菜豆资源24份,含3个抗白粉病基因的菜豆资源46份。上述结果说明,国内抗白粉病菜豆资源较多,含有多个抗白粉病基因的菜豆资源较为常见。
[1] Miklas P N,Delorme R,Riley R H.Identification of QTL con⁃ditioning resistance to white mold in a snap bean population[J].J.Am.Soc.Hort.Sci.,2003,128:564-570.
[2] Singh SP,Schwartz H F.Breeding common bean for resistance to diseases:a review[J].Crop Sci.,2010,50:2199-2223.
[3] Gupta P K,Varshney R K,Shama P C,et al..Molecular markers and their applications in wheat breeding[J].Plant Breed.,1999,118:369-390.
[4] Young N D.A cautiously optimistic vision for marker⁃assisted breeding[J].Mol.Breed.,1999,5:505-510.
[5] 刘金元,陶文静,段霞瑜,等.分子标记辅助鉴定小麦抗白粉病品种(系)所含Pm基因[J].植物病理学报,2000,30(2):133-139.
[6] Soule M,Porter J,Medina J,et al..Comparative QTLmap for whitemold resistance in common bean,and characterization of partial resistance in dry bean lines VA19 and I9365⁃31[J].Crop Sci.,2011,51:123-139.
[7] Afanador L,Hadley S,Kelly J D.Adoption of a mini⁃prep DNA extraction method for RAPD marker analysis in common bean(Phaseolus vulgaris L.)[J].Annu.Rep.Bean Improv.Coop.,1993,36:10-11.
[8] Dundas B.Inheritance of resistance to powderymildew in beans[J].Hilgardia,1936,10:243-253.
[9] Ferreira R V,Ramalho M A P,Corte H R.Genetic control of common bean(Phaseolus vulgaris L.)resistance to powdery mildew(Erysiphe polygoni)[J].Genet.Mol.Biol.,1999,22:233-236.
[10] Freyre R,Skroch P W,Geffroy V,et al.Towards an integrated linkage map of common bean 4.Development of a core linkage map and alignment of RFLP maps[J].Theor.Appl.Genet.,1998,97:847-856.
[11] Park SO,Coyne D P,Steadman JR,et al.Mapping of QTL for resistance to whitemold disease in common bean[J].Crop Sci.,2001,41:1253-1262.
[12] Kolkman JM,JD Kelly.QTL conferring resistance and avoid⁃ance to whitemold in common bean[J].Crop Sci.,2003,43:539-548.
[13] Miklas P N,Porter L D,Kelly JD,et al..Characterization of white mold disease avoidance in common bean[J].Eur.J.Plant Pathol.,2013,135:525-543.
[14] 张晓艳,王坤,王述民.普通菜豆种质资源遗传多样性研究进展[J].植物遗传资源学报,2007,8(3):359-365.
[15] 赵晓彦,王晓鸣,王述民.普通菜豆抗炭疽病基因SCAR标记鉴定[J].作物学报,2007,33(11):1815-1821.
[16] 陈明丽,王兰芬,王晓鸣,等.利用分子标记定位普通菜豆抗炭疽病基因[J].作物学报,2011,37(12):2130-2135.
Identification of Powdery M ildew Resistant Genes based on SCAR M arkers in Common Bean(Phaseolus vulgaris L.)
WU Xing⁃bo1,2,HAO Jun⁃jie1∗,ZHANG Xiao⁃yan1,WAN Shu⁃wei1,LIHong⁃wei1,SHAO Yang1,SUN Ji⁃lu1
1.Qingdao Academy ofAgricultural Sciences,Shandong Qingdao 266100,China;
2.College ofHorticulture and Landscape Architecture,Southwest University,Chongqing 400715,China
Eight SCAR primer combinations(SAU5,SS18,SF6Em3,SF12R9,SF13R10,SF18R7,SF18R15 and SMe1Em5)of common bean powderymildew resistant genes were used to check the genome DNA of 78 common bean accessions.The SCAR primer pairs of SF12R9,SF13R10,SF18R7,SF18R15 and SMe1Em5 did not amplified target bands at all;SAU5 marker appeared in 52 accessions,SF6Em3 marker in 66 accessions,and SS18 marker in 76 accessions.2~3 SCAR markers appeared in 76 accessions respectively.The types of powderymildew resistantgenes in each of the 78 accessions have been identified,and the accessions with pyramiding powderymildew resistance genes were selected.
common bean;SCAR;powderymildew;resistance gene;molecularmarker
10.3969/j.issn.2095⁃2341.2013.05.09
2013⁃07⁃29;接受日期:2013⁃09⁃06
现代农业产业技术体系专项资金资助(CARS⁃09);农业部“引进国际先进农业科学技术”项目(2012Z⁃52;2011⁃G1(3)⁃08);青岛市农科院博士基金项目资助。
吴星波,硕士,研究方向为蔬菜分子生物学与基因工程。E⁃mail:wuxingbo@126.com。∗通信作者:郝俊杰,助理研究员,博士,研究方向为蔬菜抗病育种。E⁃mail:haojunj@126.com

