白花丹醌对人肝癌SK-hep-1细胞增殖及侵袭的影响
华中科技大学同济医学院附属武汉市中心医院检验科,湖北 武汉430014
白花丹醌对人肝癌SK-hep-1细胞增殖及侵袭的影响
曹晓淬 王卉 张红梅 刘怡雯 卢忠心
华中科技大学同济医学院附属武汉市中心医院检验科,湖北 武汉430014
背景与目的:白花丹醌是中药白花丹的主要活性成分,对多种肿瘤细胞具有杀伤作用。本研究旨在观察白花丹醌对人肝癌SK-hep-1细胞增殖及侵袭的影响,并初步探讨其作用机制。方法:在体外应用MTS法、软琼脂克隆形成实验、流式细胞术及Transwell小室观察白花丹醌对细胞增殖及侵袭的影响;并通过RTPCR检测白花丹醌对p21、MMP-2及MMP-9的mRNA表达影响。结果:白花丹醌能够明显抑制肝癌SK-hep-1细胞的增殖和克隆形成,且具有剂量依赖性,其半数抑制率为22.04 μ mol/L。细胞周期分析显示,白花丹醌处理后S期细胞数减少,G0/G1期细胞增多;并且白花丹醌能够抑制SK-hep-1细胞的黏附和侵袭转移。RT-PCR结果显示白花丹醌能够促进p21表达,而抑制MMP-2及MMP-9的表达。结论:白花丹醌可能是通过上调p21及下调MMP-2/ MMP-9的表达水平,抑制人肝癌SK-Hep-1细胞增殖和侵袭。
增殖;肿瘤转移;白花丹醌;肝癌;SK-hep-1
肝细胞癌是最常见的恶性肿瘤之一,全球发病率居第5位,死亡率居第3位,而我国肝癌发病人数约占全球的55%,发病率居我国恶性肿瘤第2位[1],病死率在消化系统恶性肿瘤中居第3位,仅次于胃癌和食道癌[2]。目前肝癌的治疗主要采用外科手术切除,而切除后使用化疗对肝癌的作用非常有限,因此新药的研究十分必要。白花丹醌是中药白花丹的主要活性成分,具有抗菌消炎、抗生殖、抗凝等作用。目前有报道表明,白花丹醌对多种肿瘤具有杀伤作用,如Raja、Calu-1、HeLa及Wish等细胞[3]。本研究旨在探讨白花丹醌对人肝癌SK-hep-1细胞增殖及侵袭的影响,为治疗肝癌寻找新的治疗药物。
1 材料和方法
1.1 细胞株
人肝细胞癌细胞SK-Hep-1购自美国标准生物品收藏中心(American Type Culture Collection,ATCC)。
1.2 主要试剂
白花丹醌购自Sigma公司,Transwell小室购自Corning公司, CellTiter 96®AQueous MTS Reagent Powder、低熔点琼脂糖购自Promega公司(USA,批号:56966),吩嗪硫酸甲酯(Phenazine methosulfate,PMS) 购自Sigma-Aldrich公司,MTT、碘化丙啶(Propidium Iodide,PI) 购自Sigma公司,FACS Optimized sheath fluid、Matrigel基质胶购自BD Biosciences Pharmingen公司,SYBR Green Realtime PCR Master Mix购自Toyobo公司。
1.3 细胞培养及药物处理
人肝细胞癌细胞SK-Hep-1以含有10%胎牛血清,100 IU/mL青、链霉素,1×丙酮酸钠及1×非必需氨基酸的MEM完全培养液,在37 ℃、CO2体积分数为5%的培养箱内培养。白花丹醌溶解于二甲亚砜配成0.1 mol/L储备液,并用无血清的MEM完全培养液配成1 mmol/L的工作液。
1.4 MTS法检测白花丹醌对人肝癌SK-Hep-1细胞的抑制率
处于对数期的SK-Hep-1细胞经胰酶消化、计数,并用MEM培养液调整细胞浓度为5×105个/mL,接种于96孔细胞培养板中,每孔100 μL。CO2体积分数为5%、37 ℃的条件下温育24 h后,往每孔中分别加入不同浓度的含白花丹醌培养液,每孔100 μL,使白花丹醌的终浓度为2.5、5、10、20和40 μmol/L。每种药物浓度设5个复孔,另设5个阴性对照孔。培养48 h后,每孔中加入40 μL MTS工作液。37 ℃温育2 h后用酶标仪于490 nm处检测A值。计算抑制率(%):抑制率(%)=1- A实验组均值/ A对照组均值×100%。
1.5 流式细胞术检测
人肝癌SK-Hep-1细胞经5、10 μmol/L的白花丹醌处理12 h后,用胰酶进行消化,1 000 r/min离心5 min后收集细胞,再用PBS洗涤2次。将收集的细胞用70%的冰乙醇重悬细胞于-20 ℃固定过夜。1 000 r/min离心10 min去除乙醇,PBS液洗涤离心2次,调整细胞浓度为1×106/mL。在细胞沉淀中加入终浓度为10 μg/mL的RNase A,37 ℃水浴30 min,冰浴终止RNase A作用,加入终浓度为0.1%的Triton X-100和50 μg/mL的PI染液,混匀,4 ℃避光温育40 min。将细胞用400目筛网过滤,上流式细胞仪检测,每次检测2×104个细胞,FACScalibur流式细胞仪测定荧光强度,激发波长488 nm,使用CELLQUEST软件采集数据Modfit LT分析软件进行DNA含量分析,确定细胞周期分布。
1.6 软琼脂克隆形成实验
将配制好的1.5%琼脂糖放置于水浴锅中融化。待其降温至37 ℃时,用MEM培养基将1.5%的琼脂糖稀释为0.5%琼脂糖,加入12孔板中,每孔1 mL,凝固后备用。将预先用5 μmol/L、10 μmol/L的白花丹醌处理6 h的人肝癌SK-Hep-1细胞消化计数,并用含0.3%琼脂糖MEM培养基将细胞浓度调整为200个/mL,分别加入到预先铺好的半固体培养基的12孔细胞培养板中,每孔1 mL,使其形成双琼脂层。待上层琼脂凝固后,置37 ℃、CO2体积分数为5%的温箱内培养。培养过程中每孔加入0.5 mL的MEM培养基,使琼脂保持适当的湿度。2周后在12孔板中每孔内加入0.5 mL MTT (0.5 mg/mL)。37 ℃避光温育30 min后,显微镜下计数所形成细胞数大于50个的克隆数,计算克隆形成率。克隆形成率(%)=形成克隆数/接种细胞数×100%。
1.7 细胞黏附率实验
将4 ℃预冷后的96孔板每孔加入25 μL Matrigel胶(0.2 mg/mL),37 ℃温育12 h后,每孔加入含2%BSA的PBS 20 μL,封闭非特异性位点。将处于对数生长期的SK-Hep-1细胞,经胰酶消化计数,用含0.1% BSA的MEM调整浓度至5×105/mL,100 μL/孔加入到已包被Matrigel胶的96孔板中,每组设5个复孔,实验组96孔板中每孔加入白花丹醌工作液,使终浓度为1 μmol/L及2.5 μmol/L (经试验证明2.5 μmol/L的白花丹醌对细胞的增殖无影响,故本研究中对侵袭和黏附能力的测定采用1 μmol/L及2.5 μmol/L两个浓度组),对照组96孔板中加入无血清MEM培基,37 ℃、CO2体积分数为5%的条件下温育1 h。
PBS冲洗弃去未黏附的细胞,每个细胞培养孔中加入20 μL的MTS工作液。CO2体积分数为5%、37 ℃下温育2 h,490 nm处检吸光度(A)值。计算细胞黏附率,细胞黏附率(%)=A实验组均值/A对照组均值×100%。
1.8 Transwell小室检测
Transwell小室4 ℃预冷,将25 μL的趋化因子FN(0.2 mg/mL)涂在小室底部,超净台内风干。再将25 μL的Matrigel胶(0.2 mg/mL)包被于小室上层,37 ℃、CO2体积分数为5%的环境中温育1 h后备用。取SK-Hep-1细胞,用PBS溶液冲洗3遍,计数,用含0.1%BSA的MEM培养基调整浓度至1×106/mL,用量100 μL,加入到已包被Matrigel胶且底部涂有趋化因子FN的Transwell小室上层,在24孔板中加入含血清的MEM培养基,600 μL/孔,将小室浸入24孔板的条件培养基中。将小室分为3组,每组设3个平行小室,实验组在小室上层加入白花丹醌工作液,使终浓度为1 μmol/L及2.5 μmol/L,对照组小室中加入无血清MEM培基,37 ℃、CO2体积分数为5%的环境中温育24 h。用棉棒擦去微孔滤膜上未侵袭的细胞,HE染色,中性树胶封片。200倍光学显微镜下计数膜上、下、左、右、中5个视野穿过滤膜的细胞数,计算平均值。
1.9 RT-PCR检测
5 μmol/L及10 μmol/L的白花丹醌处理人肝癌SK-Hep-1细胞12 h后,用TRIzol提取细胞总RNA,逆转录成 cDNA,然后进行RT-PCR试验。反应体系为每管反应体系如下:SYBR Green Real-Time PCR Master Mix 12.5 μL,上游引物(2.5 µmol/L)2 μL,下游引物(2.5 µmol/L) 2 μL,cDNA工作液5 μL,ddH2O 3.5 μL。PCR扩增条件为:95 ℃预变性60 s;然后95 ℃变性15 s,退火15 s 60 ℃),72 ℃延伸45 s,扩增40个循环。每次延伸步骤结束,掺入到DNA双链中SYBR Green的荧光强度,反映当时的PCR产物形成量,所以在每个循环延伸阶段采集数据。用β-actin基因的表达量作为内参,校正目的基因的表达量,计算公式为:相对表达量= 2-ΔCT,ΔCT=CT(目的基因)-CT(β-actin)。引物序列检索自在线引物库primer bank,引物由北京奥科生物技术有限责任公司合成并纯化。各检测基因及引物序列见(表1)。
1.10 统计学处理
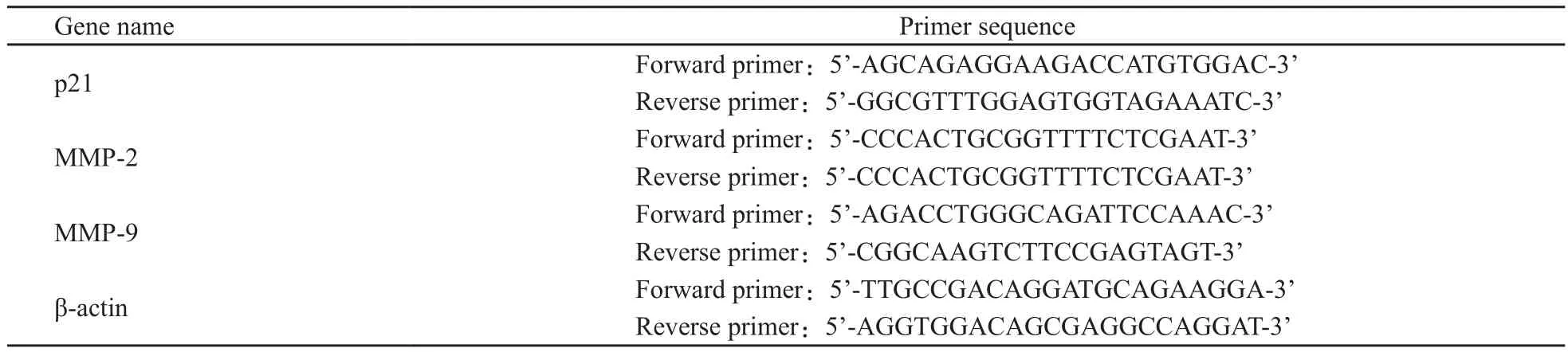
表 1 Real-time PCR 引物基因名称引物序列Tab. 1 Primer sequence for real-time PCR
2 结 果
2.1 白花丹醌抑制人肝癌SK-Hep-1细胞的体外增殖
MTS法检测结果显示,不同浓度的白花丹醌对人肝癌SK-Hep-1细胞增殖均有抑制作用,半数抑制率的浓度为22.04 μmol/L(图1)。
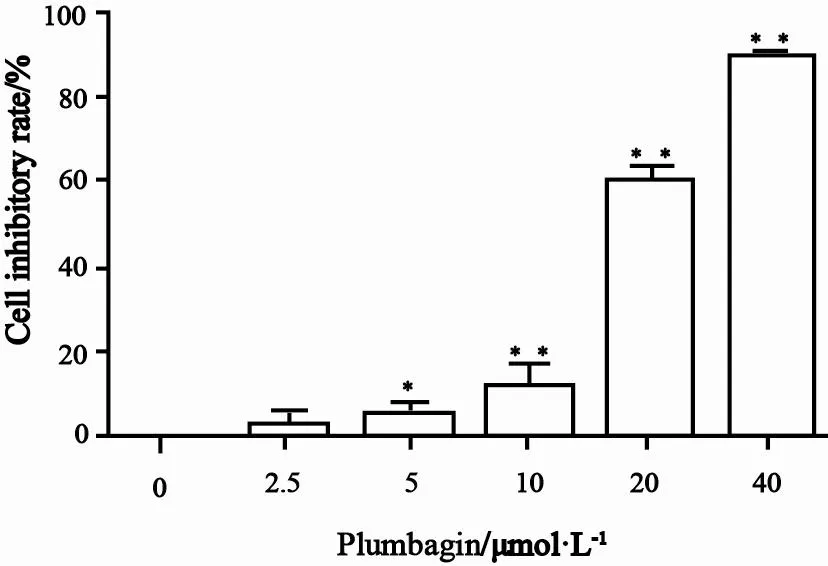
图 1 白花丹醌对人肝癌SK-Hep-1细胞增殖抑制作用Fig. 1 Inhibition effect of plumbagin on SK-Hep-1 cells proliferation.
2.2 白花丹醌影响人肝癌SK-Hep-1细胞的周期分布
流式细胞仪检测结果显示,5 μmol/L及10 μmol/L白花丹醌作用细胞后,处于G0/G1期的细胞增多,而处于S期及G2/M期的细胞数减少,差异有统计学意义(P<0.05,图2,表2)。
2.3 白花丹醌可抑制人肝癌SK-Hep-1细胞的克隆形成
软琼脂克隆形成实验结果显示,人肝癌SKHep-1细胞经5 μmol/L及10 μmol/L的白花丹醌处理后其克隆形成能力明显降低(对照组的克隆形成率为12.67%,5 μmol/L组为4.50%,10 μmol/L组为2.50%,差异有统计学意义(P<0.05,图3)。
2.4 白花丹醌抑制人肝癌SK-Hep-1细胞黏附率
研究结果显示,人肝癌SK-Hep-1细胞经白花丹醌处理后,1 μmol/L组细胞的黏附率为77.80%,而2.5 μmol/L组细胞的黏附率为60.00%,与对照组比较差异均有统计学意义(P<0.05,图4)。
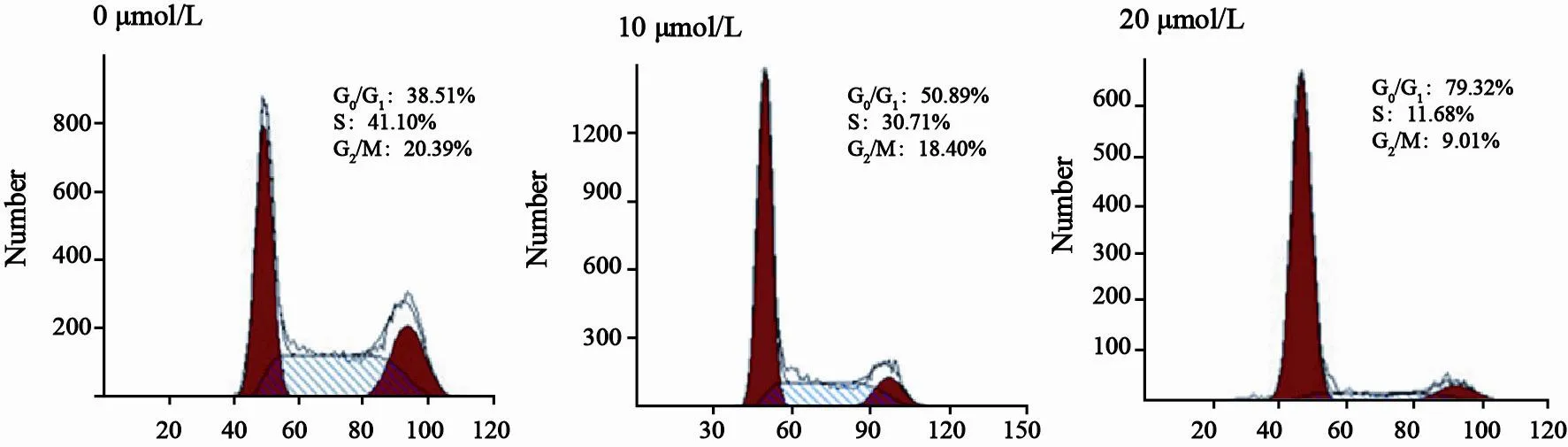
图 2 白花丹醌对人肝癌SK-Hep-1细胞周期分布的影响Fig . 2 Inhibition effect of plumbagin on SK-Hep-1 cells cell cycle distribution

表 2 白花丹醌对人肝癌SK-Hep-1细胞周期分布的影响Tab. 2 Inhibition effect of plumbagin on SK-Hep-1 cells cell cycle distribution
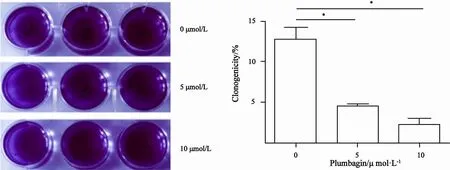
图 3 白花丹醌对人肝癌SK-Hep-1细胞克隆形成率的影响Fig. 3 Effect of plumbagin on SK-Hep-1 cells clonogenicity potential
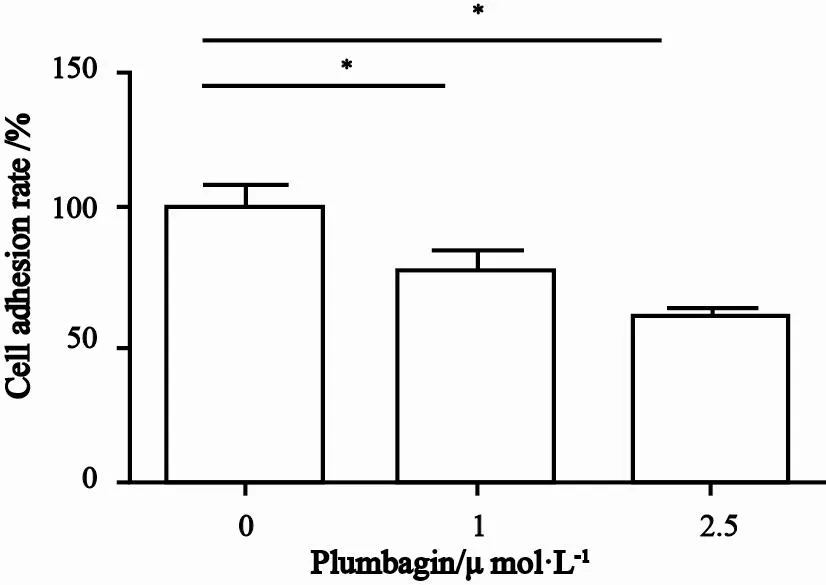
图 4 白花丹醌对人肝癌SK-Hep-1细胞黏附能力的影响Fig. 4 Inhibition effect of plumbagin on SK-Hep-1 cells adhesion potential
2.5 白花丹醌可抑制人肝癌SK-Hep-1细胞的体外侵袭
1 μmol/L及2.5 μmol/L白花丹醌均能够抑制人肝癌SK-Hep-1细胞的体外侵袭,其穿膜细胞数与对照组相比明显降低,平均穿膜细胞数对照组为216,1 μmol/L组为97,2.5 μmol/L组为35,差异均有统计学意义(P<0.05,图5)。
2.6 白花丹醌可抑制人肝癌SK-Hep-1细胞的p21、MMP-2及MMP-9 mRNA表达
本研究选择与细胞周期相关的基因p21以及与侵袭相关的基因MMP-2及MMP-9进行了检测,结果显示,5 μmol/L和10 μmol/L白花丹醌处理组细胞p21 mRNA表达是对照组的172.67%和293.7%(P<0.05),MMP-2 mRNA表达是对照组的61.00%和25.33%(P<0.05),MMP-9 mRNA表达是对照组的51.33%和33.00%(P<0.05),表明白花丹醌可调节肿瘤增殖及转移相关基因的转录(图6)。
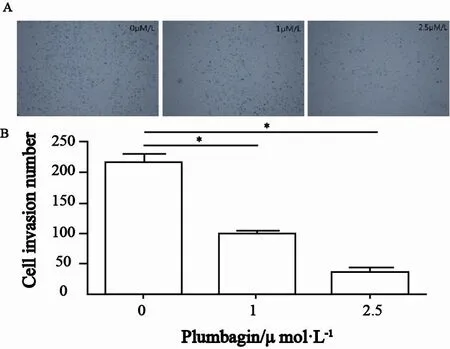
图 5 白花丹醌对人肝癌SK-Hep-1细胞侵袭能力的影响Fig. 5 Effect of plumbagin on SK-Hep-1 cells invasion potential.
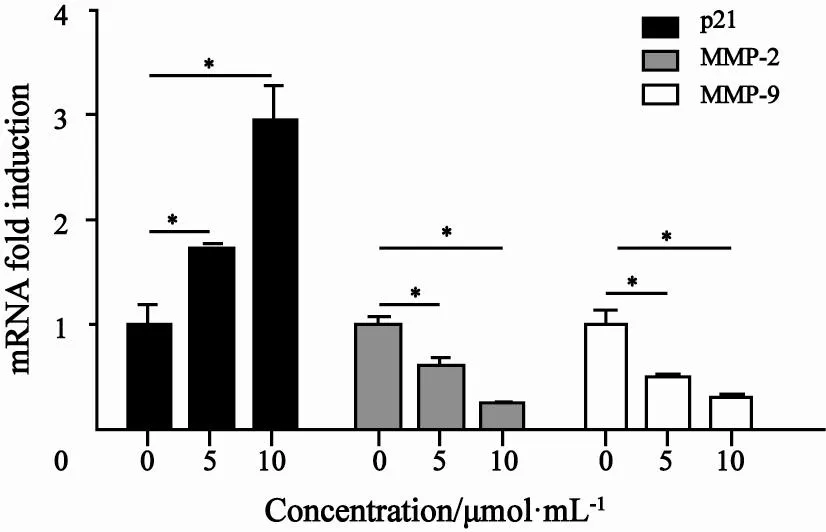
图 6 白花丹醌对人肝癌SK-Hep-1细胞p21、MMP-2及MMP-9 mRNA表达的影响Fig. 6 Effect of plumbagin on SK-Hep-1 cells p21, MMP-2 and MMP-9 mRNA expression
3 讨 论
白花丹醌是从传统药物白花丹中提取出来的一种类似于维生素K3的药物成分[4],具有抗炎、抗菌、抗凝[5]、降低血脂[6]等作用。有研究表明白花丹醌对多发性骨髓瘤、肺癌、宫颈癌、卵巢癌、胰腺癌等多种肿瘤细胞有明显的抑制作用[7-11]。但鲜见白花丹醌抑制人肝癌SK-Hep-1细胞系增殖及侵袭能力的报道。
本研究首先通过MTS法观察了人肝癌SKHep-1对白花丹醌的敏感性,本研究发现,5~40 μmol/L的白花丹醌对人肝癌SK-Hep-1细胞均有抑制作用,随着浓度的增高,细胞的增殖能力逐渐下降,其半数抑制率为22.04 μmol/L;并能够明显抑制人肝癌SK-Hep-1细胞的自我更新及无限增殖能力。Kuo等[12]发现白花丹醌能使乳腺癌细胞G2/M期阻滞,本研究发现,白花丹醌能使人肝癌SK-Hep-1细胞处于G0/G1期的细胞数增多,而处于S期及G2/M期的细胞数减少,与上述文献报道一致。本研究还应用Matrigel胶Transwell小室重建BM(基底膜)的侵袭模型观察了白花丹醌对人肝癌SKHep-1细胞体外侵袭能力的影响,结果发现白花丹醌能够显著降低人肝癌SK-Hep-1细胞的体外侵袭能力。本研究对白花丹醌抑制人肝癌SKHep-1的增殖和体外侵袭能力的机制进行了初步探讨。p21作为细胞周期抑制蛋白,可以通过抑制细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)的活性来控制细胞由G期进入S期抑制增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的活性,从而抑制DNA 的合成,使细胞停止分化,出现凋亡[13]。MMPs能够降解细胞外基质和基底膜,参与许多生理和病理过程,是肿瘤浸润转移过程中最重要的调控分子之一,涉及肿瘤浸润和转移、血管的生成,在肿瘤的发展中起关键作用。MMP-2是一种锌依赖性蛋白酶,其作用底物为Ⅳ型胶原、Ⅶ型胶原、Ⅹ型胶原和明胶,而它们是ECM和血管基底膜的主要成分,MMP-2的表达增高与结直肠癌转移密切相关,可作为临床判断结直肠癌转移及预后等生物学行为的重要参考指标[14]。MMP-9是MMPs中降解基底膜最重要的蛋白酶之一,在组织中MMP-9以酶原的形式由细胞分泌产生,被各种活化因子激活,进而发挥酶解效应。近年来,国内外学者在许多肿瘤组织中都发现有较高的MMPs的表达,并且其表达程度与肿瘤的侵袭性有关[15-16]。本研究结果还表明,白花丹醌促进p21mRNA的表达,抑制MMP-2及MMP-9 mRNA的表达。
综上所述,白花丹醌能有效抑制人肝癌SKHep-1细胞的增殖及体外侵袭能力,而这种作用可能是与上调p21的表达以及抑制MMP-2及MMP-9的表达有关,表明白花丹醌具有抗肝癌作用。
[1] 樊嘉, 王征. 肝移植治疗原发性肝癌的现状[J]. 肝胆外科杂志, 2011, 19(5): 321-323.
[2] 林惠珍. 原发性肝癌中晚期中医证候类型的临床流行病学研究[J]. 南京: 南京中医药大学, 2011: 28-42.
[3] LIN L C, YANG L L, CHOU C J. Cytotoxic naphthoquinones and plumbagic acid glucosides from Plumbago zeylanica[J]. Phytochemistry, 2003, 62(4): 619-622.
[4] SANDUR S K, PANDEY M K, SUNG B, et al. Plumbagin, Vitamin K3 analogue, suppresses STAT3 activation pathway through induction of protein tyrosine phosphatase, SHP-1: potential role in chemosensitization [J]. Mol Cancer Res, 2010, 8: 107-118.
[5] SHEN Z, DONG Z, CHENG P, et al. Effects of plumbaginon platelet aggregation and platelet-neutrophil interactions[J]. Planta Med, 2003, 69; 605-609.
[6] SHARMA I, GUSAIN D, DIXIT V P. Hypolipidaemic and antiatheroselerotic effects of plumbagin in rabbits [J]. Indian J Physiol Pharmacol, 1991, 35: 10-14.
[7] SANDUR S K, ICHIKAWA H, SETHI G, et al. Plumbagin(5-hydroxy-2-methyl-1,4-naphthoquinone) suppresses NF-kappaB activation and NF-kappa B-regulated gene products through modulation of p65 and IkappaBalpha kinase activation, leading to potentiation of apoptosis induced by cytokine and chemotherapeutic agents [J]. J Biol Chem, 2006, 281: 17023-17033.
[8] HSU Y L, CHO C Y, KUO P L, et al. Plumbagin (5-Hydroxy-2-methyl-l,4-naphthoquinone) induce apoptosis and cell cycle arrest in A549 cells through p53 accumulation via c-Jun NH2-Terminal kinase-mediated phosphorylation at serine 15 in vitro and in vivo [J]. J Pharmacol Exp Ther, 2006, 318: 484-494.
[9] SRIMVAS P, GOPINATH G, BANERJI A, et al. Plumbagin induces reactive oxygen species,which mediate apoptosis in human cervical cancer cells[J]. Mol Carcinog, 2004, 40: 201-211.
[10] THASNI K A, RAKESH S, ROJINI G, et al. Estrogendependent cell signaling and apoptosis in BRCAl-blocked BGl ovarian cancer cells in response to plumbagin and other chemotherapeutic agents [J]. Ann Oncol, 2008, 19: 696-705.
[11] CHEN C A, CHANG H H, KAO C Y, et al. Plumbagin, isolated from plumbago zeylanica, induces cell death through apoptosis in human pancreatic cancer cells [J]. Panereatology, 2009, 9: 797-809.
[12] KUO P L, HSU Y L, CHO C Y. Plumbagin induces G2-M arrest and autophagy by inhibiting the AKT/mammalian target of rapamycin pathway in breast cancer cells [J]. Mol Cancer Ther, 2006, 5: 3209-2021.
[13] 李作生, 李保庆. P21 和P27 基因多态性与肿瘤的相关性[J]. 国际遗传学杂志, 2006, 29(04): 317-320.
[14] 肖秀英, 周晓燕, 孙孟红, 等. MMP-2和C-erbB-2在散发性结直肠癌原发及转移灶中表达及意义[J]. 中国癌症杂志, 2006, (1): 1-4.
[15] BABYKUTTY S, SUBOJ P, SRINIVAS P, et al. Insidious role of nitric oxide in migration/invasion of colon cancer cells by upregulating MMP-2/9 via activation of cGMP-PKG-ERK signaling pathways [J]. Clin Exp Metastasis, 2012, 29(5): 471-492.
[16] SUBOJ P, BABYKUTTY S, VALIYAPARAMBIL GOPI D R, et al. Aloe emodin inhibits colon cancer cell migration/ angiogenesis by downregulating MMP-2/9, RhoB and VEGF via reduced DNA binding activity of NF-κB [J]. Eur J Pharm Sci, 2012, 45(5): 581-591.
复旦大学继续医学教育项目办班课程表
办班单位: 复旦大学附属肿瘤医院《中国癌症杂志》编辑部
约稿内容请侧重于知识的传播:包括最新的研究进展、诊断标准、治疗规范等。
The effects of plumbagin on proliferation and metastasis in human liver cancer SK-hep-1 cells
CAO Xiao-cui, WANG Hui, ZHANG Hong-mei, LIU Yi-wen, LU Zhong-xin (Department of Clinical Laboratory, Wuhan Central Hospital Affiliated to Tongji Medical College, Huazhong University of Science and Technology, Wuhan Hubei 430014, China)
LU Zhong-xin E-mail: lzx71@yahoo.com
Background and purpose: Plumbagin is the main active components of traditional Chinese medicine of plumbago zeylanica. The present studies show that plumbagin has a killing effect on tumor cells. This study aimed to investigate the function and primary mechanism of plumbagin on invasion and metastasis of human liver cancer SK-hep-1 cells. Methods: With the treatment of plumbagin in vitro, cell proliferation and adhesion of SK-hep-1 cells were detected by MTS staining, cell cycle of SK-hep-1 cells were detected by flow cytometry, the selfrenewal and propagation abilities of SK-Hep-1 cells were conducted by colony formation assay , invasion in cells were performed using transwell invasion assay, and the p21 and MMP-2/9 mRNA levels were detected by real-time RT-PCR. Results: With the treatment of plumbagin, SK-Hep-1 cells proliferation was decreased with plumbagin concentrationdependency and the IC50value of plumbagin in SK-Hep-1 cells was 22.04 mmol/L. The colony formation ability of SKHep-1 cells was decreased and the percentage of cells in G0/G1phase was increased in a dose-dependent manner, as compared to control. The cell adhesion and invasion abilities were decreased. The real-time RT-PCR showed that p21 mRNA expression was increased and the MMP-2/9 mRNA was decreased. Conclusion: Plumbagin could suppress the proliferation and invasiveness of human liver cancer SK-hep-1 cells in vitro, and these effects may be by up-regulation of p21 and down-regulation of MMP-2 and MMP-9.
Proliferation; Tumor metastasis; Plumbagin; Hepatocarcinoma; SK-hep-1
10.3969/j.issn.1007-3969.2013.09.05
R735.7
:A
:1007-3639(2013)09-0721-07
2013-06-06
2013-08-29)
卢忠心 E-mail:lzx71@yahoo.com

