RNA干扰Apollon基因逆转白血病K562细胞多药耐药
滨州医学院附属医院儿科,山东 滨州 256603
RNA干扰Apollon基因逆转白血病K562细胞多药耐药
贾秀红 孝飞飞 李建厂
滨州医学院附属医院儿科,山东 滨州 256603
背景与目的:Apollon基因在白血病等多种肿瘤内高表达。本试验通过构建高效干扰Apollon基因的短发夹RNA(short hairpin RNA,shRNA)真核表达载体,探讨RNA干扰技术能否逆转人髓系白血病K562细胞多药耐药。方法:构建靶向Apollon基因真核表达载体pGPHI-GFP-Neo-Apollon,应用LipofectamineTM2000转染K562细胞,G418稳定筛选。采用反转录-聚合酶链反应(RT-PCR)法、细胞免疫荧光法分别检测重组载体稳定转染K562细胞后Apollon mRNA及蛋白的表达情况;四甲基偶氮唑盐(MTT)、流式细胞术检测细胞转染前后对长春新碱(leurocristine,VCR)、足叶乙苷(etoposide,VP16)的敏感性及凋亡率的变化。结果:成功构建了pGPHI-GFP-Neo-Apollon载体并在K562细胞内稳定表达的细胞克隆,经G418筛选后,重组载体能有效沉默Apollon的表达,Apollon mRNA及蛋白表达水平明显下降。MTT结果显示,基因干扰组细胞对VCR、VP16的敏感性明显增强,其半数抑制浓度(half-inhibitory,IC50)值分别为(0.144±0.018)mg/L、(17.336±3.571) mg/L,明显低于细胞对照组(P<0.05)。流式细胞术检测结果表明,基因干扰组细胞联合化疗药物后细胞凋亡率显著升高(P<0.05),而转染阴性对照组细胞凋亡率与正常对照组比较差异无统计学意义(P>0.05)。结论:pGPHI-GFP-Neo-Apollon载体能显著增强VCR和VP16对白血病K562细胞的诱导凋亡作用,提高K562细胞对化疗药物的敏感性,提示RNA干扰Apollon基因表达能一定程度逆转白血病细胞的多药耐药。
白血病;RNA干扰;Apollon基因;多药耐药性;细胞凋亡;K562细胞
白血病是最常见的血液系统恶性肿瘤之一,以联合化疗为主的综合治疗方法仍然是目前最有效的治疗方法,但多药耐药(multidrug resistance,MDR)的产生是导致化疗失败的主要原因之一[1]。化疗药物杀伤肿瘤细胞的基本方式是诱导其凋亡[2]。细胞凋亡又称为程序性细胞死亡,在机体发育、分化和维持体内平衡中起着十分重要的作用,凋亡受抑制将导致细胞生存期延长,利于转化突变的细胞无限增殖,最终导致肿瘤的发生。凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)家族是近年来发现最强的内源性凋亡抑制因子,目前共发现8个成员:XIAP、c-IAP1、c-IAP2、NAIP、Apollon、Livin、Survivin、ILP-2,Apollon(BRUCE/ BIRC6,BIR-containing protein 6)是IAPs家族中分子量最大的成员,其转录的Apollon蛋白相对分子质量为530×103,含有一个BIR结构域(杆状病毒凋亡抑制蛋白重复序列)和一个泛素结合结构域(UBC)。Apollon是内源性IAPs家族成员之一,在白血病细胞中高表达,尤其在白血病诱导无缓解、WBC>10×109/L、复发、死亡患者中高表达,Apollon高表达的患者骨髓及外周血白血病细胞清除率及3年无复发生存率较低,预后差。目前研究表明,Apollon抑制凋亡主要通过结合Smac、HtrA2以及caspase等机制发挥作用[3]。白血病细胞抗凋亡能力增强是其产生耐药的机制之一。本实验通过构建shRNA真核表达载体下调人髓系白血病细胞株K562中Apollon基因的表达,检测K562细胞对化疗药物敏感性及凋亡率的变化,探讨白血病细胞MDR产生的机制及Apollon作为基因联合药物为治疗靶点的可能性。
1 材料和方法
1.1 材料与试剂
人慢性粒细胞白血病细胞株K562(滨州医学院医学分子遗传研究所保存);RPMI-1640、胎牛血清购自美国Hyclone公司;脂质体LipofectamineTM2000购自美国Invitrogen公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司;Annexin Ⅴ-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展公司;RNA提取试剂、RT-PCR试剂盒购自日本TaKaRa公司(RNAiso plus);Apollon及β-actin引物由北京赛百盛基因技术有限公司合成;靶向Apollon的siRNA序列、阴性对照siRNA序列由上海吉玛制药技术有限公司合成;一抗兔抗人Apollon多克隆抗体购自美国Santa Cruz公司;二抗TRITC带有红色荧光标记购自上海江莱生物科技有限公司;其余试剂均为国产分析纯。
1.2 pGPHI-GFP-Neo-Apollon载体构建及鉴定
前期试验从3条化学合成的小干扰RNA(siRNA)序列中筛选出针对GenBank数据库人Apollon(ID:57448)的特异性有效siRNA序列(顺义链:5’-CUGCCUCUUUCAGGCAAUATT-3’,反义链:5’-UAUUGCCUGAAAGAGGCAGTT-3’)。根据其合成一段互补且能编码相应shRNA的双链寡核苷酸。阴性对照siRNA序列的顺义链为:5’-GTTCTCCGAACGTGTC ACGTCAAG-3’,反义链:5’-GATTACGTGAC ACGTTCGGAGAATT-3’,与人类所有基因无同源性。按上述序列由上海吉玛制药技术有限公司合成。质粒pGPHI-GFP-Neo-Apollon中还带有绿色荧光蛋白GFP基因作转染标记及卡那霉素抗性基因,HI为RNA聚合酶Ⅲ启动子。shRNA模板的退火:选取浓度为100 μmol/L的2条寡核苷酸链各5 μL与退火缓冲液5 μL混匀,加双蒸水补足体积50 μL,退火程序:95 ℃ 5 min,85 ℃5 min,75 ℃ 5 min,70 ℃ 5 min,4 ℃保存。重组载体的线性化:BbsⅠ+BamHⅠ 37 ℃酶切1 h,胶回收线性化空载体。T4DNA连接酶连接目的片段与线性化空载体。将连接产物转化感受态细胞DH50α,使用含卡那霉素的平皿筛选,挑取阳性菌落提取质粒,用BamHⅠ、PstⅠ限制酶分别做酶切鉴定,由上海英骏生物技术有限公司进行测序,测序结果显示插入片段正确。用质粒中量提取试剂盒提取高纯度质粒备用。
1.3 细胞培养、转染及稳定细胞株筛选
用含10%胎牛血清、青霉素及链霉素终浓度均为100 U/mL的RPMI-1640培养液于37 ℃、CO2体积分数为5%、饱和湿度细胞培养箱中培养K562细胞。细胞呈悬浮状态生长,于对数生长期进行转染。实验分3组:实验组(用脂质体转染pGPHI-GFP-Neo-Apollon)、阴性对照组(用脂质体转染阴性对照质粒)、细胞对照组(只加等量无抗生素、无血清培养基)。取对数生长期的K562细胞,以1×106个/mL的密度接种于6孔板,按LipofectamineTM2000说明书将脂质体分别与质粒在无血清、无抗生素培养液中混合配成转染液转染细胞。转染12 h后加入G418(400 μg/mL)筛选,每2 d半量换液1次并重新加入G418,维持此浓度筛选4周,挑取单克隆细胞,用G418(200 μg/mL)培养液扩大培养。稳定转染后的阴性对照组和实验组细胞株分别命名为K562/ahNC和K562/shApollon。
1.4 RT-PCR法检测Apollon mRNA的表达水平
取对数生长期的K562细胞以3 ×105/孔接种于6孔培养板进行转染,作为细胞对照组。实验组、阴性对照组采用前期稳定转染的细胞接种于6孔板,每组2孔,于24 h后提取总RNA,经1%琼脂糖凝胶电泳鉴定,紫外分光光度计测定样品吸光度(A)比值(A260/A280),介于1.8~2.2。两步法行RT-PCR。由Primer Premier软件设计并化学合成Apollon引物序列顺义链:5’-TGGCTCAAGCTGGATTTTAT-3’,反义链:5’-TTCAGACCAAGGTTCATCAG-3’,扩增长度116 bp。内参照β-actin序列顺义链:5’-TCATGTTTGAGACCTTCAA-3’,反义链5’-GTCTTTGCGGATGTCCACG-3’,扩增片段513 bp。反应条件:95 ℃预变性2 min;95 ℃模板变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共进行35个循环;最后72 ℃延伸10 min。PCR产物经含EB的10 g/L琼脂糖凝胶上电泳,采集图像,经Bandleader软件分析图像,计算出目的基因mRNA的相对表达水平:以Apollon/β-actin灰度比值(ODR)表示。
1.5 细胞免疫荧光检测pGPHI-GFP-Neo-Apollon载体对K562 Apollon蛋白表达的影响
将稳定转染pGPHI-GFP-Neo-Apollon载体、阴性载体、未转染的K562细胞制成单细胞悬液滴在经多聚赖氨酸处理的载玻片上,把载玻片放入24孔板,置于37 ℃、CO2体积分数为5%的的培养箱中培养,24 h后取出细胞爬片,经4%多聚甲醛固定,1%的Triton穿孔,2%的BSA封闭30 min,加入一抗4 ℃过夜(1∶100),加入荧光二抗TRITC(1∶120),避光、室温反应1 h,PBS漂洗,50%缓冲甘油封片,激光共聚焦拍照,实验重复3次。参照Image ProPlus 6.0专业图像分析软件测定细胞荧光强度,将荧光图片转成灰度图片,测量其光密度(IOD)和总面积数值,利用IOD与总面积的比值计算灰度图片红色荧光区域的平均灰度(荧光强度)数值,所得荧光强度数值用“”表示。
1.6 流式细胞术检测稳定转染后细胞凋亡率变化
取对数生长期的各组细胞接种于24孔培养板,每孔1×105个细胞。实验分3组:实验组(K562/shApollon)、阴性对照组(K562/shNC)和细胞对照组(K562);每组均设未加药组、长春新碱(lenrocristins,VCR)组和足叶乙苷(etoposide,VP16)组,VCR和VP16质量浓度分别为0.01 μg/mL和5 μg/mL。加药48 h后,收集上述各组细胞,用冷PBS洗涤2次后将细胞重悬于100 μL的Binding Buffer,分别加入5 μL AnnexinⅤ-FITC、5 μL PI,室温避光染色10 min,1 h内用流式细胞仪检测细胞凋亡率。实验重复3次。
1.7 MTT法检测稳定转染细胞对化疗药物敏感性的变化
取对数生长期的各组细胞,接种于96孔培养板,每孔100 μL细胞悬液中含1×104个细胞。3组细胞加入不同浓度的VCR及VP16,VCR终质量浓度为0、0.01、0.1、1.0、10、100 μg/mL,VP16终质量浓度为0、0.05、0.5、5.0、50和500 μg/mL,每种细胞每个浓度设3个复孔,于加药48 h后加入5 g/L的MTT 20 μL,温育4 h后离心弃上清液,每孔加入150 μL DMSO,避光振荡15 min,待紫色结晶充分溶解后,用酶标仪检测各孔490 nm波长处A值。各平行孔取平均值,计算各组细胞对VCR、VP16的细胞增殖抑制率(IR),IR=(1-A实验组/A对照组)×100%。根据各药物不同浓度的IR,通过计算软件获得半数抑制浓度(half-inhibitory,IC50)。
1.8 统计学处理
2 结 果
2.1 重组载体pGPHI-GFP-Neo-Apollon的酶切鉴定及测序
原始载体多克隆位点处有PstⅠ,插入目的序列后PstⅠ被替换,插入的目的序列中带有BamHⅠ,所以阳性重组载体应该可以被BamHⅠ切开,而不能被PstⅠ切开。shRNA序列:5’-CACCGCTGCCTCTTTCAGGCAATAT TCAAGAGATATTGCCTGAAAGAGGCAGTTT TTTG-3’,测序结果显示重组载体的插入顺序正确。
2.2 重组载体稳定转染K562细胞对Apollon mRNA表达水平的影响
筛选4周后收集各组细胞,提取各组细胞RNA经RT-PCR扩增,结果显示各组均可检测到β-actin及Apollon mRNA的表达,实验组Apollon mRNA的表达水平明显降低,其相对表达量为(27.622±0.057)%,与细胞对照组[(89.770±0.028)%]和阴性对照组[(84.868±0.057)%]比较差异有统计学意义(t=21.936,t=13.771,P<0.05),而细胞对照但和阴性对照组间差异无统计学意义(P>0.05)。结果表明,pGPHI-GFP-Neo-Apollon重组载体转入K562细胞后Apollon基因被稳定抑制,成功构建了重组载体稳定表达的K562细胞株(图1)。
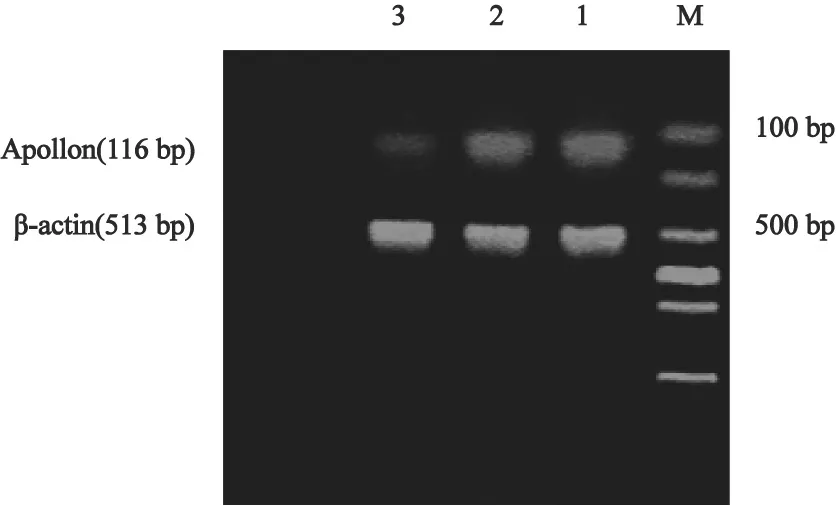
图 1 RT-PCR鉴定pGPHI-GFP-Neo-Apollon稳定转染K562细胞中Apollon mRNA的表达水平Fig. 1 Apollon gene expression in K562 cells transfected with pGPHI-GFP-Neo-Apollon was detected by RT-PCR
2.3 重组载体稳定转染K562细胞对Apollon 蛋白表达水平的影响
稳定筛选4周后收集各组细胞,细胞免疫荧光检测细胞Apollon蛋白的表达,实验组细胞Apollon蛋白的荧光强度为(15.96±1.71)%,明显低于细胞对照组[(35.36±2.90)%]和阴性对照组[(34.97±2.65)%](t=8.34,t=7.82,P<0.05),而细胞对照组和阴性对照组间差异无统计学意义(P>0.05,图2)。
2.4 流式细胞术检测各组细胞凋亡率的变化
流式细胞术结果显示,未加化疗药物时,实验组细胞凋亡率明显高于细胞对照组及阴性对照组,差异有统计学意义(P<0.05),而K562组和K562/shNC组间差异无统计学意义(P>0.05)。加入化疗药物VCR和VP16作用48 h后,K562/shApollon组细胞凋亡率较未加药物明显升高,并且显著高于相同药物作用的K562组和K562/shNC组(P<0.05),K562组和K562/ shNC组间差异无统计学意义(P>0.05,表1,图3)。
2.5 重组载体稳定转染后K562细胞对VCR和VP16的敏感性变化
MTT检测结果显示,K562/shApollon细胞组VCR和VP16的IC50值明显低于未转染的正常对照组K562细胞组(P<0.05),而正常对照组K562细胞及阴性对照K562/shNC细胞组的IC50值差异无统计学意义(P<0.05,表1)。结果说明,pGPHI-GFP-Neo-Apollon重组载体稳定转染即Apollon基因表达被抑制后,K562细胞对VCR和VP16的敏感性增强。

图 2 细胞免疫荧光检测Apollon 蛋白的表达水平Fig. 2 Apollon protein expression level detected by cell immunofluorescence

表 1 RNA干扰Apollon基因表达后K562细胞对VCR和VP16的敏感性(IC50)及凋亡率变化Tab. 1 Effects of RNA interference targeting Apollon gene on the drug-sensitivity (IC50) and apoptotic rate of K562 cells to VCR or VP16
3 讨 论
MDR是指肿瘤细胞接触一种肿瘤药物并产生耐药性后,对结构和作用机制不同的多种抗肿瘤药物具有交叉耐药性。MDR是肿瘤细胞耐药的常见方式,也是临床肿瘤化疗失败的主要原因之一。目前,以化疗为主的综合治疗仍然是治疗白血病的主要方法,作为临床治疗白血病的一线药物生物碱类抗肿瘤药物(VCR)、鬼臼毒素类(VP16)等能特异性作用于不同的细胞周期,但易发生MDR,本实验以VCR、VP16为研究药物,为逆转白血病细胞MDR寻找新的有效基因靶点。
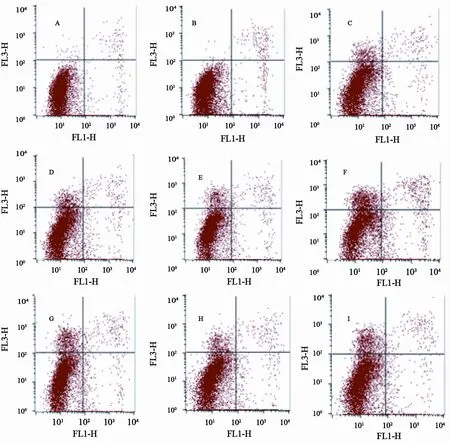
图 3 流式细胞术检测各转染组联合不同化疗药物处理K562细胞的凋亡情况Fig. 3 Apoptosis of K562 cells after different transfections combined with chemotherapeutics was detected by flow cytometry.
Apollon是目前发现的重要凋亡抑制因子之一,其高表达影响细胞凋亡,在肿瘤的发生发展、治疗及预后方面都发挥重要作用,尤其是在血液系统恶性肿瘤中的表达明显增高,如白血病、淋巴瘤等。白血病细胞凋亡受阻会带来严重的临床问题,使其对放化疗等多种治疗方法不敏感。在儿童ALL中,往髓鞘或静脉注射多种化疗药物,于第7天对早期化疗诱导效果进行评估,大部分患者未能达到完全诱导缓解,在未完全诱导缓解患者中都有Apollon基因高表达,能诱导缓解的患者Apollon基因表达较低,推测Apollon可能与肿瘤耐药有关,同时发现在Apollon高表达的细胞中,由于Apollon与caspase-9作用而抑制了依托泊苷对caspase-9的激活,表现出对依托泊苷的耐药性[4]。Apollon高表达与细胞增殖能力增强有关,抑制其表达可增强细胞的凋亡能力,提高对药物的敏感性。Lopergolo等[5]通过RNA干扰技术沉默乳腺癌细胞Apollon基因表达,能减缓乳腺癌的进度,Apollon基因介导的凋亡机制还与P53基因和Caspase-3的激活密切相关,基因联合化学疗法也许能提供治愈肿瘤的方法,为靶向药物的研发提供理论基础。Kelly等[6]研究表明,表达Apollon抑制因子可导致MLN8237剂量依赖性降低,并引起与Aurora A抑制因子一致的形态学表型,敲除Apollon后,使CML细胞对尼罗替尼诱导凋亡的敏感性增强,提示Apollon在MLN8237增强尼罗替尼疗效方面可能是一个潜在的重要因子。Tassi等[7]研究表明,黑素瘤对细胞毒性药物、靶向抑制因子导致细胞凋亡的敏感性与Apollon蛋白的下行性调节有关,应用小干扰RNA (small interference RNA,siRNA)作用于Apollon,明显增强了细胞毒性药物、MEK及BRAF V600E抑制因子导致的Caspase依赖的黑素瘤凋亡及TRAIL的溶解。RNAi技术是一种高效的基因阻断技术,利用RNAi逆转白血病MDR已在体内外实验中得到证实,Yague等[8]应用靶向MDR基因1(multi-drug resistance gene1,MDR1)的RNAi技术降低MDR1 mRNA和膜糖蛋白P-gp的表达,通过逆转K562细胞的MDR表型来逆转白血病细胞耐药,提示RNAi的目的序列整合到基因治疗载体将在临床上具有广泛的应用前景。
最近的研究表明,在儿童初治AML中,Apollon高表达与患儿最初的临床特征有关,如白细胞计数高和有髓外疾病的患儿Apollon表达水平相对较高,并且Apollon高表达诱导化疗疗效差,同时3年无复发生存率低,总生存期短[9-10]。本实验通过构建Apollon基因真核表达载体,经G418筛选重组载体稳定表达的细胞株,实验组Apollon mRNA相对表达量[(27.622±0.057)%]及Apollon蛋白相对表达量[(15.96±1.71)%]明显低于细胞对照组及阴性对照组,表明pGPHI-GFP-Neo-Apollon重组载体能有效沉默Apollon基因表达。MTT检测结果显示,Apollon-shRNA重组载体可显著降低K562细胞对VCR、VP16的IC50值(P<0.05),表明Apollon基因被沉默后,K562细胞对VCR及VP16的敏感性增强。流式细胞术检测结果表明,沉默Apollon基因表达联合化疗药物作用后细胞凋亡率明显提高(P<0.05),提示下调Apollon表达能促进VCR、VP16诱导K562细胞凋亡,这与Pennati等[4]通过siRNA介导的Apollon下调可使肿瘤细胞更易于发生由抗癌药物所诱导的细胞凋亡的研究相一致。
本研究初步证实了靶向Apollon基因真核表达载体可有效抑制K562细胞中Apollon的表达,沉默该基因可显著提高K562细胞对化疗药物的敏感性。因此,Apollon基因高表达增强了白血病细胞抗凋亡能力,应用RNAi技术沉默Apollon基因表达,可逆转白血病MDR,引导研究者可考虑将Apollon基因作为新的治疗靶点。
[1] LONG J, PARKIN B, OUILLETTE P, et al. Multiple distinct molecular mechanisms influence sensitivity and resistance to MDM2 inhibitors in adult acute myelogenous leukemia [J]. Blood, 2010, 116(1): 71-80.
[2] 张福明, 李哲深, 秦素萍, 等. 热疗在阿霉素对KG-la白血病细胞杀伤作用的曾敏作用 [J]. 新乡医学院学报, 2012, 29(3): 169-171.
[3] BARTKE T, POHL C, PVROWOLAKIS G, et al. Dual role of BRUCE as an antiapoptotic IAP and a chemeric E2/E3 ubiquitin Ligase [J]. Mol Cell, 2004, 14(6): 801-811.
[4] PENNATI M, MILLO E, GANDELLINI P, et al. RNA interference-mediated validation of survivin and Apollon/ BRUCE as new therapeutic targets for cancer therapy [J]. Curr Top Med Chem, 2012, 12(2): 69-78.
[5] LOPERGOLO A, PENNATI M, GANDELLINI P, et al. Apollon gene silencing induces apoptosis in breast cancer cells through p53 stabilisation and caspase-3 activation [J]. Br J Cancer, 2009, 100(5): 739-746.
[6] KELLY K R, ECSEDY J, MEDINA E, et al. The novel Aurora A kinase inhibitor MLN8237 is active in resistant chronic myeloid leukaemia and significantly increases the efficacy of nilotinib [J]. J Cell Mol Med, 2011, 15(10): 2057-2070.
[7] TASSI E, ZANON M, VEGETTI C, et al. Role of Apollon in human melanoma resistance to anti-tumor agents that activate the intrinsic or the extrinsic apoptosis pathways [J]. Clin Cancer Res, 2012,18(12): 3316-3327.
[8] YAGUE E, HIGGINS C F, RAGUZ S. Complete reversal of multidrug resistance by stable expression of small interfering RNAs targeting MDR1 [J]. Gene Ther, 2004, 11(14): 1170-1174.
[9] ÁRVAI K, NAGY K, BARTI-JUHÁSZ H, et al. Molecular profiling of parathyroid hyperplasia, adenoma and carcinoma[J]. Pathol Oncol Res, 2012, 18(3): 607-614.
[10] ISMAIL E A, MAHMOUD H M, TAWFIK L M, et al. BIRC6/ Apollon gene expression in childhood acute leukemia: impact on therapeutic response and prognosis[J]. Eur J Haematol, 2012, 88(2): 118-127.
《中国癌症杂志》举办继续教育函授班通知
经本刊编委会讨论决定,本刊从2013年下半年起举办2014年度继续医学教育函授班:
一、2013年第8期起开设2014年度函授继续医学教育专栏,本年度的主要内容包括:胰腺癌、食管癌、胃癌的病理诊断、放射治疗及内外科治疗等。每期刊登1讲,共12讲,2014年第8期刊登考试试题,第9期刊登正确答案,要求学员认真阅读讲座后答题,并将答案寄至编辑部(复印无效),考卷经专人统一审阅,合格者授予Ⅱ类继续教育学分10分,学分证书由复旦大学附属肿瘤医院颁发。
二、参加对象:所有正在从事医学专业技术工作的卫生技术人员。预参加者请写好本人姓名、年龄、性别、职称、职务、学历、选派单位名称(地址及邮政编码)、所在科室、联系电话等寄往本编辑部(E-mail:zgaz@chinajournal.net.cn;zgazzz@163.com),同时通过邮局汇款(单位名称:《中国癌症杂志》编辑部;地址:上海市徐汇区东安路270号)的方式支付函授教育费,并请在汇款备注中注明“2014年度函授继续教育”。编辑部收到学员报名和函授教育费后编号登记注册,随即寄出注册费发票,并按时寄上每期刊物。即日起开始报名。
三、学员每人收费200元,赠送12期杂志。编辑部依据学员报名登记注册编号、交费记录和考试成绩于2014年10月30日以前寄发学分证书。
四、编委会邀请有关专家进行出题、阅卷工作,并设专人负责。电话:021-64188274;传真:021-64043766;邮编:200032;联系人:王露。欢迎广大医务人员踊跃参加。
Reversion of multidrug resistance in leukemia K562 cells by RNA interference targeting Apollon gene
JIA Xiu-hong, XIAO Fei-fei, LI Jian-chang (Department of Pediatrics, Affiliated Hospital of Binzhou Medical University, Binzhou Shandong 256603, China)
JIA Xiu-hong E-mail: jiaxiuhong001@163.com
Background and purpose: Apollon gene is highly expressed in leukemia and other tumors. The study aimed to discuss whether RNAi technology can reverse multidrug resistance of chronic myeloid leukemia cell line K562 through constructing a eukaryotic vector of short hairpin RNA (shRNA) targeting at Apollon gene. Methods: The eukaryotic vector pGPHI-GFP-Neo-Apollon with shRNA targeting at Apollon gene was constructed and then transfected into K562 cells by LipofectamineTM2000, and G418 pressure selection. Reverse transcription-polymerase chain reaction (RT-PCR) and immunofluorescence were used to detect the expression of Apollon mRNA and protein after Apollon was transfected stably in K562 cells. The changes of sensitivity of K562 cells to leurocristine (VCR) and etoposide (VP16) after transfection with shRNA-Apollon were detected by MTT method, and the apoptosis rate was detected by flow cytometry. Results: pGPHI-GFP-Neo-Apollon carrier was constructed successfully and expressed stably in K562 cells, and after G418 screening, it silenced Apollon mRNA and protein expression effectively. According to the result of MTT, the sensitivity of K562 cells to VCR and VP16 increased significantly in the group of gene interference, with half of its inhibition concentration (half-inhibitory, IC50) value significantly lower than the control group (P<0.05); Flow cytometry showed that the cell apoptosis rate was increased significantly (P<0.05), but there was no statistically significant difference in the apoptosis rate between shRNA negative control group and normal control group (P>0.05). Conclusion: pGPHI-GFP-Neo-Apollon carrier can enhance the abilities of VCR and VP16 to inducethe apoptosis of K562 cells, namely an increase of sensitivity to these chemotherapeutics in K562 cells, it is hinted that RNA interference targeting Apollon gene may reverse the multidrug resistance of leukemia cells in some degree.
Leukemia; RNA interference; Apollon genes; Multiple drug resistance; Apoptosis; K562 cells
10.3969/j.issn.1007-3969.2013.09.004
R733.7
:A
:1007-3639(2013)09-0713-08
2013-04-24
2013-08-05 )
山东省科学技术发展计划项目(No:2010GSF10264)。
贾秀红 E-mail:jiaxiuhong001@163.com

