乳腺包被性乳头状癌的临床病理特征及预后分析
丁锦华吴伟主甘咏莉
1.宁波市医疗中心李惠利医院甲乳外科,浙江 宁波 315040;
2.宁波市临床病理诊断中心,浙江 宁波 315031
乳腺包被性乳头状癌的临床病理特征及预后分析
丁锦华1吴伟主1甘咏莉2
1.宁波市医疗中心李惠利医院甲乳外科,浙江 宁波 315040;
2.宁波市临床病理诊断中心,浙江 宁波 315031
背景与目的:乳腺包被性乳头状癌是一种少见的乳腺恶性肿瘤,术前诊断较困难。本研究旨在探讨乳腺包被性乳头状癌患者的资料,探讨临床病理特征、治疗及预后。方法:回顾性分析2005—2010年在宁波市医疗中心李惠利医院甲乳外科就诊的11例乳腺包被性乳头状癌患者的临床资料。结果:11例乳腺包被性乳头状癌患者的中位年龄为64岁;肿块直径1.5~10 cm,多位于乳头乳晕区;B超表现为“囊性肿块伴有囊壁乳头状结节”。11例患者中3例肿瘤周围伴有导管内癌,3例伴有浸润性癌;所有患者ER、PR阳性,HER-2阴性,囊壁的肌上皮细胞标志物Actin、SMA、S-100、p63均为阴性,腋下淋巴结未见转移。在随访时间内,11例患者均存活,未发现肿瘤复发和转移。结论:乳腺包被性乳头状癌是一种好发于老年女性的恶性肿瘤,预后良好,肿瘤周围常伴发导管原位或浸润性癌。单独发生或伴发导管原位癌时,按照导管原位癌的原则治疗;伴发浸润性癌时按照浸润性癌的原则治疗。
包被性乳头状癌;导管原位癌;预后
乳腺包被性乳头状癌(encapsulated papillary carcinoma,EPC)是指局限于囊性导管内,组织学呈乳头状瘤样结构的恶性上皮性肿瘤,发病率仅占乳腺恶性肿瘤的0.5%~1.0%[1]。传统观念认为,EPC是导管内乳头状癌的一个亚型[2]。近年来,有学者研究发现,该类型肿瘤的囊壁周围未见到阳性染色的肌上皮层,认为其具有一定侵袭潜能。国外尚有报道认为,该类型乳腺癌可出现区域淋巴结甚至远处转移[3–4]。本研究结合文献资料,对本院诊治的11例EPC的临床病理特点、诊断及预后等进行初步探讨。
1 资料和方法
1.1 临床资料
收集2005—2010年在宁波市医疗中心李惠利医院甲乳外科诊治的11例EPC患者的临床资料。所有患者均经手术病理确诊为EPC。临床资料包括患者性别、年龄、肿瘤直径及位置;初诊时的B超及钼靶结果;手术方式及系统治疗等。
1.2 免疫组织化学染色
对保存在本院病理科的石蜡标本重新切片,片厚4 μm,常规HE染色,同时行免疫组织化学染色。后者采用SP法,所用抗体CK5/6、HER-2、ER、PR、CEA、EMA、S-100、SMA、p63、Actin等试剂均购自福州迈新生物技术开发有限公司。
1.3 随访
随访1~6年,中位随访3年,无失访患者。
2 结 果
2.1 临床特征
11例EPC患者中,男性1例,女性10例,年龄40~77岁,中位年龄64岁(表1)。11例患者均以乳头、乳晕下肿块为主要症状,肿块直径1.5~10 cm,其中4例伴有浆液性乳头溢液。B超表现为复杂性囊肿伴有囊壁乳头状结节(图1A);6例患者行钼靶检查,表现为边界清楚的软组织肿块(图1B)。
6例患者接受乳腺癌改良根治术,4例接受乳腺切除术,1例接受保乳术。3例患者术后接受内分泌治疗,所有患者均未行化疗及放疗。
2.2 病理特征
11例患者中,3例肿瘤周围伴有导管内癌(图2A),3例伴有浸润性癌(图2B)。所有患者ER、PR阳性,HER-2阴性(表2)。囊壁的肌上皮细胞标志物Actin、SMA、S-100、p6均为阴性,腋下淋巴结未见转移(图3)。
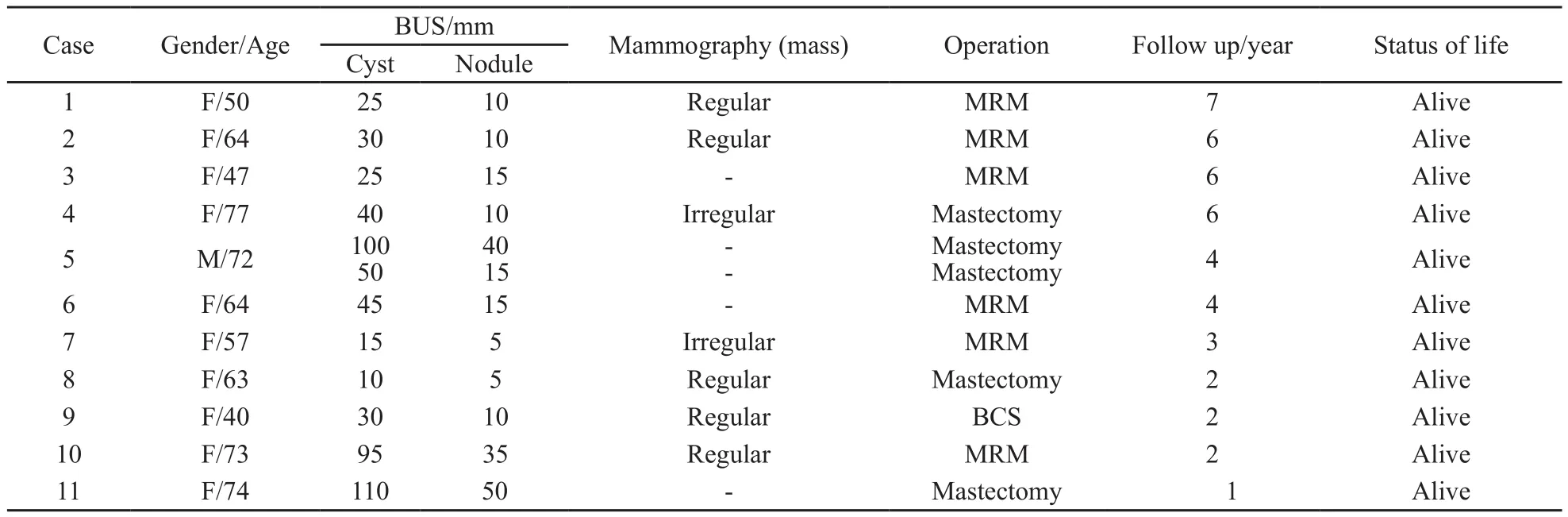
表 1 11例乳腺包被性乳头状癌的临床特征及随访Tab. 1 Clinical features and follow-up of 11 cases of EPC

图 1 乳腺包被性乳头状癌的影像学特征Fig. 1 Imaging feature of encapsulated papillary carcinoma

图 2 乳腺包被性乳头状癌及其伴随癌的表达Fig. 2 The expression of EPC and concurrent carcinoma
2.3 随访结果
在随访时间内,11例患者均存活,未发现肿瘤复发和转移。

表 2 11例乳腺包被性乳头状癌的病理特征Tab. 2 Pathological features of 11 cases of EPC
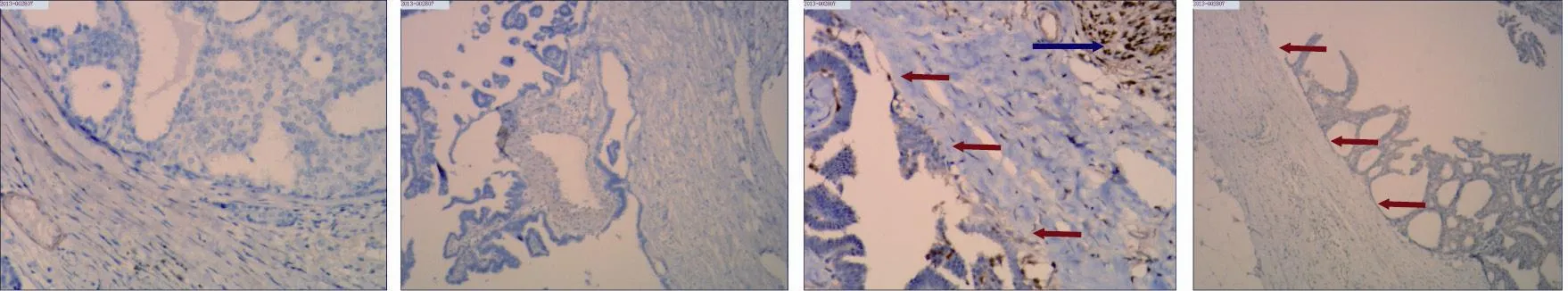
图 3 乳腺包被性乳头状癌囊壁肌上皮细胞标志物的表达Fig. 3 The expression of myoepithelial cell markers surrounding cyst wall
3 讨 论
EPC是一种少见的乳腺恶性肿瘤,2010年,Baykara等[5]学者报告女性患病人数超过1 200例,男性仅59例。2003年,WHO组织学分类就曾提出,EPC的镜下特点为囊性扩张的导管内有较大的乳头状肿瘤,肿瘤细胞具有低级别导管原位癌的特征。由于发病率很低,该疾病的临床病理特征及治疗预后等尚未形成共识。
本组资料中,EPC患者的年龄40~77岁,中位年龄64岁,临床表现为乳头乳晕下肿块或伴有乳头溢液,肿块直径1.5~10 cm。与既往的研究报道基本一致[2,6]。Akagi等[7]报道从发现肿块到明确诊断,一般经历5个月的时间。这提示与普通类型乳腺癌相比,该肿瘤的生长速度更慢,组织学分级较低且不易形成溃疡。
囊内乳头状肿瘤的病灶大小差异很大,仅仅参考肿瘤的大小无法确定病灶的性质。“囊性肿块伴有囊壁乳头状结节”被视为囊内乳头状肿瘤的特征性B超表现,但良恶性病变缺乏差异性的超声特征,因而乳腺B超也无法明确良恶性。囊内乳头状肿瘤在钼靶上显示为边界清楚的肿块,伴或不伴钙化,缺乏特征性的影像征象。研究发现良恶性病变的血管灌注及廓清模式存在差异,MRI检查能动态地显示乳腺病灶的时间-强度曲线,可鉴别乳腺囊内乳头状肿瘤的良、恶性[8]。EPC的细胞核不典型性并不明显,因此无论是细针穿刺还是空芯针穿刺,诊断困难程度大大超过常见的乳腺肿瘤,有时必须依靠切除活检才能明确诊断。
EPC可单独发生,但更常见与导管原位癌或其他类型浸润性癌并存[3,6]。本组11例中,3例伴有导管原位癌,3例伴有浸润性导管癌。术前的细针或空芯针穿刺,常常因取材局限,较难作出全面的诊断。因此,对大体标本应充分取材,仔细辨认有无浸润,慎重诊断,避免将其误诊为浸润性乳头状癌,如同时伴发浸润癌时,应对两种类型癌瘤进行分别测量,并报告标明[9],以便临床医生决定采取适当的治疗方案。本组资料中,所有患者的瘤细胞ER、PR表达阳性,HER-2表达阴性,这与EPC的低组织学分级有关。另外,所有患者未见腋窝淋巴结转移。这与既往的研究结果基本一致[10–11]。
本组资料中,囊壁的肌上皮细胞标志物S-100、SMA、Actin、p63均为阴性,这与以往报道的结果一致[3,6]。Hill等[12]指出在所谓囊性扩张的导管腔周围没有肌上皮包绕,应认为该肿瘤实际上是一种浸润癌,或是一种处于导管原位癌和浸润性癌之间的病变,在无明确浸润性癌证据的包被性乳头状癌中发现腋下淋巴结转移更加支持这一观点[13]。因此使用“包被性乳头状癌”的名称更为合适[3]。
EPC被视为导管内乳头状癌的一种亚型,国外学者建议其治疗参照导管内乳头状癌的治疗。本组资料中,多数患者的肿块位于乳头乳晕区,肿块较大,“广泛的局部切除”不能保证良好的美学效果,乳腺全切除术可能是更为合理的选择。在不能明确是否合并浸润性癌的前提下,前哨淋巴结活检既能明确腋窝淋巴结状态,又能避免不必要的腋窝淋巴结清扫术。放疗及内分泌治疗在EPC治疗中的意义尚不明确。EPC的预后与肿瘤周围是否伴随导管内癌或浸润性癌有关,当周围乳腺组织中不存在导管内癌或浸润性癌时预后非常好[14]。有学者报道其10 年生存率为100%,10年无病生存率为91%。当周围乳腺组织中存在导管内癌或浸润性癌时,前者易导致局部复发率增高(原位或浸润性癌),后者易导致局部复发及转移率增高。本组资料中位随访3年,未见肿瘤复发和转移,分析可能与全乳切除及腋窝淋巴结清扫有关。
EPC是一种具有独特组织学类型的乳腺恶性肿瘤,可能是一种分化较好的浸润癌或是一种原位癌向浸润性癌进展的病变。该类型肿瘤预后良好,单独发生或伴发导管原位癌时,应按原位癌手术治疗,如伴随其他类型浸润性肿瘤时,可按浸润性癌的原则治疗。
[参 考 文 献]
[1] CORKILL M E, SNEIGE N, FANNING T, et al . Fine needle aspiration cytology and flow cytometry of encapsulated papillary carcinoma of breast [J]. Am J Clin Pathol, 1990, 94 (6): 673-680.
[2] TAVASSOLI F A, DEVILEE P. World Health Organization classification of tumors. Pathology and genetics of tumours of the breast and female genital organs [M]. Lyon: LARC Press, 2003.
[3] COLLINS L C, CARLO V P, HWANG H, et al. Encapsulated papillary carcinomas of the breast: a reevaluation using a panel of myoepithelial cell markers [J]. Am J Surg Pathol, 2006, 30(8): 1002-1007.
[4] MULLIGAN A M, O'Malley F P. Metastatic potential of encapsulated (intracystic) papillary carcinoma of the breast: a report of 2 cases with axillary lymph node micrometastases[J]. Int J Surg Pathol, 2007, 15: 143-147.
[5] BAYKARA M, COSKUN U, DEMIRCI U, et al. Encapsulated papillary carcinoma of the breast: one of the youngest patient in the literature [J]. Med Oncol,2010, 27:1427-1428.
[6] 杨文涛, 喻林, 陆洪芬, 等. 乳腺包被性乳头状癌的临床病理学分析 [J]. 中华病理学杂志, 2008, 37(4): 234-237.
[7] AKAGI T, KINOSHITA T, SHIEN T, et al. Clinical and pathological features of encapsulated papillary carcinoma of the breast [J]. Surg Today, 2009, 39: 5-8.
[8] KUSUMA R, TAKAYAMA F, TSUCHIYA S. MRI of the breast: comparison of MRI signals and histological characteristics of the same slices [J]. Med Mol Morphol, 2005, 38: 204-215.
[9] ROSEN P P, HODA S A. Papillary carcinoma. Breast pathology diagnosis by needle core biopsy[M]. Baltimore: Lippincott Williams & Wilkins, 2006: 135-146.
[10] 黄传生, 蔡勇, 高文, 等. 乳腺包被性乳头状癌临床病理学特征的探讨 [J].实用癌症杂志, 2007, 22(6): 571-573.
[11] 卢晓梅, 柳玮华. 乳腺包被性乳头状癌4 例临床病理分析[J]. 临床和实验医学杂志, 2012, 11(1): 36-39.
[12] HILL C B, YEH I T. Myoepithelial cell staining patterns of papillary breast lesions: from intraductal papillomas to invasive papillary carcinoma [J]. Am J Clin Pathol, 2005, 123( 1): 36-44.
[13] MULLIGAN A M, O’MALLEY F P. Papillary lesions of the breast: a review [J]. Adv Anat Pathol, 2007, 14(2): 108-119.
[14] INOUE S, KUNITOMO K, OKAMOTO H, et al. A case of male non-invasive encapsulated papillary carcinoma forming a tumor in the nipple duct [J]. Breast Cancer, 2003, 10(1): 85.
《抗癌》杂志征稿启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会,杂志刊号:CN31-1664/R ISSN 1008-3065。征稿栏目及内容如下。
一、《抗癌博客》栏目
记录癌症患者自强不息、热爱生活、勇敢面对病痛和生活压力的故事,能够启发其他患者自信和勇敢的精神,帮助他们建立积极、知足、感恩和达观的生活态度。可以是你的亲身经历,也可以是医生治疗患者时的所见所闻,或是你身边发生的故事。
二、《正谊明道、大医精诚》栏目
真实记录医生对患者的关怀;或是爱岗敬业、精益求精富有专业精神的事迹,能让更多医道同仁敬重和学习。可以讲述患者眼里的医生,也可以记录你的同事。
以上稿件《抗癌》杂志编辑部在发表时有修改的权力,如果不同意修改请注明,谢谢!欢迎各位作者踊跃投稿。
来稿请寄:上海市东安路270号6号楼3楼《抗癌》杂志社
邮 编:200032 电 话:021-64043766
传 真:021-64043766 E-mail:anti-cancer@163.com
Analysis of clinical-pathological features and prognosis of patients with encapsulated papillary carcinoma of the breast
DING Jin-hua1, WU Wei-zhu1, GAN Yong-li2(1.Department of Breast and Thyroid Surgery, Ningbo Medical and Treatment Center LI Huili Hospital, Ningbo Zhejiang, 315040, China; 2. Ningbo Clinical and Pathological Diagnosis Center, Ningbo Zhejiang 315031, China)
WU Wei-zhu E-mail: lhm6728@nbip.net
Background and purpose: Encapsulated papillary carcinoma (EPC) of the breast is a kind of rare malignant tumor, which is difficult to diagnose before surgery. In this study, we analyzed the clinical-pathological features, treatment and prognosis of 11 EPC cases of breast treated in our hospital. Methods: A total number of 11 cases with EPC treated in our hospital from 2005 to 2010 were retrospectively analyzed. Results: The average age of onset was about 64 years-old, ranging from 40 to77 years-old. The mass was mostly located on “nipple-areola complex”, and “complex cyst with mural nodule” was the ultrasound imaging. In all 11 EPC patients, there were 3 patients coexisting with ductal carcinoma in situ (DCIS) and 3 patients with invasive ductal carcinoma (IDC). ER, PR expression of all patients were positive and HER-2 expression was negative, and all myoepithelial cell markers surrounding cyst wall, including Actin, SMA, S-100, and p63 were negative. There was no axillary lymph node metastasis in all patients and during follow-up time, there was no local recurrence and distant metastasis and all patients were still alive. Conclusion: EPC is a good- prognosis breast tumor in old women, and is commonly coexisting with DCIS or invasive ductal carcinoma. The treatment principle is the same to DCIS when pure EPC or accomplished with DCIS, and the same to IDC when coexisting with IDC.
Encapsulated papillary carcinoma; Ductal carcinoma in situ; Prognosis
10.3969/j.issn.1007-3969.2013.05.007
R737.9
:A
:1007-3639(2013)05-0357-05
2012-11-08
2013-03-10)
吴伟主 E-mail:lhm6728@nbip.net

