活体猪肢体长骨多极射频消融灶的影像改变
近年射频消融(RFA)已尝试用于治疗骨样骨瘤、软骨母细胞瘤及转移性肿瘤等骨肿瘤,并取得较好的疗效[1,2]。既往对骨肿瘤RFA的研究多侧重于热场分布、单次RFA的消融范围[3,4],但是RFA后如何评估RFA灶的实际坏死范围及其后续变化、周围骨组织的修复过程,为后续治疗提供指导,目前尚未研究清楚。本研究尝试寻找简单、有效的影像学评估手段,以判断RFA效果,协助临床制订后续治疗方案。
1 材料与方法
1.1 实验动物 云南小耳活猪11头,由昆明医学院动物科提供,年龄(90.0±5.7)d,体重(50.0±7.1)kg。1.2 仪器 RFA-I型多极射频肿瘤消融系统及配套RFA-1315型多极消融电极针(北京博莱德光电技术开发公司);Allura Xper FD-20平板探测器血管造影系统(飞利浦公司);DVD9SB型骨科电钻(广东妙达工具有限公司),克氏针及骨穿刺套件等。
1.3 方法 由于预实验猪股骨干出现病理骨折、猪不能活动,故选择实验猪胫骨RFA。活猪11头,随机分为A、B、C组;A组1头猪为空白对照组;B组7头猪为立即处死组;C组3头猪为随访组,依次标记为C1~3。将猪前腿及后腿绑在一起后,采用3%戊巴比妥10~20 mg/kg腹腔内缓慢注射行基础麻醉,随后开放耳缘静脉滴注3%戊巴比妥维持麻醉,速度6 ml/h,其间猪心率不低于90次/min,呼吸频率不低于12次/min;针刺实验猪皮肤及棉絮擦拭其角膜,实验猪无自主活动,达到麻醉满意状态。A组猪行X线及CT检查后深度麻醉处死获取空白对照标本。B组猪于两侧胫骨近端骨端、骨干中部行多极RFA,行X线及CT检查后深度麻醉处死,获取消融后0 d标本。C组中C1猪于左侧胫骨近端骨端及骨干中部行RFA,14 d后于右侧胫骨近端骨端及骨干中部再次行RFA,自第一次RFA后24 d行X线和CT检查后立即处死,获取RFA后10 d及24 d骨端及骨干标本;C2猪于右侧胫骨近端骨端和骨干中部行RFA,53 d后于左侧胫骨近端骨端和骨干再次行RFA,自第一次RFA后56 d于麻醉状态下行X线和CT检查后深度麻醉处死,获取RFA后3 d和56 d骨端和骨干标本;C3猪于右侧胫骨近端骨端和骨干中部行RFA,7周后于左侧胫骨近端骨端和骨干再次行RFA,第一次RFA后84 d于麻醉状态下行X线和CT检查后深度麻醉处死,获取RFA后35 d和84 d骨端和骨干标本。RFA后,C组实验猪于动物科饲养观察,不限制自主活动,给予玉米面0.5 kg及适量水,每天3次。获取猪胫骨标本立即用10%福尔马林固定,沿射频消融针道长轴纵向锯开标本,肉眼观察射频消融并测量后(尤其是0 d标本的坏死面积),送病理室做骨切片,HE染色后镜下观察。多极射频消融条件:中心温度90℃,持续时间15 min。
1.4 图像分析 X线及CT图像由3位放射科副主任医师以上医师单独阅片,病理切片由3位副主任医师以上医师单独观察;然后放射科医师与病理科医师会诊,探讨影像改变及其病理基础。
2 结果
2.1 标本获取及影像学检查情况 RFA后0 d骨端及骨干标本15个,空白对照骨端及骨干标本各1个,RFA 后3、10、24、35、56、84 d骨端及骨干标本各1个,合计胫骨骨端22个,骨干22个;空白对照猪及RFA后0、3、10、24、35、56、84 d骨端及骨干标本X线及CT检查各一次。
2.2 影像学及病理改变
2.2.1 骨端多极RFA灶影像学及病理改变 RFA后0 d、3 d X线及CT检查,除钉状的低密度针道外,骨端RFA灶未见明显异常改变;光镜下组织结构基本正常。RFA后10 d X线及CT检查在RFA灶边缘见窄带状低密度区形成,呈椭圆形(图1D~F);光镜下可见炎症细胞浸润、肉芽组织及其成熟后形成的纤维组织,肉芽组织吸收坏死骨质;其外侧及内侧骨质均未见影像学改变,光镜下组织学改变也不明显。RFA后24、35、84 d,RFA灶边缘低密度区向内逐步扩展、增宽至中心;光镜下可见肉芽组织向内逐渐吸收坏死骨质至中心;低密度带外缘环状骨质硬化(图1H、J、K),光镜下可见纤维组织内大量成纤维细胞及周围新形成的尚未成熟的骨质,随时间向内缓慢填充。
2.2.2 骨干多极RFA灶影像学病理改变 RFA后0 d、3 d X线及CT检查,除骨皮质内钉状的低密度针道外,骨髓组织及外缘骨质均未见明显影像学变化;光镜下可见RFA灶中部组织脱落,边缘骨皮质组织学改变不明显。RFA后10、24 d,RFA灶内的骨髓密度减低,呈长椭圆形,可见气体影;外缘骨质未见明显异常改变,光镜下改变同前;RFA后35、56 d标本出现射频消融区域骨干病理性骨折及死骨形成,死骨长约4 cm,其周围见明显环状骨痂形成(图2G、H、I);镜下见大量炎症细胞浸润、肉芽组织、纤维组织和新生骨质。RFA后84 d标本,见髓腔内、外多量骨痂形成,骨质密度增高,髓腔缩小、狭窄(图2J、K、L);镜下见大量新生骨质。
3 讨论
RFA后如何评估坏死区域范围是否与术前、术中计划一致,是否需补充RFA治疗,对于保证RFA治疗效果至关重要。本实验结果显示,RFA能够有效损坏骨端松质骨,提示RFA能够损毁肿瘤组织与正常骨组织交错分布的肿瘤边缘区域,即相当于外科手术的安全切缘。
RFA后10 d可在X线及CT图像上观察到松质骨RFA灶边缘的低密度带,镜下见炎症细胞浸润、肉芽组织形成并吸收已热损伤坏死的骨质;低密度带在随后时间内随着炎症反应、肉芽组织带向内推进而向内延伸至中心,提示可根据RFA后骨质吸收形成的低密度带来确定骨质RFA灶实际坏死边缘及范围,结合外科手术切除安全边际标准,可用于评估RFA范围是否满足治疗需求,是否需补充治疗。
RFA后24 d于RFA灶边缘即可见修复反应、新骨形成,但吸收及纤维性修复的速度快于骨修复的速度;另外,骨干RFA后35 d或56 d后出现病理性骨折及死骨形成,根据既往研究[5]提示热量对密质骨损伤作用有限,推测可能与骨干骨皮质髓腔侧2/3血液供应障碍和实验猪无法有效制动有关,提示骨RFA时消融范围不能过大、过多地损毁皮质血供,否则可能会引起死骨形成及病理性骨折。
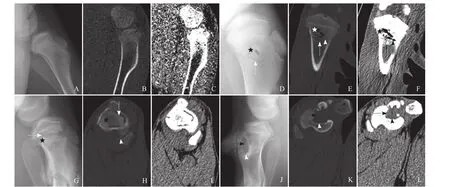
图1 A~C. RFA后3 d C2猪左侧胫骨骨端RFA灶X线及CT检查示:除针道外,RFA灶内骨质未见明显异常改变;D~F. RFA后10 d C1猪右侧胫骨骨端RFA灶X线及CT检查示RFA灶边缘骨质吸收带(箭),内部部分区域内可见气泡(箭头),中心的消融针道(星号);G~I. RFA后35 d C3猪左侧胫骨骨端X线及CT检查示RFA灶边缘的骨质吸收带(箭)、骨质吸收带外缘的新生骨质(箭头)、内部尚未被吸收的坏死骨质(星号);J~L. RFA后84 d C3猪右侧胫骨骨端RFA灶X线及CT检查示RFA灶坏死骨质被吸收,由纤维组织填充(箭),边缘见新生骨质(箭头)
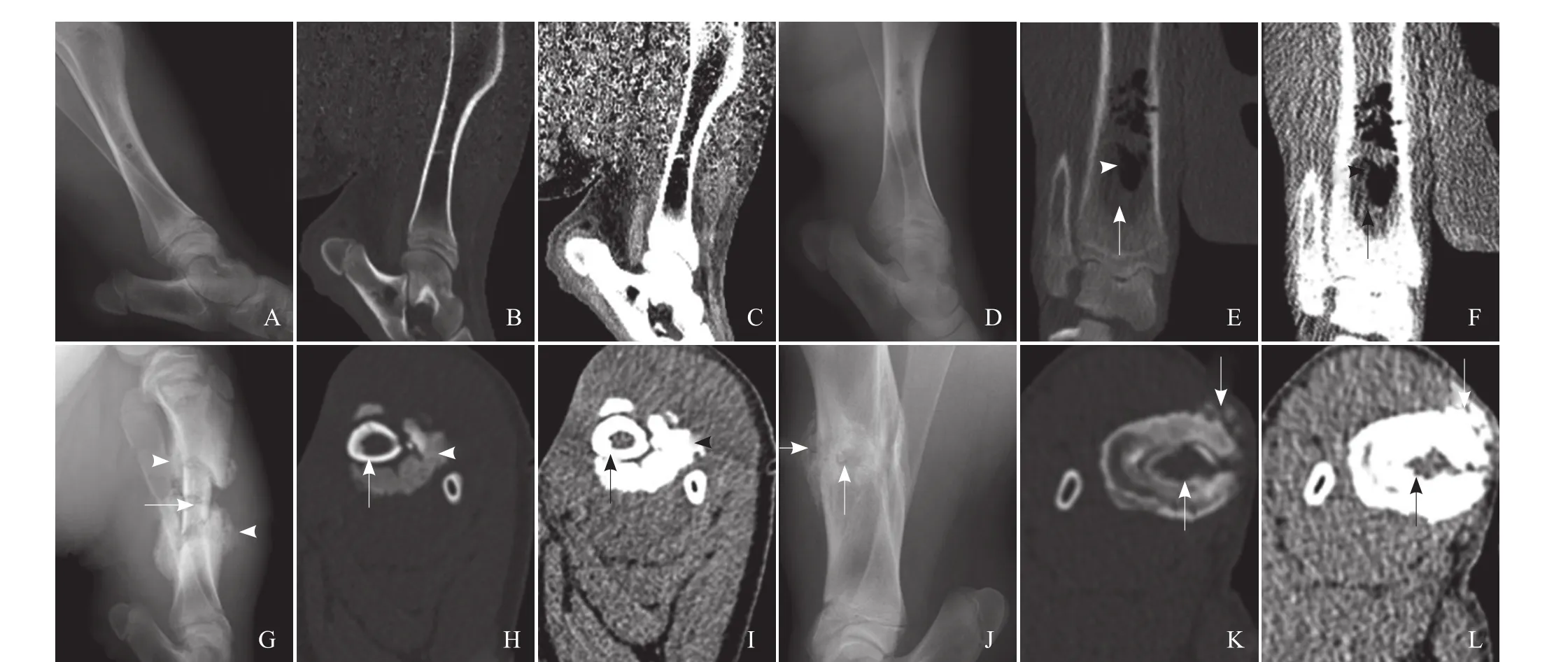
图2 A~C. RFA后3 d C2 猪左侧胫骨骨干X线及CT检查示RFA灶未见明显改变;D~F. RFA后10 d C1猪右侧胫骨骨干X线及CT检查示RFA灶区内髓质密度略低(箭),其内见积气(箭头);G~I. RFA后35 d C3猪左侧胫骨骨干X线及CT检查示RFA区的死骨(箭)及其两端的大量骨痂(箭头);J~L. RFA后84 d C3猪右侧胫骨骨干X线及CT检查示RFA区皮质骨内外大量骨痂(箭),髓腔缩小
既往骨射频消融相关研究多注重于匀质骨质中的热场分布规律、RFA范围大小,而骨肿瘤,特别是恶性骨肿瘤仅局限于骨皮质、松质骨或髓腔内者较少,且多在离体新鲜骨上进行,虽然骨血管分布对RFA范围影响有限,但血管分布可能会影响术后周围组织修复。本实验选择在活猪胫骨骨端及骨干行RFA实验,探讨实际RFA范围、RFA后消融灶随时间的影像改变特点,并与病理学对照,分析RFA后消融灶周围组织的修复过程及特点,以期为临床应用提供更有价值的参考信息。
对于骨肿瘤RFA效果的评估,Purandare等[6]认为FDP PET/CT可以从功能水平更易早期检测出是否有肿瘤组织残留,尽管X线和CT检查对肿瘤的残留早期评估不及PET/CT,但其更容易普及、更实用。
本实验研究的局限性在于缺少MRI[7]、PET对照,样本量少,尚需在后续实验中进一步完善。
总之,X线及CT图像能够反映RFA灶的坏死范围、随后的吸收及周围组织修复过程的特点,可以为骨肿瘤RFA灶的损毁情况及周围组织修复过程的评估提供影像学参考。由于骨组织在不同种属的动物之间存在高度同源性[8],因此本实验结果可以为临床骨肿瘤的RFA治疗提供参考。
[1]Palussière J, Pellerin-Guignard A, Descat E, et al.Radiofrequency ablation of bone tumours. Diagn Interv Imaging, 2012, 93(9): 660-664.
[2]Omlor G, Merle C, Lehner B, et al. CT-guided percutaneous radiofrequency ablation in osteoid osteoma: re-assessments of results with optimized technique and possible pain patterns in mid-term follow-up. Rofo, 2012, 184(4): 333-339.
[3]汝鸣, 蔡郑东, 郑龙坡, 等. Paiban骨组织单电极射频消融的范围及热场分布. 中国组织工程研究与临床康复, 2008,12(30): 5865-5868.
[4]Haemmerich D. Mathematical modeling of impedance controlled radiofrequency tumor ablation and ex-vivo validation. Conf Proc IEEE Eng Med Biol Soc, 2010: 1605-1608.
[5]郑龙坡, 蔡郑东, 牛文鑫, 等. 热力学有限元方法研究骨组织热传导的三维空间分布. 中国组织工程研究与临床康复,2008, 12(39): 7665-7668.
[6]Purandare NC, Rangarajan V, Shah SA, et al. Therapeutic response to radiofrequency ablation of neoplastic lesions: FDG PET/CT fi ndings. Radiographics, 2011, 31(1): 201-213.
[7]Rempp H, Hoffmann R, Roland J, et al. Threshold-based prediction of the coagulation zone in sequential temperature mapping in MR-guided radiofrequency ablation of liver tumours. Eur Radiol, 2012, 22(5): 1091-1100.
[8]戴景兴, 杨林林, 曲戎梅, 等. 猪源性骨支架材料的制备及性能研究. 中国临床解剖学杂志, 2007, 25(4): 439-442.

