钩端螺旋体groEL基因原核表达及其产物免疫保护作用
李小余,王银环,严 杰,程东庆
(1.浙江中医药大学生命科学学院,浙江 杭州 310053;2.浙江大学医学院病原生物学系,浙江 杭州 310058)
由致病性钩端螺旋体(Leptospira)(简称钩体)感染引起的钩体病是全球流行的人兽共患传染病,我国是该病的主要疫区之一[1-2]。钩体病通过疫水迅速传播,极易引起暴发流行,故钩体病是我国重点监控的传染病之一。致病性钩体自然宿主和血清群众多,仅我国即有18个血清群,但各血清群之间交叉保护作用弱或无[3]。目前使用的钩体疫苗均为当地流行问号钩体血清群、型制备的多价全菌死疫苗,但该疫苗对其未包含的钩体血清群感染无保护作用,同时全菌疫苗副作用很大[4-6]。因此研发高效低毒的通用型钩体基因工程疫苗具有重要意义。
研发通用型钩体基因工程疫苗的前提是筛选出不同血清群型中普遍存在的属特异性保护抗原。早年发现,钩体外膜总蛋白具有交叉免疫保护作用[7]。近年文献报道,LipL32、LigB、Loa22和OmpL1等外膜蛋白是属特异性抗原[8-11],但此类蛋白分子量过大或存在不同的基因型[9,12-13]。GroEL 是细菌热休克蛋白(heat shock protein,HSP)家族成员,序列保守,有很强的免疫原性[14-16]。在问号钩体赖株染色体中也存在编码 groEL基因[17],且其表达产物GroEL是外膜蛋白[18-19]。因此,GroEL 蛋白有可能作为钩体基因工程疫苗抗原。本研究中,我们检测了我国优势流行钩体血清群中groEL基因,重组表达了问号钩体赖型赖株GroEL蛋白并进行了动物保护性试验,以期为GroEL作为通用型钩体基因工程疫苗抗原提供依据。
1 材料和方法
1.1 钩体株及培养 我国用于钩体病血清学诊断的标准株问号钩体黄疸出血群赖型赖株、流感伤寒群流感伤寒型临6株、秋季群秋季型临4株、波摩那群波摩那型罗株、澳洲群澳洲型65-9株、七日热群七日热型56069株、犬群犬型林株、塞罗群乌尔夫型L183株由浙江大学医学院病原生物学系提供,采用EMJH培养基在28℃条件下培养。
1.2 groEL基因扩增 采用 (Generay)提取问号钩体赖株DNA,紫外分光光度法测定其浓度和纯度[20]。根据 GenBank上问号钩体赖株groEL 基因序列(accession No.:NC_004342)及其限制性核酸内切酶图谱分析结果、原核表达载体pET42a(Novagen)多克隆位点,设计扩增全长groEL基因并携带合适内切酶位点的引物。上游引物序列:5'-CGC CAT ATG(Nde I)GCG AAA GAT ATT GAA-3',下游引物序列:5'-CGC CTC GAG(Xho I)CAT CAT TCC GCC CAT TCC。引物由上海 Invitrogen公司合成。采用高保真PCR试剂盒(TaKaRa)扩增groEL基因,PCR 总体积 100 μl,内含 2.5 mol/L dNTP、200 nmol/L 各引物、20 mol/L MgCl2、2.5 U EX-Taq DNA聚合酶、100 ng DNA模板和1×PCR缓冲液(pH8.3)。PCR参数:94℃ 5 min;94℃ 30 s、52℃ 30 s、72℃ 120 s,30 个循环;72℃ 10 min。采用溴乙锭预染色的1.5%琼脂糖凝胶电泳检测PCR结果。
1.3 扩增产物测序及分析 采用PCR产物纯化试剂盒(BioColor)回收groEL基因扩增片段,采用T-A克隆试剂盒(TaKaRa)将其克隆至pMD-19T质粒中,形成 pMD-19TgroEL后电转化入E.coli DH5α(Invitrogen)并在 LB培养液(Oxoid)中扩增,氨苄西林和蓝白斑双重筛选,质粒提取试剂盒(Axygen)提取重组质粒后采用Nde I和 Xho I(TaKaRa)双酶切初步鉴定[20],委托上海 Invitrogen 公司测序。采用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM)和 TMpredServer(http://www.ch.embnet.org/software/TMPRED_form.html)中软件对GroEL结构进行分析。
1.4 groEL基因原核表达系统构建及鉴定采用Nde I和Xho I分别双酶切pMD19-TgroEL和pET42a,在T4 DNA连接酶(TaKaRa)作用下,将回收的groEL基因片段连接于线性化pET42a,形成重组表达载体 pET42agroEL。将pET42agroEL电转化入表达宿主菌 E.coli BL21DE3(Novagen),获得工程菌E.coli BL21DE3pET42a-groEL,质粒提取试剂盒(Axygen)提取质粒后再次测序[20]。
1.5 目的重组蛋白表达与纯化 E.coli BL21DE3pET42a-groEL接种于含50 μg/mL卡那霉素(Sigma)的LB培养液中,37℃培养至A600=0.6~0.8时加入终浓度为0.5 mmol/L的 IPTG(Sigma),以诱导目的重组蛋白GroEL(rGroEL)表达。培养物10000 r/min 4℃离心5 min,细菌沉淀用 0.01 mol/L Tris-HCl缓冲液(pH7.5)洗涤2次,冰浴中超声破碎,5000 r/min 4℃离心10 min,取上清和沉淀备检。采用10%分离胶的SDS-PAGE联合Bio-Rad凝胶图象分析系统检查rGroEL表达情况及状态,然后用 Ni-NTA亲和层析柱(BioColor)提纯可溶性rGroEL[21]。提纯的rGroEL采用试剂盒(Beyotime)测定其蛋白浓度。
1.6 rGroEL抗血清的制备 2 mg提纯的rGroEL与弗氏完全佐剂充分混匀,间隔一周背部多点皮内注射新西兰家兔4次。末次免疫两周后采集家兔心血,分离血清。采用 1 μg rGroEL为包被抗原的ELISA检测抗血清效价,其吸光度大于相同稀释度正常兔血清OD450均值+3SD 者判为阳性[22]。
1.7 rGroEL 免疫反应性检测:200 μg rGroEL SDS-PAGE后电转移至PVDF膜(Life Sciences)上。以1∶2500 稀释的rGroEL兔抗血清或1∶500稀释的钩体病病人血清为一抗、1∶10000 稀释的HRP标记羊抗兔IgG(Jackson ImmunoResearch)为二抗,采用 Western Blot法检测rGroEL与上述血清标本的免疫反应性。
1.8 金地鼠保护试验 4周龄雄性金地鼠购自北京维通利华实验动物技术有限公司。新鲜培养的问号钩体赖株12000 r/min离心15 min(4℃),沉淀的钩体用不同体积的EMJH培养液重悬,Petroff-Hausser counting chamber计数板(Fisher Scientific)计数[23]。先将金地鼠分为5组,每组6只,其中4组分别腹腔注射107、108、109或1010问号钩体赖株悬液1 mL,观察7 d,另一组注射等体积EMJH培养液作为对照,以确定最低致死量(MLD)。将金地鼠分为3组,每组8只,其中两组分别腹股沟皮下注射100 μg 或 200 μg rGroEL 与 1 mg 氢氧化铝(Sigma)混合物,间隔一周重复免疫一次,另一组注射200 μg BSA(Sigma)与氢氧化铝混合物作为对照[12]。末次免疫后两周,用2倍 MLD问号钩体赖株腹腔注射进行攻击,观察7 d。上述实验动物饲养温度21±2℃,相对湿度30%~70%,光照周期14/10 h。
1.9 显微镜凝集试验(MAT) 采集上述动物保护试验中存活的rGroEL免疫金地鼠心血,分离血清。血清用 PBS 进行 1∶50、1∶100、1∶200、1∶400、1∶800 稀释,取 0.1 ml与等量新鲜培养的问号钩体黄疸出血群赖型赖株、流感伤寒群流感伤寒型临6株、秋季群秋季型临4株、波摩那群波摩那型罗株、澳洲群澳洲型65-9株、七日热群七日热型56069株、犬群犬型林株、塞罗群乌尔夫型L183株混合,37℃孵育1 h,然后在暗视野显微镜下观察,以50%钩体被凝集的血清最高稀释度作为效价判断终点。实验中用正常金地鼠血清作为对照。
2 结果
2.1 groEL基因分布 从问号钩体黄疸出血群赖型赖株、流感伤寒群流感伤寒型临6株、秋季群秋季型临4株、波摩那群波摩那型罗株、澳洲群澳洲型65-9株、七日热群七日热型56069株、犬群犬型林株、塞罗群乌尔夫型L183株基因组DNA中均扩增出预期大小的groEL基因片段(图1)。
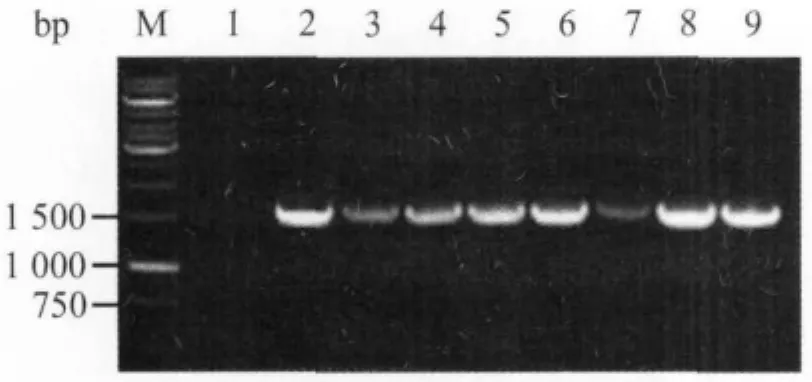
图1 不同问号钩体血清群groEL基因扩增片段Fig.1 Amplification fragments of groEL gene of different L.Interrogans serogroups
2.2 groEL基因测序与结构分析结果 与GenBank(accession No.:NC_004342)中问号钩体赖株groEL基因比较,本实验所克隆的问号钩体黄疸出血群赖型赖株、流感伤寒群流感伤寒型临6株、秋季群秋季型临4株、波摩那群波摩那型罗株、澳洲群澳洲型65-9株、七日热群七日热型56069株、犬群犬型林株、塞罗群乌尔夫型L183株groEL基因核苷酸和氨基酸序列相似性达99.5%以上。基因结构分析结果显示,GroEL为外膜蛋白,N端位于胞外,跨膜区序列为MAKDIEYNETARRKLLE,无胞内区(图2)。
2.3 rGroEL表达及其抗血清效价 在IPTG诱导下,所构建的原核表达系统 E.coli BL21DE3pET42a-groEL能有效表达rGroEL,该重组蛋白主要以可溶性形式存在,提纯的rGroEL经SDS-PAGE后显示为单一的蛋白条带(图3)。

图2 钩体GroEL蛋白结构分析结果Fig.2 Results of structural analysis of leptospiral GroEL protein
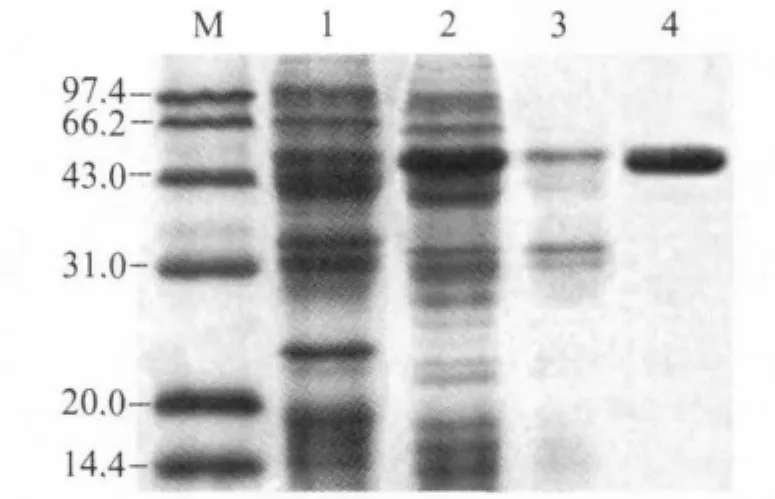
图3 rGroEL蛋白表达和提纯效果Fig.3 Expression and purification effects of rGroEL protein
2.4 rGroEL免疫原性 兔抗 rGroEL血清ELISA效价为1∶5000 。Western Blot结果显示,rGroEL可被兔抗rGroEL血清及钩体病患者血清识别并产生结合反应(图4)。
2.5 rGroEL免疫保护效果 问号钩体赖株对金地鼠MLD为108。2倍MLD问号钩体赖株攻击后,100与200 μg rGroEL免疫的金地鼠存活率分别为 50.0%(4/8)和75.0%(6/8)。
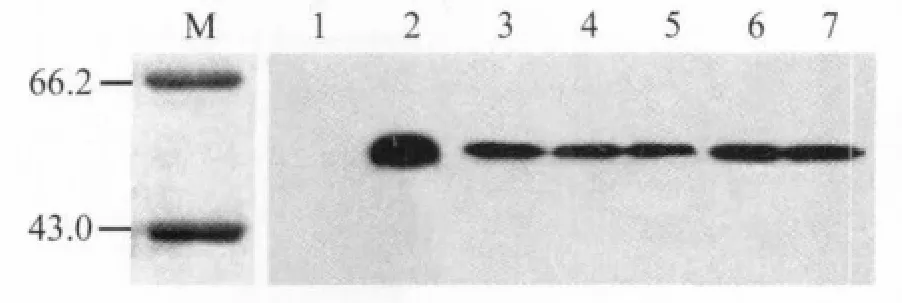
图4 rGroEL与不同血清标本Western Blot结果Fig.4 Western BlotresultofrGroEL with different serum specimens
2.6 MAT效价 rGroEL免疫金地鼠血清与问号钩体黄疸出血群赖型赖株、流感伤寒群流感伤寒型临6株、秋季群秋季型临4株、波摩那群波摩那型罗株、澳洲群澳洲型65-9株、七日热群七日热型56069株、犬群犬型林株、塞罗群乌尔夫型L183株的 MAT效价为1∶50~1∶400(表2)。
3 讨论
除新疆、西藏、青海、甘肃、宁夏省区至今尚未有钩体病例报道外,其余我国省区均存在不同程度的钩体病流行状况,其中四川、湖北、湖南等长江流域及岭南地区钩体病流行较为严重[2-3]。我国流行的主要问号钩体血清群为黄疸出血群、流感伤寒群、秋季群、波摩那群、澳洲群、七日热群和犬群,其中60% ~70%的钩体病病人为感染黄疸出血群赖型所致[2-3]。广东、广西、四川、江西等地区曾发生塞罗群棉兰型钩体感染所致的钩体病暴发流行[3]。
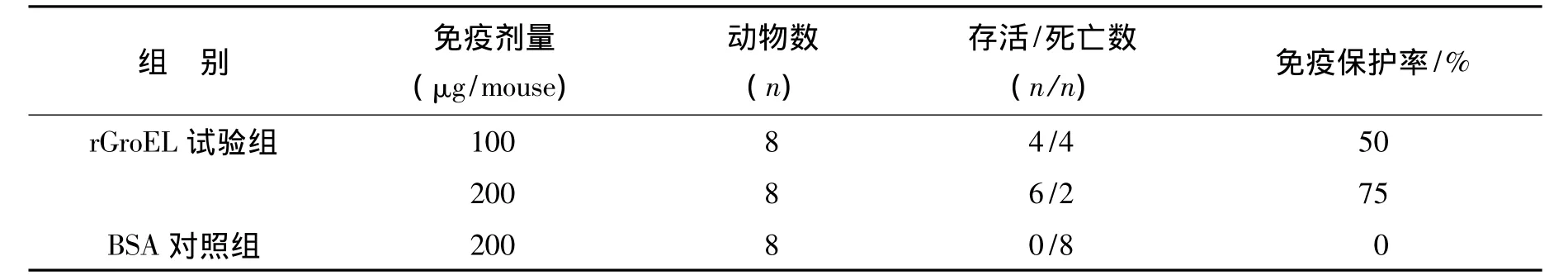
表1 rGroEL对金地鼠免疫保护效果Table 1 Immunoprotective effect of rGroEL in LVG hamsters

表2 rGroEL免疫金地鼠血清MAT检测结果Table 2 Detection result of sera from rGroEL-immunized LVG hamsters by MAT
接种疫苗是预防和控制传染病流行最为有效和经济的措施。现行使用的多价钩体全菌死疫苗虽对其所包含的钩体血清群感染有一定的保护作用,但接种后常有发热、接种部位淋巴结肿大等严重不良反应,一般认为该毒副作用由钩体细胞壁 LPS引起[3,12-13]。由于易感人群主要是农民,上述多价钩体全菌死疫苗接种后往往数天内不能进行重体力劳动,使疫苗预防接种受到了很大限制。多价钩体全菌死疫苗另一重大缺陷是,对疫苗中未包含的问号钩体血清群无交叉免疫保护作用,这也是近年来广东、广西、四川、江西等地区塞罗群棉兰型暴发流行的主要原因[2-3]。
GroEL是一种热休克蛋白,广泛存在于多种原核细胞型微生物,在新生蛋白正确折叠和组装、变性蛋白质修复、蛋白跨膜转移过程中起重要作用[14-16]。有文献报道,问号钩体秋季型GroEL 位于钩体外膜表面[18-19,24],是诱导宿主体液免疫反应的主要抗原,钩体病病人血清中可检出GroEL抗体[25]。我们的蛋白分子结构分析结果表明,GroEL确为外膜蛋白,其96.9%(17/546)序列位于菌体外。
我们以往研究中发现,问号钩体赖株感染巨噬细胞后,LipL32等不少外膜蛋白表达水平显著下降,但GroEL表达水平显著升高[26-27]。我们的实验结果显示,问号钩体黄疸出血群赖型赖株、流感伤寒群流感伤寒型临6株、秋季群秋季型临4株、波摩那群波摩那型罗株、澳洲群澳洲型65-9株、七日热群七日热型56069株、犬群犬型林株、塞罗群乌尔夫型L183株都有groEL基因且其序列高度保守。除幼豚鼠外,金地鼠是致病性钩体的易感动物[28]。本研究中,我们探讨了rGroEL蛋白对金地鼠的免疫保护作用,结果显示100与200 μg rGroEL免疫的金地鼠存活率分别为50.0%和75.0%(表1)。此外,rGroEL免疫金地鼠血清对上述8群8株问号钩体的MAT效价为1∶50~1∶400(表2)。综上所述,GroEL是分布广泛、序列保守、抗原性较强的问号钩体属特异性保护性抗原,可用于研制通用性钩体基因工程疫苗。
[1]BHARTI A R,NALLY J E,RICALDI J N,et al.Leptospirosis:a zoonotic disease of global importance[J].Lancet Infect Dis,2003,3(12):757-771.
[2]ZHANG C L,WANG H,YAN J.Leptospirosis prevalence in Chinese populations in the last two decades[J].Microbes Infect,2012,14(4):317-323.
[3]YAN Jie,DAI Baoming,YU Enshu(严 杰,戴保民,于恩庶).Leptospirology(钩端螺旋体病学)[M].Third Edition,Beijing:The People's Healthy Publication House,China,2006.(in Chinese)
[4]SUN Baili,GUO Zongqi,LUO Dongjiao(孙百莉,郭宗琪,罗冬娇,等),et al.Membrane location and naturally antibody responses of genus-specific antigen OmpLls of Leptospira interrogans[J].Acta Microbiol Sin(微生物学报),2007,47(2):329-334.(in Chinese)
[5]LUO Dongjiao,YAN Jie,MAO Yafei(罗冬娇,严杰,毛亚飞,等),et al.Construction and application ofprokaryotic expression system ofLeptospira interrogans lipL32/1-lipL41/1 fusion gene [J].JournalofZhengjiang University:Medical Sciences(浙江大学学报:医学版),2005,34(1):27-32.(in Chinese)
[6]YAN Jie(严 杰).ProgressofLeptospira pathogenic mechanismsand new vaccinesand bacterial drug resistance [J].Journal of Zhengjiang University:Medical Sciences(浙江大学学报:医学版),2008,37(6):537-543.(in Chinese)
[7]SONRIER C,BRANGER C,MICHEL V,et al.Evidence ofcross-protection with in Leptospira interrogans in an experimental model[J].Vaccine,2000,19(1):86-94.
[8]HAAKE D A,CHAO G,ZUERNER R L,et al.The leptospiral major outer membrane protein LipL32 is a lipoprotein expressed during mammalian infection[J].Infect Immun,2000,68(4):2276-2285.
[9]JULIO C,CLAUDIO P F,ELSIO A W J,et al.Targeted mutagenesis in pathogenic Leptospira species:Disruption of the LigB gene does not affect virulence in animal models of leptospirosis[J].Infect Immun,2008,76(12):5826-5833.
[10]PICARDEAU M,BULACH D M,BOUCHIER C,et al.The OmpA-like protein Loa22 is essential for leptospiral virulence [J].PLoS Pathog,2007,3(7):0894-0903.
[11]HAAKE D A,CHAMPION C I,MARFINCH C,et al.Molecular cloning and sequence analysis of the gene encoding OmpL1,a transmembrane outer membrane protein of pathogenic Leptospira spp[J].J Bateriol,1993,175(13):4225-4234.
[12]LUO D J,XUE F,OJCIUS D M,et al.Protein typing of major outer membrane lipoproteins from Chinese pathogenic Leptospira spp. and characterization of their immunogenicity [J].Vaccine,2010,28(1):243-255.
[13]DONG H Y,HU Y,XUE F,et al.Characterization of the ompL1 gene of pathogenic Leptospira species in China and cross-immunogenicity of the OmpL1 protein [J].BMC Microbiol,2008,8:223.
[14]KHAN M,SHUKLAD,BANSALA,etal.Immunogenicity and protective efficacy of GroEL(hsp60)of Streptococcus pneumoniae against lethal infection in mice [J].FEMS Immunol Med Microbiol,2009,56(1):56-62.
[15]NOAH C E,MALIK M,BUBLITZ D A C,et al.GroEL and lipopolysaccharide from Francisella tularensis live vaccine strain synergistically activate human macrophages[J].Infect Immun,2010,78(4):1797-1806.
[16]LIN J S,MARK A W.Escherichia coli thioredoxinlike protein YbbN contains an atypical tetratricopeptide repeat motif and is a negative regulator of GroEL [J].J Biol Chem,2011,286(22):19459-19469.
[17]REN S X,FU G,JIANG X G,et al.Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing[J].Nature,2003,422(6934):888-893.
[18]NATARAJASEENIVASAN K,ARTIUSHIN S C,VELINENI S,et al.Surface-associated Hsp60 chaperonin of Leptospira interrogans serovar Autumnalis N2 strain as an immunoreactive protein[J].Eur J Clin Microbiol Infect Dis,2011,30(11):1383-1389.
[19]LO M,CORDWELL S J,BULACH D M,et al.Comparative transcriptional and translational analysis of leptospiral outer membrane protein expression in response to temperature[J].PLoS Negl Trop Dis,2009,3(12):e560.
[20]SAMBROOK J,FRITSCHEF,MANIATIST.Molecular Cloning:A LaboratoryManual[M].2nd edition,New York:Cold Sping Harbor Labooratory Press,1989,1.21-1.52,2.60-2.80,7.3-7.35,9.14-9.22.
[21]XU Lihui,YAN Jie,RUAN Ping(徐丽慧,严杰,阮 萍,等),et al.Immune-functional epitopes and inflammation-inducing effects of the major outer envelope proteins of Leptospira interrogans[J].Journalof Zhengjiang University:Medical Sciences(浙江大学学报:医学版),2005,34(1):9-14.(in Chinese)
[22]LEWIS S M, OSEI-BIMPONG A.Haemoglobinometry in general practice[J].Clin Lab Haematol,2003,25(6):343-346.
[23]SCHREIER S,TRIAMPO W,DOUNGCHAWEE G,et al.Leptospirosis research:fast,easy and reliable enumeration of mobile leptospires[J].Biol Res,2009,42(1):5-12.
[24]CULLEN P A,XU X,MATSUNAGA J,et al.Surfaceome of Leptospira spp[J].Infect Immun,2005,73(8):4853-4863.
[25]PARK S H,AHN B Y,KIM M J.Expression and immunologic characterization of recombinant heat shock protein 58 of Leptospira species:a major target antigen of the humoral immune response[J].DNA Cell Biol,1999,18(12):903-910.
[26]SUN Pingping,LIN Xv'ai,LI Liwei(孙萍萍,林旭瑷,李 立 伟,等),etal.Diversityofouter membrane protein expression of Leptospira interrogans during infection ofhuman THP-1 monocytes [J]. Chinese Journal of Microbiology and Immunology(中华微生物学与免疫学杂志),2012,32(3):224-231.(in Chinese)
[27]XUE F,DONG H Y,WU J Y,et al.Transcriptional responses of Leptospira interrogans to host innate immunity:Significantchangesin metabolism,oxygen tolerance,and outer membrane [J].PLoS Negl Trop Dis,2010,4(10):e857.
[28]ATZINGEN M V,VIEIRA M L,OLIVEIRA R,et al.Evaluation of immunoprotective activity of six leptospiral proteinsin the hamstermodelof leptospirosis[J].Open Microbiol J,2012,6(1):79-87.

