再竭运动恢复期大鼠纹状体微透析液中Glu和GABA含量的变化
邱守涛,张蕴琨
早在19世纪末期,意大利都灵大学的著名生理学家Angelo Mosso利用记功器记录中指屈肌在随意运动及电刺激时的收缩情况,其认为肌肉疲劳的影响因素来源于中枢(脑和脊髓)和外周(神经肌肉接头和骨骼肌)[1],由于当时技术条件的限制,运动性中枢疲劳研究进展缓慢。近年来随着生理学、生物化学和神经生物学的发展及新型分析技术的应用,运动性中枢疲劳逐渐成为体育科学领域研究的热点问题。众多学者认为长时间运动时及其恢复期,脑内神经递质含量的变化及不同递质之间平衡的破坏导致了运动性中枢疲劳的发生[2-5];中枢神经系统(central nervous system,CNS)氨基酸类神经递质含量发生变化,影响CNS的兴奋与抑制过程,是运动性中枢疲劳产生的可能机制之一[6-7]。谷氨酸(glutamate,Glu)和γ-氨基丁酸(γ-amino-butyric acid,GABA)分别是脑内最重要的兴奋性及抑制性氨基酸类神经递质,直接参与CNS兴奋及抑制过程的调控;另外有学者认为Glu/GABA比值的变化可以在一定程度上反映脑内氨基酸类神经递质之间的平衡情况,影响中枢神经系统的生理功能[8-9]。因此本研究采用微透析技术取得纹状体细胞外液样品,利用毛细管电泳—激光诱导荧光技术对其中所含Glu及GABA含量进行测定,动态观察力竭运动24 h恢复期纹状体细胞外液Glu及GABA含量的变化,了解同一研究对象在力竭运动恢复期不同时段Glu、GABA释放的变化特征及规律,揭示运动性中枢疲劳的产生及恢复机制,为探索运动性中枢疲劳与细胞外液Glu及GABA含量之间的关系提供实验依据。
1 实验材料
1.1 实验动物及分组
12只SD 雄性成年大鼠体重为200~230 g,随机分为两组:(1)安静对照组A(n=6)正常饲养,不施加运动;(2)力竭运动组B(n=6)进行一次性力竭游泳运动;分养于室温下(18~25℃),自然光照周期,自由进食饮水。
1.2 实验仪器和试剂
毛细管电泳—激光诱导荧光系统(美国贝克曼公司P/ACE MDQ毛细管电泳仪,毛细管柱总长度57 cm,有效长度50 cm,内径75 μm,外径375 μm);I2C 型脑立体定位仪购自美国stoting公司;微透析探针(型号为IBR4)、微量注射泵、连接管均为美国BAS公司;所用水均为超纯水(去离子水用Mollipore公司生产的millipore water system 制备);Glu和GABA标准品均为Sigma 公司产品,其它化学试剂均为国产分析纯。
人工脑脊液(ACSF溶液NaCl:140 mmol/L;KCl:2.4 mmol/L; MgCl2:1.0 mmol/L; CaCl2:1.2 mmol/L;NaHCO3:5.0 mmol/L; Vc:0.6; PH=7.4 mmol/L )
2 实验方法
2.1 力竭运动实验
力竭运动组大鼠于实验前适应性游泳5次,每次15 min。实验时使大鼠一次性负重(2.92 %体重)游泳至力竭。游泳池采用无色透明玻璃缸(120 cm×60 cm×80 cm),水温(30 ±2)℃,水深60 cm。力竭运动标准为:(1)游泳动作明显失调,在水中放射性乱窜,不能再坚持;(2)沉入水底不能回到水面超过10 s[10]。
2.2 纹状体脑区定位手术
力竭运动组大鼠在游泳力竭运动后,擦干身上水渍,用20%乌拉坦按1 g/kg体重剂量腹腔注射麻醉,每6小时采用皮下注射法补注射相同剂量的乌拉坦。将麻醉大鼠固定在脑立体定位仪上,根据《大鼠脑立体定位图谱》对大鼠右侧纹状体进行定位(坐标为AP:+1mm ML:+2.8mm DV:-2.6mm),在定位部位用颅钻在头骨钻一直径约为1.5 mm的小孔,于定位头骨表面下植入一根直径1.30 mm,长14 mm的灭菌不锈钢引导管,并用牙科水泥固定。
2.3 微透析采样
采样时小心将微透析探针沿引导管探入右侧纹状体脑区,利用微量注射泵将人工脑脊液以2 μl/min的速度恒速灌注,平衡180 min;分别于运动后4 h、5 h、6 h、 8 h、24 h收集微透析液。每一时刻收集时间为30min,提前15 min开始采集。收集完成后立即转入-80℃低温冰箱保存。
安静对照组A采用相同的方法采集微透析样品。
2.4 脑组织学鉴定
将完成微透析取样的大鼠断头处死,取全脑,福尔马林中过夜,固定后切片,检查微透析探针是否插入纹状体中,微透析探针未准确插入纹状体的数据不采用。
2.5 微透析样品检测
采用毛细管电泳—激光诱导荧光技术测定大鼠纹状体脑区微透析液中Glu、GABA含量。
2.6 数据处理
所有数据均采用平均数±标准差(X±SD)表示,用spss13.0对数据进行重复测量资料的方差分析,α为0.05。
3 研究结果
3.1 力竭运动恢复期大鼠纹状体细胞外液Glu含量的变化
表1、图1表明力竭运动后4~24 h恢复期大鼠纹状体细胞外液中Glu含量呈现先上升后下降的趋势,力竭运动后8 h达到峰值,随着恢复时间的逐渐延长,其含量逐渐下降,运动后24 h大鼠纹状体细胞外液中Glu含量略高于安静水平(P<0.05)。
3.2 力竭运动恢复期大鼠纹状体细胞外液GABA含量的变化
表2、图2表明力竭运动后大鼠纹状体细胞外液中GABA含量显著上升,4~24 h恢复期呈现先上升后下降的趋势,运动后6 h达到峰值,随着恢复时间的逐渐延长,其含量逐渐下降,运动后24 h大鼠纹状体细胞外液中GABA含量仍高于安静水平(P<0.05)。
3.3 力竭运动恢复期大鼠纹状体细胞外Glu/GABA比值变化
表3、图3表明力竭运动后4 h细胞外液中Glu/GABA比值显著低于安静水平,但没有显著差异,5~24 h恢复期内细胞外液中Glu/GABA比值显著低于安静水平(P<0.05),在24 h恢复期内Glu/GABA比值呈现先下降后上升的趋势,比值在6 h降至最低点,其后逐渐上升,恢复至24 h时仍低于安静值(P<0.05)。

表1 力竭运动恢复期大鼠纹状体细胞外液Glu含量的变化(单位:μmol/L)TableⅠ Changes of Glu in the Striatum of Rat Brain in the Recovery Period after Exhaustive Exercise

表2 力竭运动恢复期大鼠纹状体细胞外液GABA含量的变化(单位:μmol/L)TableⅡ Changes of GABA in the Striatum of Rat Brain in the Recovery Period after Exhaustive Exercise

表3 力竭运动恢复期大鼠纹状体细胞外液Glu/GABA比值变化(单位:μmol/L)TableⅢ Changes of Glu/GABA Ratio in the Striatum of Rat Brain in the Recovery Period after Exhaustive Exercise
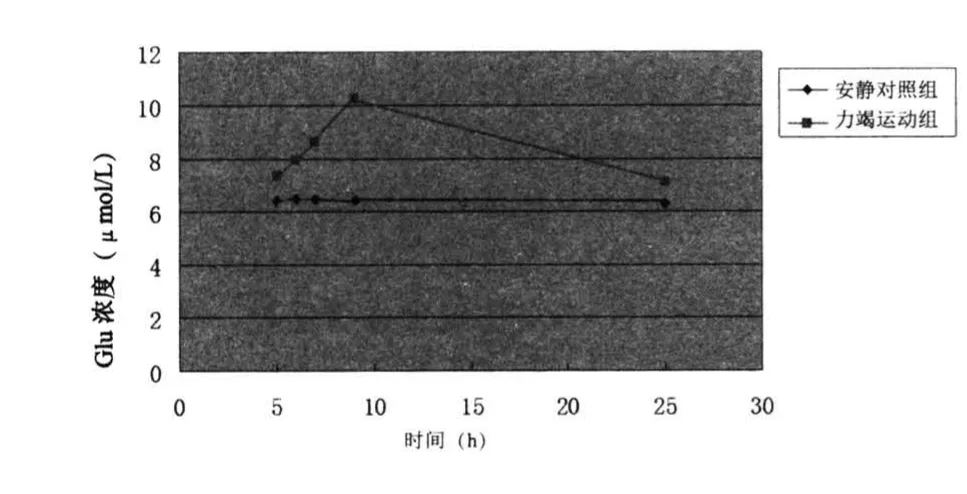
图1 力竭运动恢复期大鼠纹状体细胞外液Glu含量的变化Figure 1 Changes of Glu in the Striatum of Rat Brain in the Recovery Period after Exhaustive Exercise
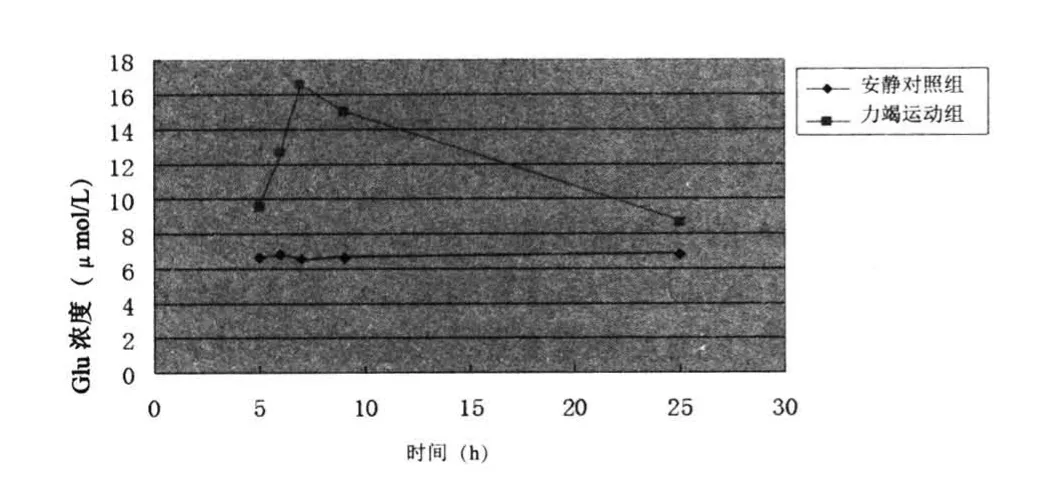
图2 力竭运动恢复期大鼠纹状体细胞外液GABA含量的变化Figure 2 Changes of GABA in the Striatum of Rat Brain in the Recovery Period after Exhaustive Exercise
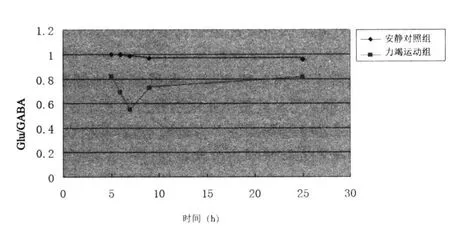
图3 力竭运动恢复期大鼠纹状体细胞外液Glu/GABA含量的变化Figure 3 Changes of Glu/GABA Ratio in the Striatum of Rat Brain in the Recovery Period after Exhaustive Exercise
4 分析讨论
4.1 力竭运动对大鼠纹状体细胞外液Glu含量的影响
Glu是脑内最重要的兴奋性氨基酸类神经递质,其作用于突触后膜上的相应受体使Na+内流,细胞膜去极化而产生兴奋性突触后电位,导致细胞的兴奋性增强而发挥作用。Glu在信息传递过程中发挥着重要作用,其含量的变化与运动性中枢疲劳的产生及发展密切相关,且在脑组织缺血缺氧的病理过程中发挥重要功能[11-12]。纹状体内的Glu包括储存在神经元囊泡的和释放到细胞外液的,真正与受体结合而发挥作用的是释放到细胞外液的Glu,本研究结果所反映的正是这部分递质的含量。安静状态下,大鼠纹状体细胞外液中的Glu含量约为6.45 μmol/L,这与Scott M.Rawls[13]所测结果基本一致。
本研究发现力竭运动后24 h恢复期Glu含量整体呈现先上升后下降的趋势。力竭运动后4~8 h大鼠纹状体细胞外液中Glu含量呈现上升的趋势。这可能由于当大鼠进行有氧运动达到力竭时,以及力竭后一定时间内脑组织处于相对缺血缺氧状态,影响神经元及神经胶质细胞对Glu重摄取,从而使Glu的释放增加。李菊[8]等人发现在脑缺血时,海马细胞外液中的Glu水平显著高于对照组。我们所观测Glu的升高幅度较小,可能是大鼠进行有氧运动达到力竭时,其相对缺氧程度较脑缺血轻。在运动后8~24 h恢复期大鼠纹状体细胞外液中Glu含量逐渐下降,恢复期24 h其含量仍高于安静值。力竭运动后4~24 h恢复期,大鼠纹状体细胞外液中Glu含量高于安静水平,其整体变化趋势为先上升后下降,在力竭运动后8 h时达到峰值。这与张东明[14]的对其他脑区的研究结果基本一致。
纹状体是通过直接通路和间接通路对机体的运动进行调节的,直接通路主要起易化运动的作用,而间接通路起抑制运动的作用,两者相互制约、相互弥补,处于动态平衡状态,因此机体处于不同机能水平时,直接通路与间接通路所起的作用不同。在正常运动时,细胞外液Glu水平适当升高造成纹状体兴奋时,经过分析整合,主要通过直接通路加强运动,以维持机体的运动能力保持在一定水平。但是当机体运动至力竭时,机体纹状体处于相对缺血缺氧状态,Glu水平显著升高,当其浓度超过一定程度时,纹状体则可能利用间接通路调节运动,导致运动性中枢疲劳的产生,通过抑制运动达到保护机体免受损害的目的。可见纹状体细胞外液中的Glu在运动调节中可能具有双向调节作用。
力竭运动后4~24 h恢复期,大鼠纹状体细胞外液Glu含量高于安静水平,其整体变化趋势为先上升后下降,在力竭运动后8 h时达到峰值。力竭运动后,纹状体细胞外液Glu显著高于安静水平,纹状体通过一系列机制对信息进行分析整合,使间接通路在纹状体调节活动中所占比例增加,抑制机体运动,从而达到保护性抑制目的,参与运动性中枢疲劳的产生。8~24 h恢复期细胞外液中兴奋性氨基酸类神经递质含量逐渐下降,直接通路调节所占比例逐渐增加,使机体的运动性中枢疲劳得以逐渐恢复。
4.2 力竭运动对大鼠纹状体细胞外液中GABA含量的影响
GABA是最重要的抑制性氨基酸类神经递质,其作用于突触后膜上的相应受体使Cl-1内流,突触后膜去极化产生抑制性突触后电位,造成细胞的兴奋性降低而发挥抑制作用。与Glu相同,其也分为贮存在细胞内的神经递质和释放到细胞外液中的神经递质,只有后者能通过与受体结合而发挥其生理功能,观察这部分神经递质含量的变化对于运动性中枢疲劳的研究具有积极的意义。本研究发现大鼠安静状态下纹状体细胞外液中GABA的含量约为6.55 μmol/L,这与文献[15]的报道基本一致。
在4~24 h恢复期中纹状体细胞外液GABA含量呈现出先升高后降低的变化趋势,力竭运动后6 h达到峰值。这与Dongming Zhang[16]等对其他脑区的研究结果基本一致,其利用微透析技术观察发现力竭运动后4 h视下丘细胞外液中GABA含量显著增加,运动后72 h二者的含量依然显著高于安静水平。这可能是由于机体在力竭运动后处于高度应激状态,兴奋性氨基酸类神经大量释放对神经组织造成兴奋毒性损伤,自由基等有害物质的产生增加也会造成神经组织的损伤,机体通过一定机制促进GABA的释放以对抗兴奋毒性,从而实现自身保护。邓雷等[17]研究发现GABA通过GABA - A受体抑制运动应激时自由基过量生成对大鼠海马CA1神经元超微结构产生保护作用。另外,GABA神经递质可以抑制纹状体的活动,通过直接通路抑制运动,而且GABA是纹状体间接通路中的重要神经递质,GABA释放的增加可以通过间接通路的作用抑制运动。力竭运动恢复期GABA含量明显高于安静水平,既可以防止因Glu过量增加造成的兴奋毒性损伤,又可通过直接通路和间接通路抑制运动的继续进行,达到保护性抑制的目的,造成机体运动性中枢疲劳的发生。随着恢复时间的延长,细胞外液GABA含量逐渐下降,对运动的抑制逐渐减弱,运动能力逐渐恢复,力竭运动后24 h时纹状体细胞外液GABA含量仍显著高于安静水平,说明运动后24 h机体仍处于抑制过程,运动性中枢疲劳还没有完全恢复。
4.3 力竭运动对大鼠纹状体细胞外液Glu与GABA之间的相互关系
运动对正常机体机能的影响不是由单一神经递质实现的,而是通过它们相互作用影响神经系统的机能活动,因此对于中枢疲劳机制的研究,不但要关注细胞外液兴奋性或抑制性氨基酸类神经递质含量的变化,而且要结合它们之间的比值进行分析。由于Glu与GABA分别是脑内最重要的兴奋性和抑制性氨基酸类神经递质,且Glu是GABA合成的前体物质,因此本研究针对二者的关系展开讨论。目前许多学者将Glu/GABA比值作为评定中枢神经系统兴奋与抑制的指标之一。李人[18]报道了在安静状态下受训与未受训的大鼠脑中Glu/GABA比值无显著差异,这意味着各组大鼠安静时脑中Glu与GABA的代谢水平相似。运动引起机体出现疲劳时,脑中Glu与GABA代谢水平发生变化,导致Glu/GABA比值显著降低,从而脑中GABA的抑制效应占优势,白宝丰[19]的研究结果也证明了这一点。
本研究发现大鼠力竭运动5~24 h恢复期内纹状体细胞外液中Glu/GABA比值显著低于安静水平,在24 h恢复期内Glu/GABA比值呈现先下降后上升的趋势,比值在6 h降至最低点,其后逐渐上升,到恢复期24 h时仍低于安静值。我们观察了纹状体细胞外液中氨基酸类神经递质的含量变化,发现力竭运动后细胞外液中Glu及GABA的含量均升高,但是GABA的升高幅度高于Glu,说明运动时抑制过程占优势导致了运动性中枢疲劳的发生。这可能是纹状体细胞外液Glu和GABA含量变化,导致纹状体的神经活动过程受到抑制,并通过神经递质调节运动的直接通路及间接通路抑制机体的运动过程,从而造成机体运动能力下降,导致运动性中枢疲劳的发生。
5 结论
5.1 纹状体细胞外液的Glu具有双向调节作用,当运动至力竭后纹状体Glu大量增加,过多的Glu可能通过间接通路抑制运动,参与了运动性中枢疲劳的发生。Glu释放量达到峰值后缓慢下降至接近安静水平,可能使直接通路恢复到正常水平,导致中枢兴奋性逐渐加强使疲劳得以恢复。
5.2 运动至力竭时纹状体细胞外液GABA含量的升高,有利于保护神经元免受兴奋毒性的损害,其浓度升高又可通过直接通路和间接通路抑制运动,从而达到机体保护性抑制的作用。在恢复期后期细胞外液中升高的GABA含量逐渐下降,对运动的抑制作用减弱。可见GABA在运动性中枢疲劳的产生与恢复过程中具有重要作用。
5.3 运动性中枢疲劳产生时,机体同时促进Glu和GABA的释放,但是GABA释放量更多,纹状体抑制过程占优势而影响运动。恢复期后期两者均逐渐下降,纹状体兴奋性逐渐升高,疲劳得以逐渐恢复。
5.4力竭运动恢复期大鼠纹状体细胞外液Glu、GABA含量升高及恢复均有延迟性,力竭运动后24 h恢复仍未完成;大鼠纹状体细胞外Glu/GABA显著低于安静水平,24 h恢复期抑制性神经递质仍起主导作用。
[1]Di Giulio, C., F. Daniele, C.M. Tipton.(2006). Angelo Mosso and muscular fatigue: 116 years after the fi rst Congress of Physiologists:IUPS commemoration[J]. Adv Physiol Educ, 30(2): 51-57.
[2]Gandevia SC. (2001).Spinal and supraspinal factors in human muscle fatigue [J]. Physiol Rev, 81:1725–1729
[3]John D. Fernstrom, Madelyn H. Fernstrom.(2005).Exercise,Serum Free Tryptophan, and Central Fatigue [J]. JN The Journal of Nutrition,135:1539-1546
[4]Yamamoto, T., H. Azechi, M. Board.(2012).Essential role of excessive tryptophan and its neurometabolites in fatigue[J]. Can J Neurol Sci, 39(1): 40-47.
[5]MeeusenR,Roelands B.(2010).Central fatigue and neurotransmitters, canthermoregulation be manipulated? [J].Scand J Med Sci Sports, 20 Suppl 3: 19-28.
[6]Davis JM, et al. (1997).Possible mechanisms of central nervous system fatigue during exercise. [J]. Med Sci Sport Exerc, 29(1):45-57
[7]Davis JM.(1996).Carbohydrates, branched amino acids and endurance: The central fatigue hypothesis[J]Sport Science Exhange, 9(2):6-10
[8]LabinerDM , Yan CC , Weinand ME , et al. (1999).Disturbances of amino acids from temporal lobe synaptosomes in human complex partial epilepsy[J]. NeurochemRes, 24 (11):1379
[9]DolinaS , Peeling J , Sutherland G, et al.(1993)Effect of sustained pyri2doxine treatment on seizure susceptibility and regional brain amino acid levels in genetically epilepsy - prone BALB/ c mice[J].Epilepsia,34 (1):33
[10]Moskowitz RW, Howell DS, Goldberg VM, et al. (1984).Osteoarthritis: diagnosis and management[M]. USA;W.B.saunders Company, 9-211
[11]李菊, 杨期东. 微透析技术和丹参注射液对Wistar鼠脑缺血时海马细胞外液兴奋性氨基酸释放的影响[J].中风与神经疾病杂志,1995,12(5):258-260
[12]胡永善,贾杰等.预运动训练对脑梗死大鼠脑保护作用的兴奋性氨基酸递质效应[J]. 中国康复医学杂志,2008,23(7):589-593
[13]Scott M. Rawls, Jacquelinef. Mcginty.(1998).Muscarinic Receptors Regulate.Extracellular Glutamate Levels in the Rat Striatum: An In Vivo MicrodialysisStudy[J].The Journal of and Experimental Therapeutics,286(1):91-98
[14]张东明,张佳民,马万云等. 急性力竭运动对大鼠下丘脑氨基酸神经递质的影响 [J].高等学校化学学报,2002,23(2):230-233
[15]福全,陈义等. 鼠脑微透析液中谷胱甘肽和介质氨基酸的CELIF[J].化学通报,1999,11:35-37
[16]DongmingZhang,JiamingZhang,WanyunMa,DieyanChen,Huiwa nHan,HongjunShu,GuoquanLiu.(2001). Analysis of trace amino acid neurotransmitters in hypothalamus of rats after exhausting exercise using microdialysis. Journal of Chromatography B,758: 277 – 282
[17]邓雷,张蕴琨,陆小香. GABA 受体阻断剂对力竭运动应激后大鼠海马CA1 区神经元氧化还原状态及超微结构的影响[J]. 西安体育学院学报,2009,26(3):351-356
[18]李人,陶心铭.运动性疲劳与脑中γ-氨基丁酸[J ].中国运动医学杂志,1985 ,4 (2):81 - 86.
[19]白宝丰,王斌,张蕴琨.力竭运动前后大鼠脑皮质运动区递质性氨基酸含量的动态变化[J].南京体育学院学报(自然科学版),2008,7(3):1-5
体育科研2013年3期
- 体育科研的其它文章
- 日本全国体育娱乐节的发展及启示
