多西紫杉醇治疗前列腺癌的分子机制研究*
吴 静 方克伟 石志豪 陈 韬 董 彪
前列腺癌(prostate carcinoma,Pca)是男性常发恶性肿瘤。在西方国家,前列腺癌死亡率居男性恶性肿癌的第二位[1]。近年来,我国男性前列腺癌发病率呈明显上升趋势[2]。前列腺癌的发生经历了雄激素依赖且受雄激素刺激阶段,非雄激素依赖但受雄激素刺激阶段,非雄激素依赖且雄激素不敏感阶段及非雄激素依赖且受雄激素抑制阶段等复杂的过程。因此,研究雄激素受体在前列腺癌中的表达是近年的热点问题[3]。围绕前列腺癌的基因组、基因转录和蛋白代谢的研究,可能提供集预测、治疗和预后于一体的“分子信号”[4]。紫杉醇是一种存在于紫杉烷类植物树皮和枝叶中的二萜烯类物质,因其阻碍肿瘤细胞微管活性,在G2/M期阻碍纺锤体的形成而抑制癌细胞的生长[5-7],而多西紫杉醇是一种半合成的紫杉醇衍生物。本研究基于上述认识,以前列腺癌细胞株LNCaP、PC-3和CWR22-rv1为研究对象,研究其经多西紫杉醇处理后磷酸化c-jun(phosphorylated c-jun,p-c-jun)的变化及与雄激素受体(Androgen Receptor,AR)的相互关系、p-c-jun及AR与前列腺癌细胞存活率的关系,以探讨多西紫杉醇治疗前列腺癌的分子机制。
1 材料与方法
1.1 细胞株和试剂
雄激素依赖型细胞株LNCaP和CWR22-rv1、非雄激素依赖的细胞株PC-3均购自中国科学院昆明动物研究所。脂质体2000、c-jun抗体、p-c-jun抗体均购自上海圣克鲁斯生物技术公司。AR抗体购自北京Upstate生物技术有限公司,PSA购自深圳Dako公司。辣根过氧化物酶标记的抗兔和抗鼠抗体均购自北京Sigma公司,化学发光(ECL)试剂盒购自上海Amersham公司。AP-1 luc购自上海promega公司。
1.2 方法
1.2.1 细胞培养 雄激素依赖型细胞株LNCaP和CWR22rv1细胞、非雄激素依赖的细胞株PC-3培养于含有10%胎牛血清和1%青霉素-链霉素RP⁃MI-1640培养基(GIBCO公司)中。37℃下于含5%CO2的条件下常规培养。细胞以0.25%胰蛋白酶消化传代,2~3 d传代1次。将5×106个/mL细胞接种于96孔板,每孔200 μL,贴壁生长后,分别以5 nM浓度紫杉醇处理细胞24和48 h,每种浓度设平行重复7孔,重复实验3次,并设立不加任何药物的空白对照组。
1.2.2 细胞存活率 细胞存活率用台酚蓝排除法直接观察。细胞接种在24孔版中,每孔接种细胞为2.5×104个。24 h后,细胞经5 nM的Doc处理24或48h。等量细胞沉淀和0.4%台盼蓝与磷酸盐缓冲液混合,用细胞计数板来计数活的细胞数量。
1.2.3 蛋白质印迹分析 细胞裂解后,用BCA蛋白浓度测定试剂盒测定蛋白浓度。电泳时,30μg全细胞裂解液用4%~12%SDS-PAGE分离,然后转移到硝酸纤维素膜上。置于含5%无脂肪的TBST缓冲液中,室温封闭1h。然后在封闭袋中加入鼠抗人c-Jun一抗(1:1 000)过夜孵育。隔日洗膜,加入辣根过氧化物酶酶标的羊抗鼠二抗(1:5 000)的封闭液,37℃振摇保温1~2h。洗膜后,使用ECL试剂发光、显影、定影。为了确保上样量一致,用β-actin作为对照。蛋白质印迹分离得到的蛋白质条带的密度用Bio-Rad Quality one-4.6.2凝胶成像仪分析完成。
1.2.4 细胞免疫荧光 细胞接种在4孔的细胞培养玻片中,分别以正常条件及暴露在5 nM Doc中培养48h。细胞用2%多聚甲醛固定10min,室温下用含0.1%Triton X-100的PBS处理15min,用含10%驴血清的PBS封闭30min,然后用单克隆p-c-jun一抗在4°C孵育过夜。隔日用Alexa 488染色1 h。阴性对照反应不加一抗。在奥林巴斯AX70显微镜和Nikon DS-U1数码彩色相机下观察细胞。
1.2.5 细胞转染 转染前24 h前列腺癌细胞(3×105个细胞/mL)接种到含10%热灭活胎牛血清RPMI的12孔培养板中。脂质体2000转染AR及c-jun。用AP-1 luc作为AP-1的示踪剂。孵育24 h后,加或不加Doc(5 nM)、双氢睾酮(DHT)(10 nM)或100 nM的12-O-十四烷酰佛波-13醋酸酯(TPA)(作为p-c-jun的化学诱导剂),继续培养24 h,收获细胞并裂解,进行荧光素酶活性分析。
1.2.6 实时定量PCR 细胞总的RNAs从经过Doc、二甲基亚砜治疗0、3和8d后的LINCaP、PC-3和CWR22-rv1细胞中抽提出来。前列腺细胞使用RNAeasy试剂盒(Promega公司),根据试剂盒的方法进行cDNA的制备、实时定量PCR(RT-PCR)。PSA引物序列:5'-AGGCCTT CCCTGTACACCAA-3'/5'-GTCTTGGCCTGGTCATTTC C-3',AR引物序列为:5'-GTACCTGTCAGCCCCTGAA C-3'/5'-GGAGAGCTGCTTTCGCTTAG-3',GAPDH引物序列为:5-CGA CCA CTT TGT CAA GCT CA-3/5-AGG GGT CTA CAT GGC AAC TG-3。PCR反应条件:95℃10 min,94℃ 1min,57℃ 1 min,72℃ 1 min,循环35次,72℃延伸10 min。
1.3 统计学分析
所得结果至少来自3次平行实验,用SPSS 11.0进行统计分析,计量资料用表示,P<0.05被认为具有统计学意义。
2 结果
2.1 Doc处理后p-c-jun的表达及细胞的存活率
结果表明Doc(5 nM)处理2 h后就可以诱导p-c-jun的表达,8h达到高峰。p-c-jun在CW22-rv1细胞系表达最高,LNCaP细胞系次之,PC-3细胞系表达最低(图1)。细胞免疫荧光分析也显示PC-3细胞的p-c-jun染色比LNCaP和CW22rv1细胞弱。细胞存活实验显示,Doc处理细胞后,CWR22-rv1的细胞存活率为40%,LNCaP细胞的细胞存活率为30%,PC-3细胞存活率为10%(图2)。结果提示p-c-jun蛋白的表达水平与细胞生存密切相关。转染了c-jun基因到PC-3细胞后,该细胞对多西紫杉醇的敏感性下降,细胞存活率上升为40%。共转染c-jun和AR基因,PC-3细胞对多西紫杉醇中度敏感,细胞存活率为30%(图3)。
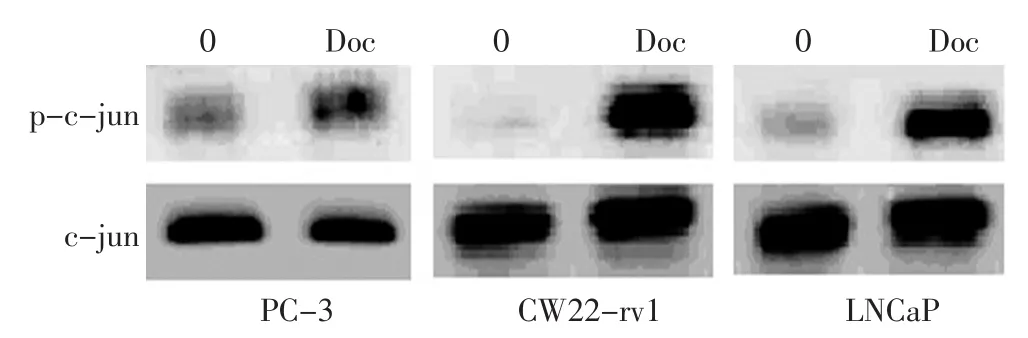
图1 三种前列腺癌细胞暴露于5 nM Doc培养0~30 dFigure 1 PC-3,CW22-rv1,and LNCaP cell lines treated with 5 nM Doc for 0 d to 30 d
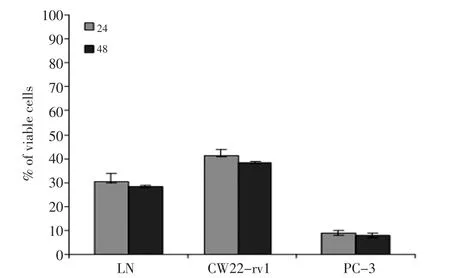
图2 三种细胞暴露于5 nM Doc培养24、48 h后存活率Figure 2 Percentage of viable cells in PC-3,CW22-rv1,and LNCaP af⁃ter exposure to 5 nM Doc for 24 and 48 h
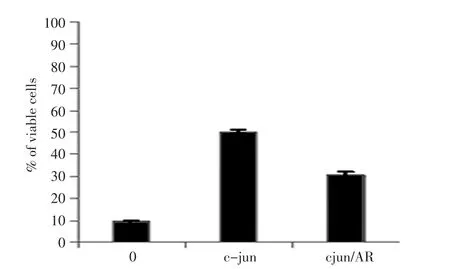
图3 PC-3细胞转染c-jun和AR基因后对Doc的敏感性Figure 3 Sensitivity to Doc in PC-3 cells transfected with c-jun and AR
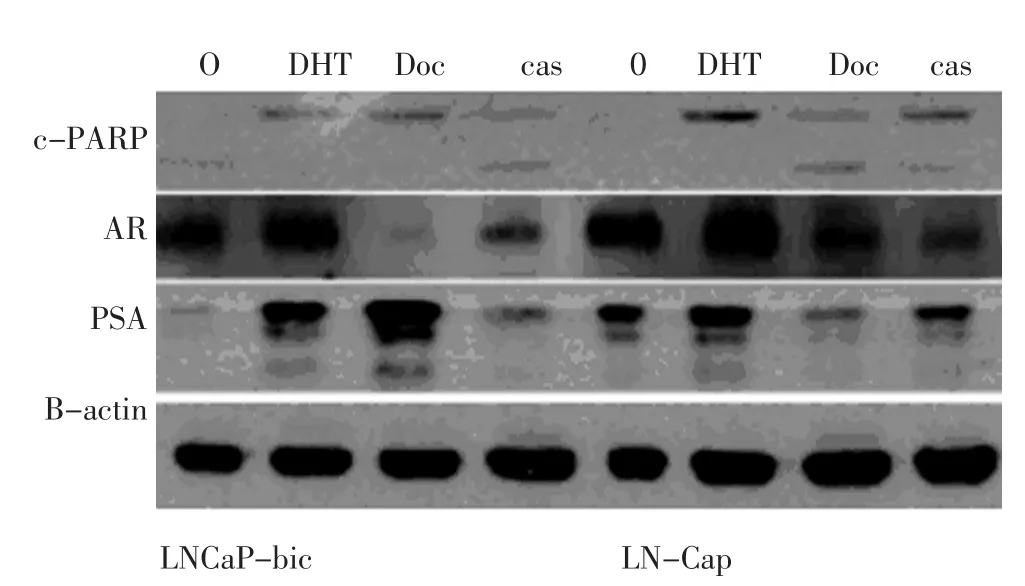
图4 LNCaP-bic及LNCaP细胞暴露于多西紫杉醇(Doc,5 nM),双氢睾酮(DHT,10 nM)或比卡鲁胺(cas,10μM)24 h后PSA、AR表达的变化Figure 4 Expression of PSA and AR in LNCaP-bic and LNCaP cells af⁃ter exposure to Doc(5 nM),DHT(10 nM),or cas(10 μM)for 24 h,as well as cells without Doc treatment(0 h)
2.2 Doc对LNCaP-bic的效应
LNCaP-bic是从含有1 μM比卡鲁胺培养液中培养9个月的LNCaP细胞中分离出来的细胞,与LNCaP细胞比较,LNCaP-bic经Doc处理后,其PSA蛋白水平显著增加,而AR蛋白表达水平却低(图4)。细胞存活实验表明,LNCaP-bic对Doc低度敏感,存活率为40%,与CW22-rv1对Doc的治疗反应类似(图5)。与父代LNCaP细胞相比,LNCaP-bic暴露于Doc后有着高水平的p-c-jun及抗凋亡能力。
2.3 细胞转染和PCR结果
PSA和ARE转染前列腺癌细胞LNCaP和LN⁃CaP-bic后,对Doc的反应活性增加,双氢睾酮单独治疗或与Doc联合治疗诱导了AR和PSA的反应活性升高。AP-1转染LNCaP和LNCaP-bic细胞后暴露于Doc、TPA、DHT或者DHT联合Doc的培养液中,发现双氢睾酮治疗后,LNCaP细胞的AP-1转录活性受抑制,但LNCaP-bic细胞更明显,Doc治疗后则表现为中度的转录活性。DHT联合Doc治疗后,引起LNCaP细胞的AP-1转录活性中度升高、LNCaP-bic细胞的AP-1转录活性明显升高。LNCaP和LNCaP-bic细胞经TPA处理后AP-1的转录活性均升高(图6)。实时定量PCR显示Doc治疗LNCaP细胞后第8d AR蛋白水平显著降低,却引起了AR的mRNA增加(图7)。

图5 四种细胞暴露于5 nM Doc培养24、48h后的细胞存活率Figure 5 Percentage of viable cells in PC-3,CW22-rv1,LNCaP,and LNCaP-bic cells after exposure to 5 nM Doc for 24 and 48 h

图6 AP-1转染LNCaP和LNCaP-bic细胞后,不同处理对AP-1的转录活性的影响Figure 6 Transcriptional activity of AP-1 after transfection with AP-1-luc and treatment with 5 nM Doc,10 nM DHT,or 10 nM TPA
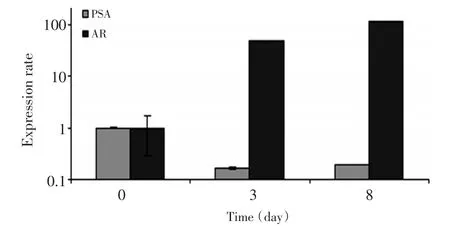
图7 Doc处理LNCaP细胞后AR蛋白水平显著降低,但AR mRNA表达增加(RT-PCR)Figure 7 Decreased expression of AR proteins in LNCaP cells after expo⁃sure to Doc;however,the relative mean AR mRNA expression was in⁃creased(measured by quantitative RT-PCR)
3 讨论
多数患者在内分泌治疗开始后的18个月左右进展为激素抵抗性前列腺癌(castration-resistant pros⁃tate cancer,CRPC),美国临床肿瘤学会及最近研究确立了多烯紫杉醇(docetaxel,taxotere,Doc)作为HRPC治疗的核心地位[6-7],已作为CRPC的一线化学治疗方案,并得到美国FDA的批准[8-9],但分子机制尚不清楚。
目前,在前列腺癌发生发展过程中多条信号通路表达异常,如高迁移率族蛋白1(HMGB1)基因[10]、二肽基肽酶(DDPⅣ)[11]、即刻早期基因(immediate early genes,IEGs)等[12],其中即刻早期基因组原癌基因,包括c-fos、c-jun以及c-myc等,其过度表达会促进肿瘤细胞恶性增殖且侵袭能力增强。作为原癌基金,c-Jun的活化总是与肿瘤细胞的恶性增殖有关[8]。由于磷酸化的c-jun即p-c-jun才具有活性,故本研究关注p-c-jun。
本实验中分别以雄激素依赖型细胞株LNCaP和CWR22-rv1、非雄激素依赖的细胞株PC-3作为研究对象,Doc处理后,发现非雄激素依赖的细胞株PC-3的敏感性最高,细胞的存活率为10%,但p-c-jun最低;雄激素依赖型细胞株LNCaP和CWR22-rv1分别为30%和40%,p-c-jun的表达在LNCaP细胞系次之、CW22-rv1细胞系最高。免疫荧光分析显示PC-3细胞对应的印迹比LNCaP和CW22rv1细胞相比要弱。转染了c-jun基因到PC-3细胞后,该细胞对多烯紫杉醇的敏感性下降,细胞存活率上升为40%。共转染c-jun和AR基因,PC-3细胞对多烯紫杉醇中度敏感,细胞存活率为30%。延长暴露在Doc中的时间至15 d,p-c-jun维持在一个比较高的水平。LN⁃CaP-bic的实验也显示LNCaP-bic暴露于Doc后有着高水平的p-c-jun及抗凋亡能力。结果表明p-c-jun蛋白的表达水平与细胞生存密切相关,而转录因子p-c-jun表达水平与细胞对Doc的敏感性呈负相关。
雄激素受体(androgen receptor,AR)作为雄激素功能的介导者,其突变、异常扩增、表达的异质性与前列腺癌的发生、发展、恶化密切相关,抑制AR的表达和功能便成为治疗前列腺癌的有效方法之一。已有的前列腺癌细胞系,如PC-3细胞、CW22-rv1细胞等均能够在激素剥夺的环境下生长[13]。目前仅有LNCaP细胞系保留了人前列腺癌的激素依赖性的特征,能够分泌PSA、PSMA及雄激素受体,能够在具有雄激素样活性的甾体激素的刺激下生长。
LNCaP细胞系依次进行多西紫杉醇(Doc,5 nM),双氢睾酮(DHT,10 nM)或比卡鲁胺(bic,10 μM)24h或未经处理,结果表明AR的表达在DHT处理后较未经处理增加,其他情况下是降低的,相应的PSA也有同样改变。进一步对LNCaP-bic进行研究发现,与LNCaP细胞比较,LNCaP-bic经Doc处理后,其PSA蛋白水平显著增加,而AR蛋白表达水平却降低,细胞存活试验表明,LNCaP-bic对Doc低度敏感,成活率为40%,与CW22-rv1对Doc的治疗反应类似。这证明AR的表达与LNCaP细胞对Doc的反应正相关,AR可能是Doc有效治疗的关键分子靶点。
为进一步明确AR的表达、作用及其机制,用PSA和AR转染LNCaP和LNCaP-bic细胞,结果显示二者对Doc的反应活性均增加,双氢睾酮单独治疗或与Doc联合治疗诱导了AR和PSA的升高。AP-1转染LNCaP和LNCaP-bic细胞后暴露于Doc、TPA、DHT或DHT联合Doc,结果表明DHT治疗后,LNCaP细胞的AP-1转录活性受抑制,但LNCaP-bic细胞更明显;Doc治疗后则表现为中度的转录活性。DHT联合Doc治疗后,引起LNCaP细胞的AP-1转录活性中度升高、LNCaP-bic细胞的AP-1转录活性明显升高。LN⁃CaP和LNCaP-bic细胞经TPA处理后AP-1的转录活性均升高。实时定量PCR显示Doc处理LNCaP细胞后第8天AR蛋白水平显著降低,却引起了AR的mRNA增加(图3)。进一步证实AR的表达与前列腺癌细胞对Doc的治疗敏感性正相关,也说明AR的表达对p-c-jun是负向调节的。
本研究中荧光素酶实验显示AR和c-jun磷酸化间有直接相关性。PC-3细胞是雄激素非依赖性细胞,不表达AR,对Doc最敏感。转染了c-jun基因后,该细胞对多烯紫杉醇的敏感性下降,细胞存活率由10%上升为40%。共转染c-jun和AR基因,PC-3细胞对多烯紫杉醇中度敏感,细胞存活率为30%。延长暴露在Doc中的时间至15天,p-c-jun维持在一个比较高的水平。这说明虽然AR诱导p-c-jun维持一个较高的水平,但降低了p-c-jun对细胞的保护性作用,提高了对Doc的治疗反应。另外,LNCaP作为激素依赖性细胞,表达AR。实验显示,Doc治疗后p-c-jun会引起LNCaP细胞的保护性反应,有研究认为其机制是NF-КB[14]。而LNCaP-bic细胞实验却显示长期缺乏、切除雄激素可以增加AR活性,而AR蛋白水平是降低的。
为进一步明确p-c-jun与AR的相互关系及作用进行细胞转染实验。用PSA和AR转染前列腺癌细胞LNCaP和LNCaP-bic后,二者对Doc的反应活性均增加。AP-1转染LNCaP和LNCaP-bic细胞后,经DHT刺激,LNCaP细胞的AP-1转录活性受抑制,但LNCaP-bic细胞更明显,AR的表达降低;Doc处理后则表现为中度的转录活性,AR的表达中度升高。DHT联合Doc处理后,LNCaP细胞的AP-1转录活性中度升高、LNCaP-bic细胞的AP-1转录活性明显升高。作为p-c-jun的诱导剂,TPA处理LNCaP和LN⁃CaP-bic细胞后AP-1的转录活性均升高。实时定量PCR显示Doc处理LNCaP细胞后第8天AR蛋白水平显著降低,却引起了AR的mRNA增加。上述结果表明p-c-jun是LNCaP对Doc的保护性因子,而AR与p-c-jun是相互影响的,AR对p-c-jun有负向调节的作用,AR受DHT的调节,与已有报道结论类似[15]。其机制可能是c-Jun对转录进行调控是通过c-jun基因编码核苷酸切除修复体系中的特殊成分,在转录诱导的DNA修复中起作用,以保护细胞免受细胞毒物影响[16]。
前列腺癌的发病率不断上升,其治疗有许多难题,尤其对CRPC的治疗,仍无理想的方案。本研究通过对前列腺癌细胞株LNCaP、PC-3和CW22-rv1经Doc处理后细胞株的生存情况、AR及p-c-jun的表达情况及其与细胞生存的关系研究,发现p-c-jun降低了前列腺癌细胞株对多西紫杉醇的反应,而AR可以增加前列腺癌细胞株对多西紫杉醇的反应,AR上调抑制c-jun/p-c-jun的转录活性以降低前列腺癌对Doc的抵抗性可能是Doc治疗前列腺癌的机制之一,通过雄激素对AR表达的调节,有望成为今后治疗CRPC的方向。
1 Jemal A,Siegel R,Ward E,et al.Thun MJ.Cancer statistics[J].CA Cancer J Clin,2007,7(57):43–46.
2 叶定伟,李长岭.前列腺癌发病趋势的回顾和展望[J].中国癌症杂志,2007,17(3):177-180.
3 周智恩,李汉忠,严维刚.雄激素受体蛋白表达及其基因获得/缺失与前列腺癌预后的相关性[J].基础医学与临床,2010,30(8):857-861.
4 Lopergolo A,Zaffaroni N.Biomolecular markers of outcome pre⁃diction in prostate cancer[J].Cancer,2009,115(13 Suppl):3058-3067.
5 刘 征,杨为民,叶章群,等.紫杉醇联合肿瘤坏死因子相关凋亡诱导配体对前列腺癌细胞的抑制作用[J].华中科技大学学报(医学版),2007,36(3):352-354.
6 Jiang J,Huang H.Targeting the Androgen Receptor by Taxol in Castration-Resistant Prostate Cancer[J].Mol Cell Pharmacol,2010,2(1):1-5.
7 Petrylak DP,Tangen CM,Hussain MH,et al.Docetaxel and estra⁃mustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer[J].N Engl J Med,2004,351(15):1513-1520.
8 McKeage K.Docetaxel:a review of its use for the first-line treat⁃ment of advanced castration-resistant prostate cancer[J].Drugs,2012,72(11):1559-1577.
9 Shapiro D,Tareen B.Current and emerging treatments in the man⁃agement of castration-resistant prostate cancer[J].Curr Drug Tar⁃gets,2012,12(7):951-964.
10 宋登新,陈安民,郭风劲,等.siRNA抑制人高迁移率族蛋白1表达对前列腺癌PC-3增殖的影响[J].中国肿瘤临床,2008,35(6):339-343.
11 刘荣华,王世宣,马湘一,等.二肽基肽酶对前列腺癌细胞系1E8侵袭转移的影响[J].中国肿瘤临床,2008,35(17):1003-1006.
12 Pfahl M.Nuclear receptor/Ap-1 interaction[J].Endocr Rev,1993,14(5):651-658.
13 Hemmerlein B,Weseloh RM,Mello de Queiroz F,et a1.0verexpres⁃sion of Eagl potassium channels in clinical tumours[J].Mol Cancer,2006,5(1):41-54.
14 O'Neill A J,Prencipe M,Dowling C,et al.Characterisation and ma⁃nipulation of docetaxel resistant prostate cancer cell lines[J].Molecu⁃lar Cancer,2011,10:126
15 Lamont KR,Tindall DJ.Androgen regulation of gene expression[J].Adv Cancer Res,2010,107:137-162.
16 Potapova O,Basu S,Mercola D,et al.Protective role for c-Jun in the cellular response to DNA damage[J].J Biol Chem,2001,276(30):28546-28553.

