结直肠腺癌组织中细丝蛋白A的表达变化及意义
马红献,刘勤英,史建伟,张利众,李 中
(1涞源县医院,河北保定074300;2河北大学附属医院;3保定市第一医院)
结直肠癌是常见的消化道恶性肿瘤,近年来发病率呈上升趋势,5年生存率为50%~60%[1]。患者生存预后不佳的重要原因是肿瘤的局部复发和远处转移。细丝蛋白A(FLNa)是细丝蛋白家族的重要成员,参与调节细胞的增殖和迁移,与细胞骨架形成、细胞形状动态改变以及抵抗细胞外破坏性机械压力有关[2]。近期我们采用免疫组化法检测了结直肠腺癌组织及正常黏膜组织中FLNa蛋白的表达情况,并分析FLNa蛋白表达水平与临床病理参数之间的相关性,探讨其在结直肠癌患者预后中的价值。
1 资料与方法
1.1 临床资料 46例标本均随机选取自河北大学附属医院2005年1月~2006年12月的结直肠癌手术患者的蜡块标本。其中男27例,女19例;年龄34~80岁,平均58岁。癌组织取自癌灶中心处,正常黏膜组织取自距癌灶边缘至少10cm处。全部入组病例均经病理检查确诊,且其他器官无原发肿瘤,无放、化疗及免疫治疗史,均有完整的临床及随访资料。随访截止日期为2011年7月。
1.2 FLNa蛋白表达检测方法 应用免疫组化SP法检测结直肠腺癌组织及正常黏膜组织中FLNa蛋白的表达情况,试剂盒购于中杉金桥公司,单克隆兔抗人FLNa一抗购自Epitomics公司。DAB显色剂购自Tiangen公司。严格按免疫组化试剂盒说明书进行操作,PBS溶液取代一抗着色作为阴性对照,正常人子宫组织染色作为阳性对照。
1.3 免疫组化结果判断 FLNa蛋白分布于细胞胞质。于高倍镜下选取5个视野,每个视野观察约200个细胞,统计细胞阳性率:着色颗粒分为不明显、稀疏、一定量和弥漫性等4种级别;着色程度分淡染、淡黄、棕黄和棕褐。对每张切片的阳性率及染色强度进行综合分析:阳性细胞<25%,染色较淡,无明显着色颗粒者判定为“-”;阳性细胞在25%~<50%,染色淡,着色颗粒稀疏者为“+”;阳性细胞在50%~75%,染色棕黄,具有一定量着色颗粒者定为“++”;阳性细胞数≥75%,染色棕褐,着色颗粒弥漫者定为“+++”。由2名高资质临床病理医师共同阅片,确定最终判定结果。
1.4 统计学方法 采用SPSS13.0统计软件。FLNa在正常组织和癌组织表达情况比较采用χ2检验,多因素分析采用Cox回归模型,FLNa表达阴性与阳性者生存分析采用Kaplan-Meier法,P≤0.05为差异有统计学意义。
2 结果
FLNa蛋白在结直肠腺癌组织中表达-为24例,+为12例,++为10例,阳性率为47.8%,正常组织中﹣为4例,+为5例,++为13例,+++为24例,阳性率为92.3%,两组FLNa蛋白表达阳性率比较,P=0.000(χ2=41.559),见图1。将患者年龄、性别、肿瘤发生部位(结肠与直肠)、肿瘤侵润深度(侵及浆膜与未侵及浆膜)、淋巴结转移情况(有、无淋巴结转移)及FLNa表达(阳性与阴性)等因素引入Cox回归模型进行多因素分析,结果显示淋巴结转移情况、肿瘤浸润深度及FLNa表达是影响结直肠腺癌术后患者预后的独立因素(表1)。FLNa表达阳性与阴性者的中位生存时间分别为63、26个月,FLNa蛋白阴性表达者的死亡风险是阳性表达者的3.856倍,其95%的可信区间为7.326~19.421。两组生存率的Log-rank检验提示差异有有统计学意义(P=0.000),生存曲线见图2。
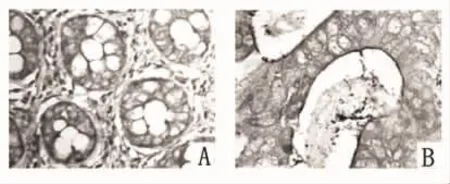
图1 结直肠腺癌组织及正常组织中FLNa蛋白的表达(SP×200)
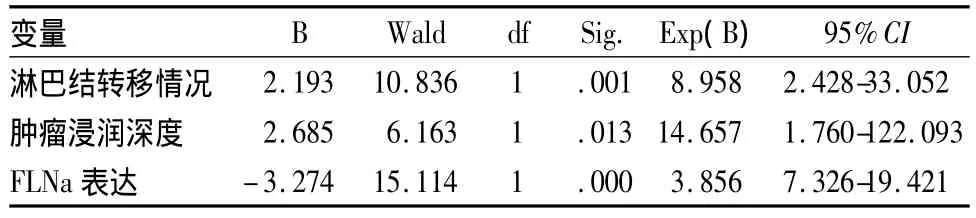
表1 46例患者的多因素分析
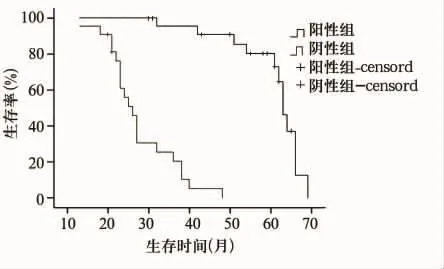
图2 FLNa表达情况与生存期分析
3 讨论
FLNa蛋白主要分布于细胞胞质,其基因结构保守,广泛表达于哺乳动物的组织器官中,对组织器官形成发育具有重要功能。FLNa蛋白二聚体亚基的长度约80 nm、相对分子质量约280 kD,两条相同的多肽链于羧基端相连接,形成的“V”型同源二聚体具有生物学功能。FLNa蛋白的棒状结构域中含有多重β-片层结构,该结构为多种具有重要功能的蛋白质间的相互作用提供了平台,并且其中的多数蛋白质是细胞信号分子的膜受体,参与调节细胞的增殖、迁徙、黏附等多种生物学行为[2]。
目前有关FLNa与恶性肿瘤发生发展相关性的研究较少。史建伟等[3~5]通过研究FLNa蛋白在60例结直肠癌患者的癌组织及其正常结直肠黏膜组织的表达情况,并结合临床资料进行分析,发现FLNa蛋白在结直肠腺癌组织中的阳性表达率为50.0%,而在正常结直肠黏膜组织的阳性率为91.7%,差异有统计学意义。FLNa的低表达与结直肠腺癌的肝转移、肠壁的浸润深度、淋巴结的转移相关;经脂质体成功将FLNa cDNA转染人结肠癌SW480细胞,过表达FLNa基因后发现,FLNa能够抑制SW480细胞的体内、体外侵袭能力,其作用机制与MMP-9的表达水平降低有关。本研究亦发现,癌组织中的FLNa蛋白表达明显低于正常黏膜组织,进一步的多因素分析发现FLNa是结直肠腺癌患者术后生存的独立影响因素,生存分析表明FLNa蛋白低表达患者的生存时间明显短于FLNa蛋白高表达患者。
有关FLNa抑癌的机制目前尚不完全清楚。Fiori等[6]研究发现,与表达FLNa的 M2A7细胞相比,受表皮生长因子(EGF)刺激后,缺失FLNa的M2细胞中表皮生长因子受体酪氨酸的泛素化水平较低。进一步深入研究证实,FLNa蛋白的缺乏可影响泛素连接酶c-Cb1链与表皮生长因子受体相互作用,细胞中抗表皮生长因子诱导的表皮生长因子受体降解受到明显的抑制,但在表达FLNa的细胞中表皮生长因子受体的降解却非常活跃,因此推测FLNa可能通过下调表皮生长因子受体的活性,对肿瘤细胞的增殖具有抑制作用。Zhu等[7]研究发现,FLNa通过Ras-GRF1参与调节Ras/ERK信号通路,下调细胞内基质金属蛋白酶-9的含量,抑制其对细胞外基质的降解能力,最终阻遏肿瘤细胞的黏附和迁移。研究[8]还发现FLNa能够与Smads蛋白家族成员相互结合,共同调节转化生长因子-β(TGF-β)信号,阻遏肿瘤细胞的迁移,相反,在不表达FLNa的肿瘤细胞中则不存在TGF-β信号。另外,酵母双杂交实验和细胞信号转导通路的多项研究还证实,FLNa特异性地与G蛋白耦联受体(钙受体和多巴胺受体)、小 GTP结合蛋白(CDC42,Rac和Rho)以及其下游效应分子(SEK1)结合,共同调节肿瘤的发生、发展。
综上所述,FLNa与结直肠腺癌的发生、发展密切相关,且可作为预后判断的重要指标,但FLNa如何发挥其抑癌生物学效应还有待进一步深入研究。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96.
[2]Nakamura F,Osbiorn TM,Hartemink CA,et al.Structure basis of filamin A functions[J].J Cell Biol,2007,179(5):1011-1025.
[3]史建伟,王贵英,张鸿滨,等.细丝蛋白A在结直肠腺癌中的特异性表达[J].中国肿瘤临床,2010,37(23):1342-1343.
[4]史建伟,于跃明,王士杰,等.细丝蛋白A抑制人结肠癌SW480细胞体外侵袭转移能力[J].基础医学与临床,2011,31(9):1000-1005.
[5]史建伟,于跃明,王士杰,等.细丝蛋白A抑制荷人结肠癌细胞SW480 裸鼠移植瘤的生长[J].肿瘤,2011,31(8):701-706.
[6]Fiori JL,Zhu TN,O'Connell MP,et al.Filamin A modulates kinase activation and intracellular trafficking of epidermal growth factor receptors in human melanoma cells[J].Endocrinology,2009,150(6):2551-2560.
[7]Zhu TN,He HJ,Kole S,et al.Filamin A-mediated down-regulation of the exchange factor ras-GRF1 correlates with decreased matrix metalloproteinase-9 expression in human melanoma cells[J].J Biol Chem,2007,282(20):14816-14826.
[8]Feng Y,Walsh CA.The many faces of filamin:a versatile molecular scaffold for cell motility and signalling[J].Nat Cell Biol,2004,6(11):1034-1038.

