微流控芯片上的精子自然优选
钟志敏 王维 梁广铁 周小棉 刘大渔
据世界卫生组织(WHO)评估,每7对夫妇中约有1对存在生殖障碍。我国近期调查显示,育龄夫妇中不孕症者比例约为10%,且发病率呈上升趋势。近年来,辅助生殖技术(Assisted Reproductive Technology,ART)的应用使得不育夫妇实现妊娠生子的愿望,由不育引发的相关问题也随之得到解决。对于最常用的ART,如试管婴儿(In vitro fertilization,IVF)和卵细胞浆内单精子注射(Intracytoplasmic Sperm Injection,ICSI),获取高质量精子是保证胚胎质量的关键因素。目前,常用的精子分选方法如上游法和密度梯度离心法,具有样品需求量大、分选时间长、操作繁琐以及易对精子DNA造成损伤[1]等不足。因此,现实医疗工作中迫切需要一种更为简便高效的精子分选技术。
微流控技术的发展为少量细胞样品的高效分选提供了一种便利的解决方案。近年来,一些研究者在微流控芯片上的精子分选[2~3]。例如,Chen 等[4~5]利用精子逆液流方向游动的特性在微流控芯片上对精子进行了分选;王维等[6~7]发展了基于层流的微流控芯片精子分选技术;丘天等[8]对微流控芯片筛选条件进行了优化。上述微流控芯片精子分选方法均利用微流体特性,以无损伤操作实现精子分选,因而在分选同时保证了精子的活力。此外,微流控芯片因为具有操作简便以及适合于处理少量样品的优点,非常适合于小体积精液样品的处理。
在前述工作基础上,本研究发展了一种基于微流控芯片的精子自然优选方法。该方法借鉴了精子的体内分选机制,即利用宫颈粘液的阻滞作用实现精子的优选。研究利用自行设计加工的微流控芯片,模拟生理状态下精子与宫颈粘液相互作用实现了精子分选。与之前报导的精子分选方法相比,这种基于精子-宫颈粘液相互作用的芯片精子优选方法不仅操作简便,而且分选效率更高。
1 实验部分
1.1 精液与宫颈粘液的来源
研究所用的35例精液样本全部来自我院生殖不孕专科就诊的男性患者,患者夫妇同居一年以上,有正常的性生活,未采取任何避孕措施,未能成功怀孕,且女方没有任何影响受孕的器质性疾病。患者通过手淫方式留取精液样本,待精液液化后,在30 min内通过计算机辅助精子分析系统(computer-assisted semen analysis,CASA)完成精液各项参数的检测。
研究使用的宫颈粘液样本全部来自我院生殖不孕专科就诊的女性患者,经患者知情同意后于排卵期采集。采集后立即使用世界卫生组织《人类精液与精子-宫颈粘液相互作用实验室检验手册》第五版推荐的moghissi设计系统[9]对宫颈粘液的成丝性、羊齿化结晶程度、粘稠度和pH值等有关指标进行评分,满分为15分。高于10分表明宫颈粘液质量较好,利于精子穿透;低于10分则表明不利于精子穿透。选取评分高于10分的宫颈粘液用于此研究。
1.2 仪器和试剂
精子洗液PureSperm Wash购自瑞典NidaCon International AB公司,计算机辅助精子分析系统(CASA)购自西班牙Microptic S.L.公司,聚二甲基硅氧烷(polydimethylsiloxane,PDMS)购自美国Dow Corning公司,SU-8 3025光刻胶购自美国Microchem公司。精子DNA完整性检测试剂盒(包括预处理玻片,带有低溶点琼脂的微量离心管,带有变性液的试管,裂解缓冲液)购自美国Halosperm公司。
1.3 微流控芯片的设计与构建
使用制图软件CorelDraw画出微流控芯片的结构图,采用软刻蚀工艺制造如图1a所示的微流控芯片[10]。该芯片由顶部的PDMS层与底部的载玻片封接而成,芯片尺寸为76 mm×34 mm。在PDMS层底面刻蚀有图1b所示的流体通道,其中精液加样池的直径为4 mm;宫颈粘液分选通道长20 mm,宽6 mm,深度为0.02 mm,以保证只有高活动力精子单层通过分选通道;精子回收检测池是一个不规则倒梨形结构,最宽处为18 mm,在分选通道与回收检测池之间有密集排列的微柱阵列,便于分隔宫颈粘液与精子培养液。
1.4 微流控芯片精子优选
微流体通道首先注入精子洗液,润洗5 min。在宫颈粘液分选通道中注入5μL宫颈粘液,精子回收检测池注入20μL精子培养液,使池底形成约0.04 mm的一薄层液体,以便于CASA检测。最后在精液加样池中加入10μL液化精液。完成加样的芯片贴上PDMS盖片,防止液体的蒸发。把芯片置于36.5℃温箱中15 min。在正常生理状态下,精子与宫颈粘液相互作用,质量好的精子能够穿透宫颈粘液分选通道进入到精子回收检测池。最后,吸取回收池精子进行涂片,采用WHO推荐的改良巴氏染色法染色分析精子形态并检测精子的DNA损伤情况。
1.5 上游法优选精子
用世界卫生组织《人类精液与精子-宫颈粘液相互作用实验室检验手册》第五版中推荐的上游法:取一灭菌试管加入精液1.0 mL 然后在精子液面上小心加入精子培养液1.5 mL,37℃ CO2培养箱内30°~45°倾斜上游1 h,然后小心取出,用试管吸取上层白色略浊液体,500×g 离心5 min,去上清,回收优选后精子用于精子常规分析和DNA 完整性分析。
1.6 精子分析
使用CASA系统对分选精子的多项参数进行检测,包括活力精子百分比,精子直线运动速度(straight-line velocity,VSL),平均路径速度(average path velocity,VAP)和前向性(straightness,STR)。
同一份精液标本分别使用微流控芯片和上游法进行优选,优选后的精子使用CASA系统进行各项参数测定,同时涂片,采用改良巴氏染色法染色观察精子形态并计算正常形态精子百分比。
精子DNA 完整性测定采用染色质扩散试验(sperm chromatin dispersion test,SCD)方法。按照Halosperm试剂盒操作说明将精液标本置于包被琼脂糖胶的预处理玻片上, 然后融合到低熔点的琼脂糖凝胶中。包埋镜子首先用酸处理, 使精子DNA变性, 然后用裂解液除去大部分核内蛋白。在没有大量DNA断裂碎片情况下的精子, 会呈现DNA 环由核向外扩散产生晕环, 而带有DNA 碎片的精子核状体不出现晕环或晕环很小。计算每1000个精子中有DNA 损伤的精子数, 计算损伤百分率。
1.7 统计学分析
采用统计软件SPSS18.0进行统计学分析,所测定的各项指标数据均为正态分布,采用±s表示。芯片法和上游法的比较采用单因素的方差分析,P<0.05认为有统计学意义。
2 结果
上游法最小精液样品量要求不少于1.0 mL,分选时间为60 min。芯片法可以处理的最小样品量为10μL,分选在15 min内完成。35例精液样本的分选结果显示:上游法的精子回收率为19.39±7.42%,而芯片法的精子回收率约为1%左右。
与原始样品相比,精液样本经过上游法和芯片法分选后精子正常形态、活力精子、前向性精子以及DNA完整精子百分比均有显著提升(表1,图2),各参数的变化差异有统计学意义(P <0.01)。同时,两种方法分选后精子平均直线运动速度(VSL)和平均轨迹速度(VAP) 差异有统计学意义(P <0.01)。
表1 使用上游法和芯片法处理后精子各参数的变化(±s,n=30)Table 1 Sperm parameters detected before and after the swinning-up and microchip treatments(±s,n=30)
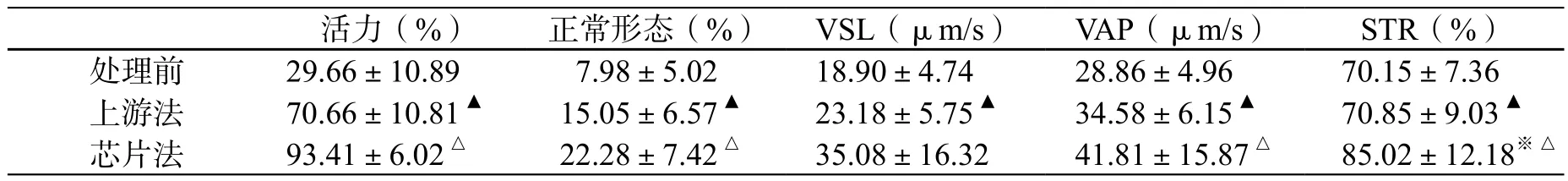
表1 使用上游法和芯片法处理后精子各参数的变化(±s,n=30)Table 1 Sperm parameters detected before and after the swinning-up and microchip treatments(±s,n=30)
注:※芯片法与处理前比较,均是P<0.01,△芯片法与上游法比较,P<0.05;▲上游法与处理前比较,均是P<0.01。
活力(%) 正常形态(%) VSL(μm/s) VAP(μm/s) STR(%)处理前 29.66±10.89 7.98±5.02 18.90±4.74 28.86±4.96 70.15±7.36上游法 70.66±10.81▲ 15.05±6.57▲ 23.18±5.75▲ 34.58±6.15▲ 70.85±9.03▲芯片法 93.41±6.02△ 22.28±7.42△ 35.08±16.32 41.81±15.87△ 85.02±12.18※△

图1 基于精子与宫颈粘液相互作用的精子优选图Figure 1 Schematic representation of sperm sorting using the sperm-cervical mucus interaction
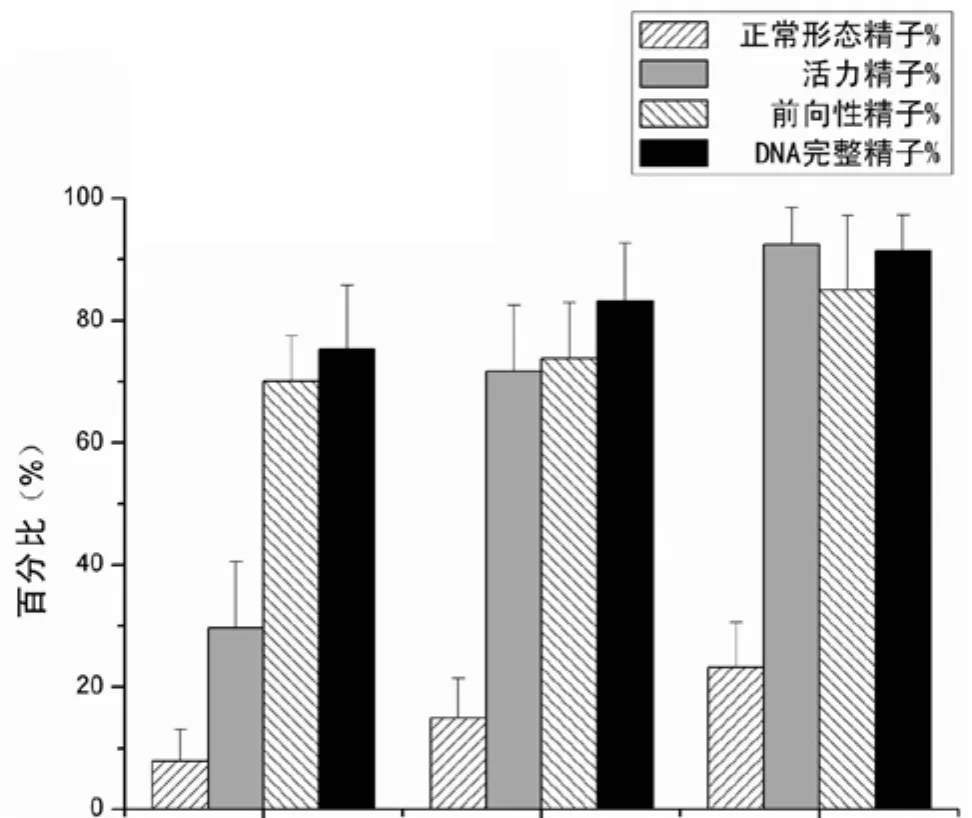
图2 上游法、芯片法分选精子与分选前精子正常形态、活力精子、前向性精子以及DNA完整精子百分比的比较Figure 2 Comparison of percentages of sperms with normal morphology, high-motility, straighness and DNA integrity before and after sperm sorting
与上游法相比较,芯片法分选精子在正常形态、活力精子、前向性精子、DNA完整精子比率以及VAP和STR方面差异有统计学意义(P<0.05)。微流控芯片法与上游法比较,VSL变化差异无统计学意义(图3)。

图3 上游法、芯片法分选精子与分选前精子平均直线运动速度(VSL)和平均轨迹速度(VAP)的比较Figure 3 Comparison of VSL and VAP of sperms detected before and after the sorting
3 讨论
自然状态下,女性生殖道内具有精子优选机制,与宫颈粘液接触的精子会沿着宫颈粘液中的粘蛋白向前游动。由于宫颈粘液具有一定的黏度,只有高活力的精子才能克服粘液的阻滞作用进入宫腔,而低活力精子、白细胞以及上皮细胞等成分则被保留在宫颈粘液中。生理状态下到达子宫颈隐窝的精子被认为是有受精潜能的精子,这些精子的形态被认为是判断精子正常形态的标准,其与各项生育指标包括体内、体外妊娠率都有良好的相关性,对判断生育的预后非常有用[10]。同样,高质量精子的获得是人工辅助生殖技术的关键环节。临床工作中使用不同类型的精子优选方法以获得高活力精子。这些方法或是依据精子的游动速度,或是依赖于精子的密度进行分选。总的看来,现有精子分选方法所使用的分选机制与生理状态下精子的优选过程相差较远,因而分选效果相比体内情况尚有差距。为解决上述问题,本研究发展了一种基于微流控芯片的精子自然优选方法。实验在分选通道内填充宫颈粘液,模拟子宫颈管内的精子筛选机制通过粘液对于精子的运动阻滞效应实现精子优选。精液加样池中的高质量精子能够穿透宫颈粘液分选通道进入到精子回收检测池,而低活力精子、白细胞以及上皮细胞等成分则被保留在宫颈粘液中。此外,回收池中的精子使用CASA系统在线分析,不仅缩短了操作时间,也减少了转移和离心过程中可能造成的机械性和氧自由基引发的损伤。
与上游法相比较,芯片法分选精子的回收率要低很多,但活力提升非常显著(70.66% vs 93.41%)。该结果可能是因为芯片法缩短了分选时间,因而更好地保持了精子活力有关。除精子活力外,正常形态精子比例亦是评价分选效果的主要指标。我们在实验中观察到在某些畸形精子虽然具有较快的游动速度,但其在宫颈粘液中无法保持直线前向运动,因而无法越过宫颈粘液的屏障。如单纯依靠精子泳动速度,这部分精子是难以被筛除掉的。由于宫颈粘液的阻滞分选效应,芯片法获得正常形态精子百分率(22.28%)显著高于上游法(15.05%)。相应地,这些精子的VSL,VAP及STR也得到改善。这些分选的高质量精子对于提高IVF尤其是ICSI的成功率将有明显的帮助。
与传统检测方法相比, 精子DNA 完整性是反映男性生育力的另一个重要指标[11]。离体环境中,精子接受的许多不良刺激可能会造成精子的机械性损伤和氧自由基增加,导致精子过氧化损伤,破坏精子DNA 完整性。本实验使用的芯片精子分选方法尽量模拟生理条件,且有效缩短了分选时间,这些均有效减少了精子DNA损伤。使用本研究方法优选出来的精子的正常形态百分率为22.28±7.42%,这一数值与从健康夫妻性交后的子宫颈隐窝精子的正常形态数取得的值30%尚有差距。究其原因,可能是由于分选通道的长度没有达到女性子宫颈的长度3 cm有关,我们将针对该问题进行进一步改进。
4 结论
本研究发展了一种基于微流控芯片的精子分选方法,利用体内精子分选机制实现高活力精子的优选。这种芯片分选方法具有操作简便和低损伤性的优势,有希望为成为一种精子优选的有力工具。
[1] Schulte R T, Chung Y K, Ohl D A, et al. Microfluidic sperm sorting device provides a novel method for selecting motile sperm with higher DNA integrity[J]. Fertility and Sterility,2007, 88(suppl 1): S76.
[2] Schuster T G, Cho B, Keller L M, et al. Isolation of motile spermatozoa from semen samples using microfluidics[J].Reprod Biomed Online, 2003, 7(1): 75-81.
[3] Cho B S, Schuster T G, Zhu X, et al. Passively driven integrated microfluidic system for separation of motile sperm[J]. Anal Chem, 2003, 75(7): 1671-1675.
[4] Seo D B, Agca Y, Feng Z C, et al. Development of sorting,aligning, and orienting motile sperm using microfluidic device operated by hydrostatic pressure[J]. Microfluid Nanofluid, 2007, 3: 561-570.
[5] Chen Y A, Huang Z W, Tsai F H, et al. Analysis of sperm concentration and motility in a microfluidic device[J].Microfluid Nanofluid, 2011, 10: 59-67.
[6] 王维, 黎维生, 彭娅娅, 等. 微流控芯片在精子分选中的应用[J]. 中华检验医学杂志, 2009, 32(8): 920-923.
[7] 王维, 梁广铁, 彭娅娅, 等. 微流控芯片精子分选法对精子常规参数及DNA完整性的影响[J]. 中华男科学杂志, 2011,17(4): 301-304.
[8] 丘天, 李卓琦, 马睿, 等. 用于精子活力筛选的微流控芯片设计与优化[J]. 中华检验医学杂志, 2010, 33(11): 1061-1065.
[9] 世界卫生组织. 人类精液检查与处理实验室手册[M]. 第五版. 北京: 人民卫生出版社, 2011: 45-46.
[10] 林炳承, 秦建华. 图解微流控芯片实验室[M]. 北京: 科学出版社, 2008.
[11] 吴永明, 夏欣一, 黄宇烽. 精子DNA完整性检测技术研究进展[J]. 中华男科学杂志, 2006, 12(8): 737-741.

