冬枣采后青腐病病原菌的分离、鉴定及控制
郭东起,侯旭杰,*
(1.塔里木大学生命科学学院,新疆阿拉尔843300;2.新疆特色农畜产品加工重点实验室,新疆阿拉尔843300)
冬枣是新疆环塔里木盆地近几年种植的晚熟鲜食品种,以其丰富的营养,优良的品质受到消费者的青睐,由于冬枣含水量高,皮薄肉脆,极易受机械损伤和微生物侵染而腐烂变质,故不耐贮运,冬枣贮藏期的侵染性病害主要有浆胞病、霉腐病、果柄基腐病等[1-2],霉腐病病原菌以青霉菌、根霉为主,青霉菌引起的霉腐病称青腐病,其症状是,受害冬枣为青绿色斑,圆形或不规则形状,用手触压病斑表皮为湿润状。病部果肉组织为褐色或黑褐色,发病后期病部表面产生青绿色的霉层,病果软腐或溃烂,对新疆冬枣采后贮藏品质危害严重。为此,在2010~2011年,对新疆冬枣在贮藏过程中引起腐烂的青霉菌进行了分离与纯化,获得1株典型致病菌,并对其进行鉴定,探讨了其生物学特性,旨在为综合防治冬枣采后贮藏中青腐病提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂
葡萄糖、蔗糖、乳糖、D-甘露醇、麦芽糖、NH4NO3、KNO3、(NH3)2SO4、NH3Cl、NaNO3等,以上试剂为分析纯。
1.1.2 培养基
蔡氏培养基:K2HPO41.00g,KCl0.5g,MgSO4·7H2O 0.5g,FeSO40.01g,琼脂粉 20.00g,无菌蒸馏水 1000mL,自然pH。
PDA培养基:称取200 g马铃薯,洗净去皮切成小块,加水1 000 mL煮沸30 min,纱布过滤,再加2%葡萄糖和2%琼脂,121℃,灭菌15 min。
1.1.3 主要试验仪器
LDZX-40BI立式自动电热压力蒸汽灭菌器:上海申安医疗器械厂;SPX-250C恒温恒湿培养箱:上海博讯实业有限公司;DZKW-S-6电热恒温不锈钢水浴锅:巩义英峪华仪器;101-5ARS电热鼓风干燥箱:北京永光明医疗仪器厂;XB-K-25血球计数板:浙江省玉环县求精医用仪器厂。
1.2 方法
1.2.1 病原菌鉴定
1.2.1.1 病原菌分离及其致病性鉴定[3-4]
冬枣2010年10月采于农一师十团,选择成熟度一致(7~8成熟)、大小均一、无病虫害及无机械损伤的果实,当天运回并贮藏在实验室冷库。2010年11月,选择自然发病的具有青霉症状的冬枣,用75%酒精浸泡消毒10 min后,用无菌水清洗后,在病斑与健康组织交接处取5 mm 2小方块,接种于PDA培养基,培养于28℃恒温恒湿培养箱。待菌丝长出,挑取于培养皿中划线分离,然后在2%琼脂水培养基中单孢纯化。
选择品质优良的冬枣,用2%次氯酸钠溶液浸泡消毒后,用无菌水清洗,自然晾干备用。无菌操作条件下,纯化培养的病原菌接到PDA培养基上,28℃,培养7 d后,用接种环在培养好的霉菌试管斜面上刮取适量孢子,转移到5 mL含0.05%Tween-80的无菌水中,并通过四层无菌纱布过滤,以滤去其菌丝体。用血球计数板计数,并添加含0.05%Tween-80的无菌水调整病原菌孢子数目为1×105spores/mL,然后用接种针蘸取孢子悬浮液在冬枣赤道部针刺接种,每个果实接种5针,接种深度基本一致,以刺破果实表皮为宜。28℃保湿培养(相对湿度85%~90%),每日观察并记录其发病症状。对接种成功的发病果实再进行组织分离纯化,获得致病菌。
1.2.1.2 病原菌的形态学分类鉴定
观察感病果实外观病害症状,采用的玻片培养法[5]将病原菌培养7 d后观察其菌落形态及显微形态,参照真菌形态学鉴定手册的方法,鉴定分离所得致病菌的种类。
1.2.2 不同碳源、氮源对橘青霉生长的影响[6]
基础培养基为蔡氏培养基,碳源试验:以KNO3为氮源,分别加入不同碳源30.0 g,不加碳源的蔡氏培养基作为对照;氮源试验:以蔗糖为碳源,分别加入不同氮源2.00 g,不加氮源的蔡氏培养基作为对照。
橘青霉在PDA培养基上培养7 d(28℃),以内径为5 mm的打孔器打下菌苔,然后将其接种于不同碳源、氮源的PDA培养基平板上,28℃恒温恒湿培养,每处理重复3次,采用十字交叉法逐日测量菌落直径。7 d后测量其产生饱子的量,同时观察其培养特性。每处理3个重复。产生饱子数量的测定方法参照汪章勋[7]等的方法,用5 mm直径为的打孔器取菌落3块于含0.05%Tween-80的无菌水中,充分振荡,用血球计数板测定饱子数,最后根据菌落面积进行换算。
1.2.3 光照对橘青霉生长的影响
橘青霉在PDA培养基上培养7 d(28℃),以内径为5 mm的打孔器打下菌苔,然后将其接种于PDA平板上,分别放于全光照、全黑暗、12 h光暗交替条件下,28℃倒置培养,每个处理3个重复,5 d后测量菌落直径和产孢量[8]。
1.2.4 pH对橘青霉生长的影响
用1 mol/L的HCI和1 mol/L的NaOH溶液调节PDA 培 养 基 的 pH, 设 2、3、4、5、6、7、8、9、10、11 pH10个梯度,每个培养皿中接入1个直径5 mm橘青霉的菌苔,28℃的恒温箱中培养。每个处理重复3次,5 d后测量菌落直径[9]。
1.2.5 橘青霉致死温度的测定
测定方法:取1mL的孢子悬浮液(1×106spores/mL)分装于9 mL马铃薯葡萄糖液体培养基的不同试管中,水浴加热,待温度上升到预定值时开始计时,并保温10 min,由40℃开始,以5℃为梯度递增,直至85℃,然后用移液枪吸取0.1 mL培养液在PDA培养基上涂平板,置于28℃的恒温培养箱中倒置培养,3 d后观察橘青霉的菌落生长情况。每个处理3个重复[10]。
1.2.6 橘青霉孢子的抗紫外线辐照能力的测定
配制浓度为1×103spores/ml的孢子悬浮液。取0.1 mL上述孢子悬浮液接种到装有PDA培养基的平板中,涂匀。然后置于超洁净工作台中,分别用紫外线照射 1、6、11、16、21 min,不处理的培养作为对照。每个处理3个重复,置于28℃的恒温培养箱中倒置培养3d,统计单菌落个数,计算致死率。致死率计算公式如下:

1.2.7 试验数据处理
采用SPSS17.0版国际通用软件进行统计分析,计算最小显著差异(LSD)比较差异显著性(α=0.05)。
2 结果与分析
2.1 病原菌的分离及鉴定结果
2.1.1 病原菌的分离
试验结果看出,分离获得20株病原真菌,回接到冬枣上,均能生产典型的冬枣青腐病病斑。从发病冬枣上可重新分离得到与所接种菌株培养性状相同的病原菌,依照柯赫氏法则说明这个菌株即为冬枣青腐病的致病菌。
2.1.2 病原菌的形态学鉴定
病原菌的形态学鉴定结果见图1。
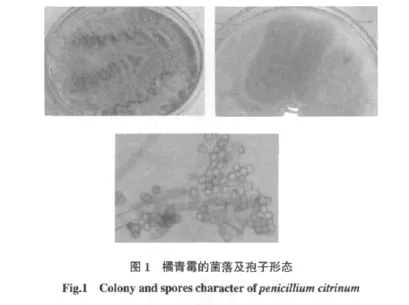
图1结果看出,病原菌在PDA培养基上菌落生长局限,有放射状沟纹,大多数菌系为绒状,另一些则呈现絮状,绿色豆。反面黄色至橙色,培养基颜色相仿或带粉红色,渗出液呈淡黄色。低倍显微镜下分生孢子链为明确的分散柱状。分生孢子梗大多自基质生出,也有自菌落中央气生菌丝生出者,壁光滑,一般不分枝。帚状枝由3个~4个轮生而略散开的梗基构成,每个梗基上簇生6个~10个路密集而平行的小梗。分生孢子呈球形或近球形,淡绿色,光滑或近于光滑,结合形态特征及镜检结果,参照真菌分类鉴定手册[11-12],可初步确认病原菌为半知菌亚门青霉属的橘青霉系(penicillium citrinum)。
2.2 不同碳源、氮源对病原菌菌丝生长及产孢量的影响
采用硝酸盐类(NaNO3、KNO3、NH4NO3)、铵盐类(NH4)2SO4、NH4Cl)、5 种不同的氮源,葡萄糖、麦芽糖、蔗糖、乳糖和D-甘露醇5种不同的碳源,研究了它们对橘青霉菌丝体生长及产孢量的影响,结果见表1。
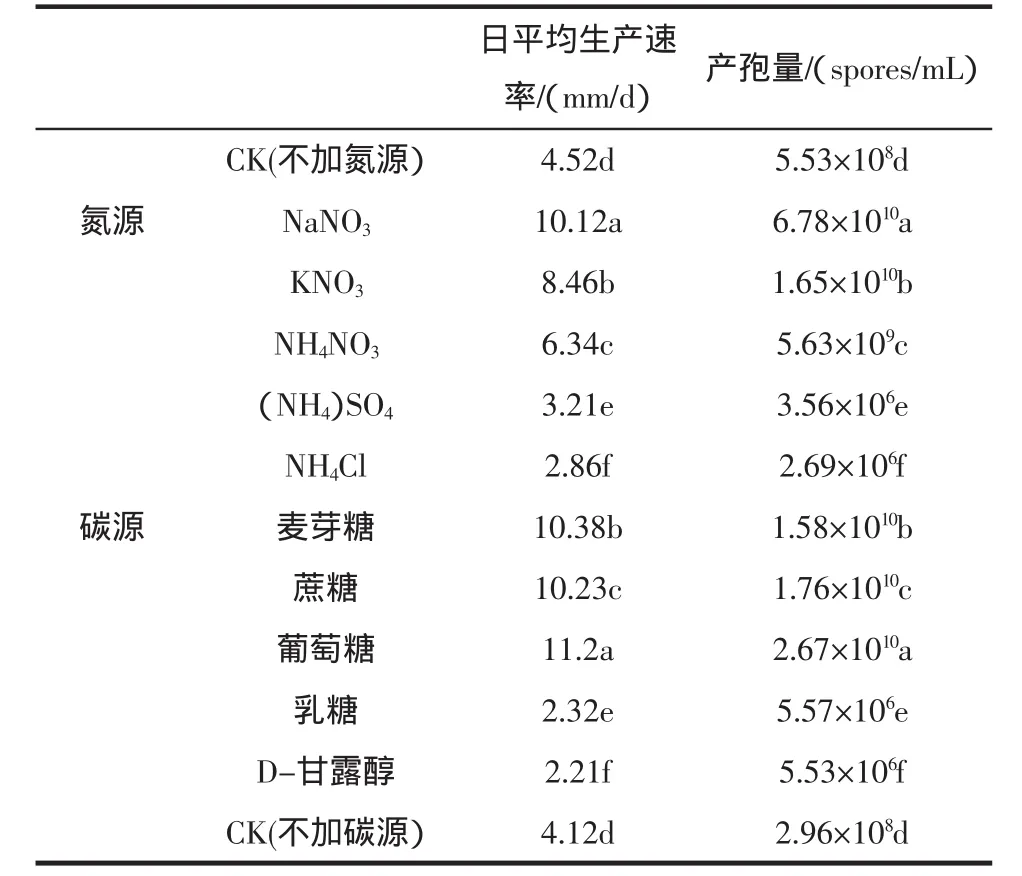
表1 不同氮源、碳源对橘青霉菌丝体生长及产孢量的影响Table 1 Effect of different nitrogen and carbon sources on mycelial growth and spores production of penicillium citrinum
结果表明(见表1),不同的氮源营养和碳源营养对橘青霉的菌丝体生长及产孢量的影响都有显著性差异(P<0.05),硝酸盐类(NaNO3、KNO3、NH4NO3)都有利于橘青霉生长繁殖,而铵盐类((NH4)2SO4、NH4Cl)对橘青霉的菌丝体生长及孢子的产生都有较强的抑制作用,如氯化铵(NH4NO3)作为氮源时,橘青霉菌丝体日平均生产速率仅为2.86 mm,7 d后的产孢量为2.69×106spores/mL,明显低于对照(不加氮源)处理;橘青霉对单糖、双糖和多糖等碳源均可利用,葡萄糖最有利于橘青霉的菌丝体生产和孢子的产生,而乳糖和D-甘露醇对其生长繁殖具有较强的抑制作用,总之,不同营养条件对冬枣青腐病的病原菌菌丝体生长及孢子的产生都有显著影响。
2.3 不同光照处理对橘青霉的菌丝体生长及产孢量的影响
不同光照处理对橘青霉的菌丝体生长及产孢量的影响见表2。
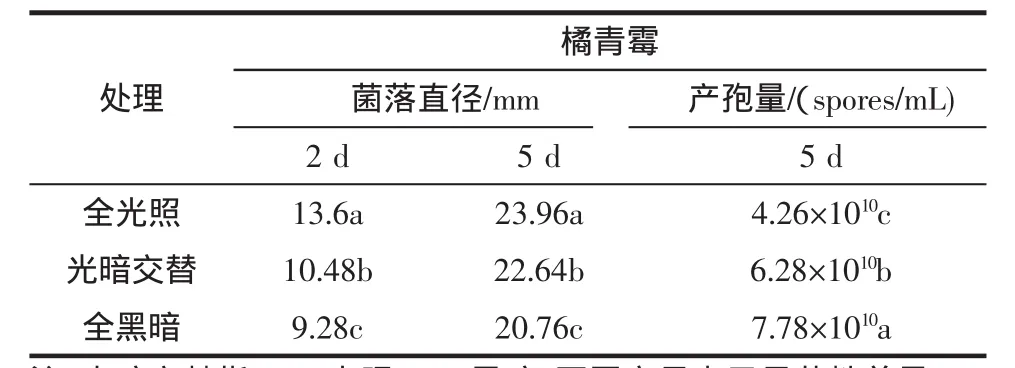
表2 光照处理对橘青霉的菌丝体生长及产孢量的影响Table 2 Effect of light treatment on mycelial growth and spores production of penicillium citrinum
表2试验结果看出,不同光照处理2 d和5 d后,橘青霉的菌落直径均呈显著性差异(P<0.05),全光照时菌落直径最大,培养5 d后,橘青霉的菌落直径达23.96 mm,光暗交替条件下次之,而全黑暗条件下菌丝生长最差;不同光照处理5 d后,橘青霉的产孢量也显著性差异(P<0.05),全黑暗处理菌株产孢量最多,达到7.78×1010spores/mL。总之,光照利于橘青霉菌丝体的生长,而黑暗则对其孢子的产生起促进作用。
2.4 不同pH对橘青霉的菌丝体生长的影响
不同pH对橘青霉的菌丝体生长的影响见图2。
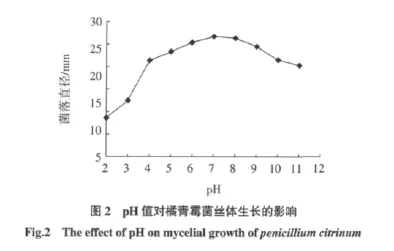
橘青霉菌丝生长对pH不敏感,在pH2~11的范围均可生长(见图2),在偏酸性 PDA 培养基(pH2、3)上,菌丝生长缓慢,在中性及碱性PDA培养基上(pH7、8、9)菌丝生长较快,但碱性过强时菌丝体生长受抑制,结果表明,橘青霉的最适生长pH值为7~8。
2.5 橘青霉致死温度的测定
由表3可知,随着处理温度的升高,橘青霉孢子在PDA平板上长出的菌落数逐渐减少,培养3 d后,40℃~70℃处理的菌株均能长出菌落,但经75℃处理组未见菌落长出,5 d后观察结果与3 d后基本保持一致,无新菌落长出。结果表明,在75℃处理,能将橘青霉的分生孢子全部杀死。
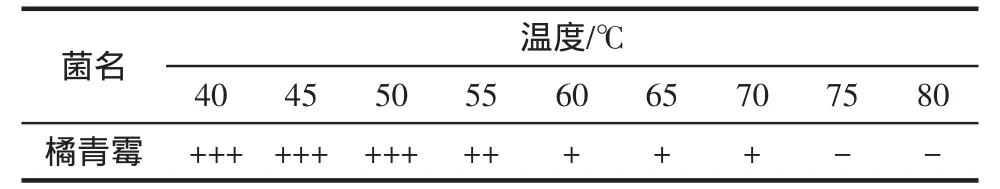
表3 橘青霉的致死温度Table 3 The deadly temperature for penicillium citrinum
2.6 橘青霉孢子的抗紫外线辐照能力的测定
对橘青霉的孢子进行 1、6、11、16、21 min 的紫外线辐照处理,见图3。
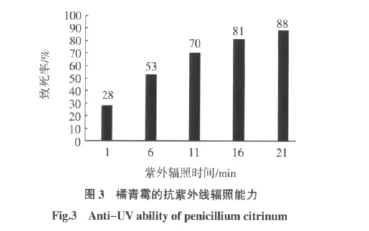
由图3可以知,随着紫外辐照时间的延长,菌株的致死率逐渐增加,紫外辐照处理11 min时,橘青霉的致死率才达70%,说明橘青霉孢子的抗紫外线辐照能力较强。
3 结论与讨论
青霉属病原菌引起的冬枣采后贮藏中青腐病,其菌落大多呈灰绿色或青绿色,通常难以描述和区分。本试验采用传统真菌形态学的鉴定方法.与已报道的鲜枣青霉致病菌的特征进行比对,从而得出病害的主要病原菌为橘青霉。为了更好地防治果蔬采后病害,了解和掌握各种病害病原菌的生物学特性,逐步受到人们的重视。
在氮源、碳源对橘青霉菌丝生长及产孢量的影响试验中发现,硫酸氨、氯化氨(氮源)和D-甘露糖、乳糖(碳源)均对其有抑制作用,这些试验结果将可用于冬枣采后贮藏中病害防治,如应用硫酸氨、氯化氨等作为增效剂来提高化学杀菌剂和生防微生物对冬枣采后贮藏中青腐病的防治效果。光照对青霉菌菌丝体生长及孢子的产生影响差异都显著,光照利于橘青霉菌丝体的生长,而黑暗则对其孢子的产生起促进作用;橘青霉在pH2~11的范围内均可生长,在pH6~9范围内生长良好,最适生长pH为7~8。随着温度的升高,橘青霉的致死率迅速上升但达到一定值后,趋势有所下降,其孢子的致死温度为75℃左右,对高温的忍耐能力较强;随着紫外辐照时间的延长,致死率也逐渐增加,橘青霉的抗紫外线辐照线辐照能力较强,辐照11 min的致死率只有70%。由试验可知冬枣采后致病青霉菌孢子较耐高温,特别是新疆塔里木盆地的干旱高温的秋季,它们适应环境条件的能力较强,热处理和紫外线辐照在一定程度上可以延缓或控制冬枣采后病害的发生,但并不能在根本上起到杀菌的作用,仍然需要采用化学杀菌剂或生物防治等方法配合才能延长冬枣的贮藏期。
综合分析冬枣采后橘青霉的致病性及生物学特性,研究发现,温度、pH、营养条件及环境条件等是引起冬枣采后病害的关键因素。冬枣采后病害的控制应在采前果实近成熟期就采取措施减少潜伏侵染,采收时尽量避免机械损伤,采后以低温贮藏为基础,结合高效低毒化学杀菌剂、紫外辐照、热处理及生物防治技术进行综合防治,才能有效控制冬枣在贮藏期间的由橘青霉引起青腐病危害。
[1] 王亚萍,王贵禧.鲜枣贮藏期病害研究进展[J].果树学报,2005,22(4):376-380
[2] 吴兴梅,孙蕾.冬枣贮藏期主要病害的研究[J].经济林研究,2003,21(2):19-22
[3] 周绪宝.冬枣采后黑腐病病害及防治技术的研究[D].北京:中国农业大学,2003
[4] 李静,殷晓悦.场山梨采后黑腐病病原菌的分离鉴定[J].保鲜与加工,2006,6(5):38-39
[5] 周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:258-267
[6] 王宏,常有宏.梨黑斑病病原菌生物学特性研究[J].果树学报,2006,23(2):247-251
[7] 汪章勋.粉拟青霉不同菌株生物学特性的研究[J].安徽农业大学学报,2005,32(1):8-11
[8] 闵晓芳.柑橘青绿霉病病原菌的分离及其生物学特性研究[J].中国南方果树,2007,36(3):11-14
[9] 岑贞陆,谢玲.大青枣炭疽病的病原鉴定及其生物学特性研究[J].中国农学通报,2002,18(3):48-51
[10]闵晓芳.柑橘采后致病青霉的分离鉴定及其生物学特性研究[D].武汉:华中农业大学,2007
[11]邵力平,沈瑞祥.真菌分类学[M].北京:中国林业出版社,1984:297-329
[12]孔华忠.中国真菌志(第35卷)[M].北京:科学出版社,2007:38-131
[13]甘瑾,马李一.芒果采后病原菌的分离及天然抗菌物质的筛选[J].食品科学,2008,29(10):414-417
[14]周绪宝.冬枣采后黑腐病病害及防治技术的研究[D].北京:中国农业大学,2003
[15]王亚萍,王贵禧.鲜枣贮藏期病害研究进展[J].果树学报,2005,22(4):376-380
[16]刘万臣.3种鲜枣贮藏期致病真菌的检测及定性研究[J].食品科技,2007(8):237-240

