猪皮胶原蛋白制备及其抗氧化肽水解条件优化
杨芳宁,张慧芸,康怀彬
(河南科技大学食品与生物工程学院,河南洛阳471003)
我国是一个养猪大国,随着科学技术的不断发展,养猪业也得到了飞速的发展,猪出栏数和猪肉产量保持逐年增长的势头。在生产猪肉的同时会产生大量的副产物,猪皮就是其中之一。绝大部分的猪皮都用于制革,可在制革工业中,大部分皮革边角余料都被扔掉,而皮革边角余料的主要成分是胶原蛋白。猪皮中的蛋白质含量高达33%,其中胶原蛋白含量为87.8%[1]。胶原蛋白具有良好的物理性能和生物学特性,在化工、食品、生物材料等有着广泛的应用[2-3]。胶原蛋白经酶解后得到的生物活性多肽也更有利于人体的吸收利用[4]。胶原多肽具有免疫调节、抗疲劳、抗氧化等[5-6]生理调节功能,2006年全世界胶原肽的年产量已超过20万t[7],是极具发展前景的功能因子和当前国际医药学、食品界最热门的研究课题[8]。
本研究旨在利用猪皮提取胶原蛋白,采用酶解法提取胶原蛋白多肽,以O2-·清除率为指标,考察时间,酶用量,底物浓度对多肽抗氧化性的影响,确定最佳酶解提取条件,获得最具抗氧化性的胶原蛋白多肽。
1 材料与方法
1.1 试验材料
新鲜猪皮:购于洛阳大张超市;胃蛋白酶(1∶3000):Sigma;其他试剂均为分析纯。
1.2 仪器与设备
H2050R高速冷冻离心机、TG16-W微量高速离心机:湘仪离心机仪器有限公司;GLZ-0.2真空冷冻干燥机:上海浦东冷冻干燥设备有限公司;722S可见分光光度计、JR2002万分之一电子天平:上海精密科学仪器有限公司;UV-7504单光束紫外分光光度计:上海欣茂仪器有限公司;HH-S电热恒温水浴锅:江苏金坛市亿通电子有限公司;303-1电热恒温干燥箱:江苏省东台县安丰电器厂。
1.3 方法
1.3.1 胶原蛋白的提取
参考周玉恵[9]和朱夕波[10]等研究方法稍作修改。将新鲜猪皮洗净用手术刀去皮下脂肪切成0.5 cm×0.5 cm小块,用pH 7.5的磷酸盐清洗干净,再用去离子水浸泡冲洗3次~5次,浸入10%的NaCL溶液中12 h,除去盐溶性杂质,用去离子水洗涤2次~3次,然后分别加入 0.5 mol/L 的 HAc(1∶20,体积比)和胃蛋白酶(1∶20,质量比),控制pH在2~3范围内,酶处理72 h后,离心(3 000 r/min)分离取上层清液。在上层清液中加入NaCl进行胶原蛋白盐析,NaCl浓度为2 mol/L,离心分离(8 000 r/min),沉淀即为胶原蛋白,然后将胶原蛋白重新溶解于0.5 mol/L的HAc,重复盐析两次。将胶原蛋白溶解于0.5 mol/L的HAc中,然后在0.02 mol/L的Na2HPO4(pH8.8)中透析2 d~3 d,所得的胶原沉淀冷冻干燥。
1.3.2 胶原蛋白抗氧化多肽的制备
称取胶原蛋白加入10 mL蒸馏水溶于锥形瓶中,然后放入90℃水浴锅中预热5 min,用盐酸调节pH为2,称取胃蛋白酶溶于其中,放置37℃的水浴锅中开始反应。反应结束后在沸水浴中加热5 min灭酶,在8 000 r/min 离心 30 min,取上清液,测定其对 O2-·自由基清除的能力,同时测定胶原蛋白清除力作对照。
1.4 测定方法
1.4.1 羟脯氨酸的测定
缓冲溶液的配制:15 g柠檬酸、7.5 g氢氧化钠和45 g醋酸钠用水溶解后,转移至500 mL的容量瓶,然后加入145 mL甘油,用水稀释至刻度。
氯氨T试剂的配制:取氯氨T 1.41 g溶于100 mL的缓冲液中(放置于5℃的冰箱中可以保存一个月)。
发色剂的配制:溶解10 g 4-二甲氨基苯甲醛于35 mL 60%的高氯酸中,慢慢地不断摇动加入65 mL异丙醇(当天使用)。
羟脯氨酸标准曲线的测定:参考刁雪洋[11]和秦玉清[12]等方法稍作修改。研究称取50 mg羟脯氨酸,用少量水溶解于100 mL容量瓶中滴加一滴3 mol/L硫酸,定容至刻度(标准储备液:500 μg/mL,现配现用)。移取5 mL标准储备液于500 mL容量瓶中,用水稀释定容。然后移取 0、10、20、30、40 mL 上述溶液于 100 mL 容量瓶中,定容至刻度,此标准溶液的羟脯氨酸浓度分别是 0.00、0.5、1、1.5、2 μg/mL。(其余各步按 ISO 3496:1994(E)羟脯氨酸测定法操作。)空白溶液用蒸馏水代替。取不同浓度的上述溶液4.00 mL,分别加入20 mL具塞试管中,加氯胺T溶液2 mL,摇匀后于室温放置20 min。加入显色剂2 mL,摇匀,塞上塞子于60℃试管加热器(恒温水浴锅)中保温20 min后取出,迅速冷却,在波长(558±2)nm处测定吸光值,绘制标准曲线。
酶法提取胶原蛋白的测定:从离心后的上清液中各吸取5.0 mL于锥形瓶中,分别加入5.0 mL、3 mol/L的H2SO4用保鲜膜封口,盖上烧杯,放入105℃烘箱中水解16 h,将水解液转移至100 mL容量瓶定容至刻度;吸取5.0 mL母液定容至100 mL(稀释液1);再吸取10.0 mL稀释液1定容至100 mL(稀释液2),其余各步按ISO 3496:1994(E)羟脯氨酸测定法操作。
回收率测定:分别称取4 g新鲜猪皮,各加入40 mg和120 mg标准羟脯氨酸,按上述步骤进行实验,测定羟脯氨酸含量,计算回收率。每一样品做3次平行实验。
1.4.2 O2-·自由基清除能力测定方法
利用邻苯三酚自氧化体系测定样品对O2-·的清除能力。取4.5 mL 50 mmol/L pH 8.2的Tris—HCl缓冲溶液,加入0.2 mL样品溶液,于25℃保温10 min。然后加入0.3 mL 25℃预温的3 mmol/L邻苯三酚,混匀后迅速加入干燥的比色皿中,在波长320 nm处测定吸光度。每隔30 s测定1次吸光度值。以等量的10 mmol/L HCI代替邻苯三酚调零。空白组以等量的去离子水代替样液,其它步骤同前。
作出样品溶液与邻苯三酚,去离子水与邻苯三酚混合液在320 nm处吸光度值随时间的变化曲线。其回归方程的斜率作为邻苯三酚的自氧化速率V样品、V空白(△OD/min)。
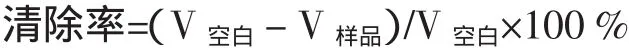
1.5 数据分析
采用sigmaplot10.0软件对所得实验结果作图分析。
2 结果与分析
2.1 羟脯氨酸标准曲线绘制
如图1所示,以羟脯氨酸浓度为横坐标,吸光度为纵坐标绘制标准曲线,其回归方程为y=0.1888x+0.0008,相关系数R2=0.999 9,这说明所确定的回归方程有意义。

2.2 回收率和胶原蛋白提取率测定
由表1可知,实验建立的羟脯氨酸含量测定方法回收率为77.04%~92.19%,平均回收率为81.69%,证明了实验的可行性。胶原蛋白含有羟脯氨酸的量一般以占胶原蛋白干重的14%左右来定量测定。根据前期实验得到猪皮中羟脯氨酸含量平均值为33.792 mg/g,通过计算得到胶原蛋白提取率为44.46%。这与王川[13]研究结果得率36.2%相比高出一些,可能是提取方法上略有不同,测定时有些环境误差,这也说明了本实验的可操作性较强。

表1 猪皮胶原蛋白回收率Table 1 The recovery of collagen extracted from pig skin
2.3 酶解条件对胶原蛋白抗氧化多肽制备的影响
2.3.1 酶解时间对酶解产物抗氧化性的影响
在pH=2,底物浓度为1%,酶用量为底物的2%条件下进行试验,分别在时间为 0.5、1、2、4、6、7、8、10、12 h下检测水解产物清除自由基能力大小,清除能力越大,抗氧化能力越强。实验结果如图2所示。从图2可以看出,随着酶解反应时间增加所得酶解产物对自由基清除率有上升趋势,且在反应时间为7 h时清除率最高可达51.72%,之后在反应时间为10 h时清除率又有所上升但均低于7 h的清除率。原因可能是水解时间过长,一些肽段的肽键被破坏。由此试验看出7 h为最佳酶解时间。
2.3.2 酶用量对酶解产物抗氧化性的影响
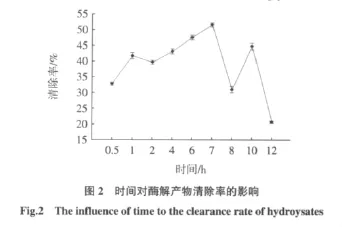
在pH=2,底物浓度为1%,酶解时间为7 h的条件下进行试验,分别在酶用量占底物的1%、2%、2.5%、3%、4%下检测水解产物清除自由基能力大小,清除能力越大,抗氧化能力越强。实验结果如图3所示。
从图3可以看出,不同酶用量下反应所得酶解产物对O2-·自由基清除率有所不同,在酶占底物用量为2%时清除率最高可达44.83%。在底物浓度一定的时候,酶分子越多则酶与底物之间作用频繁,但随着酶用量的增加,酶的数量就趋于过剩,单位时间内一部分酶分子不与底物结合,造成水解程度增加变缓慢。另外,由于酶本身也是一种蛋白质,也会发生酶解,如果量太大了则会干扰酶解物的组成。另外,酶试剂价格较贵,过量添加成本较高。因此试验得出酶占底物浓度2%为最佳酶用量。
2.3.3 底物浓度对酶解产物抗氧化性的影响
在pH=2,酶解时间为7h,酶占底物浓度2%条件下进行试验,分别在底物浓度为1%、2%、2.5%、3%、4%、5%、6%、8%下检测对酶解产物对自由基清除能力大小,清除能力越大,抗氧化能力越强。实验结果如图4所示。从图4可以看出,不同底物浓度下反应所得酶解产物对自由基清除率随浓度增加不断上升,且在底物浓度为4%时清除率可达71.03%,而之后随着底物浓度增加清除率缓慢降低。这可能是由于底物与酶分子结合达到饱和,过高底物浓度易造成水解黏度增大,影响蛋白酶扩散,抑制水解反应。由此得出底物浓度4%为最佳底物浓度。

图4 底物浓度对酶解产物清除率的影响Fig.4 The influence of the substrate concentration to the clearance rate of hydrolysates
2.3.4 正交试验确定酶解提取胶原蛋白抗氧化肽的最佳水解条件
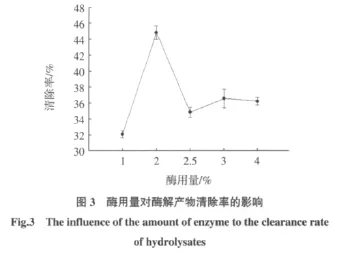
考虑到各因素的相互依赖和相互制约,导致对酶解效果的影响,进行正交试验以确定各参数的最佳组合。按正交表L9(34)设计试验,以对自由基清除率为指标,拟定实验方案见表来考察3个因素对水解效果的影响,结果见表2。
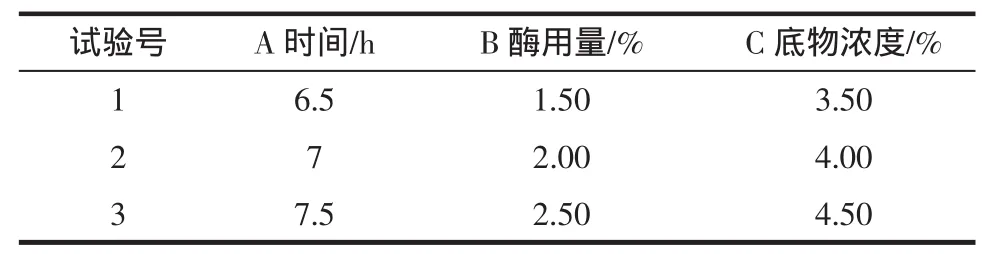
表2 猪皮胶原蛋白抗氧化肽制备的正交试验因素和水平Table 2 Factors and levels for preparation technology of the antioxidant peptides from pig skin collagen
通过正交试验酶解反应正交试验清除率结果见表3。由表中极差(R)大小可知,影响清除自由基能力的主次因素顺序为酶占底物用量→酶解时间→底物浓度,直观分析可得最优组合为A1B3C2,且极差(R)满足 RB>RA>RC,由此可得因素 A(酶解时间)、因素B(酶占底物用量)、因素C(底物浓度)都对样品清除自由基能力有影响,即A、B、C均为主要因素。因素B影响最显著,且B3最优,其次因素A应选A1最好,而因素C选C2。则较优组合应为酶解时间6.5 h、酶占底物用量2.5%、底物浓度4%。试验中没有出现,且接近3号试验。经验证实验所得,在较优组合条件下水解产物对自由基清除率可达72.07%,与实验结果相符。同时测定胶原蛋白对自由基清除率只有37.14%,可见胶原蛋白多肽具有较强的清除自由基能力,具有较好的抗氧化性。
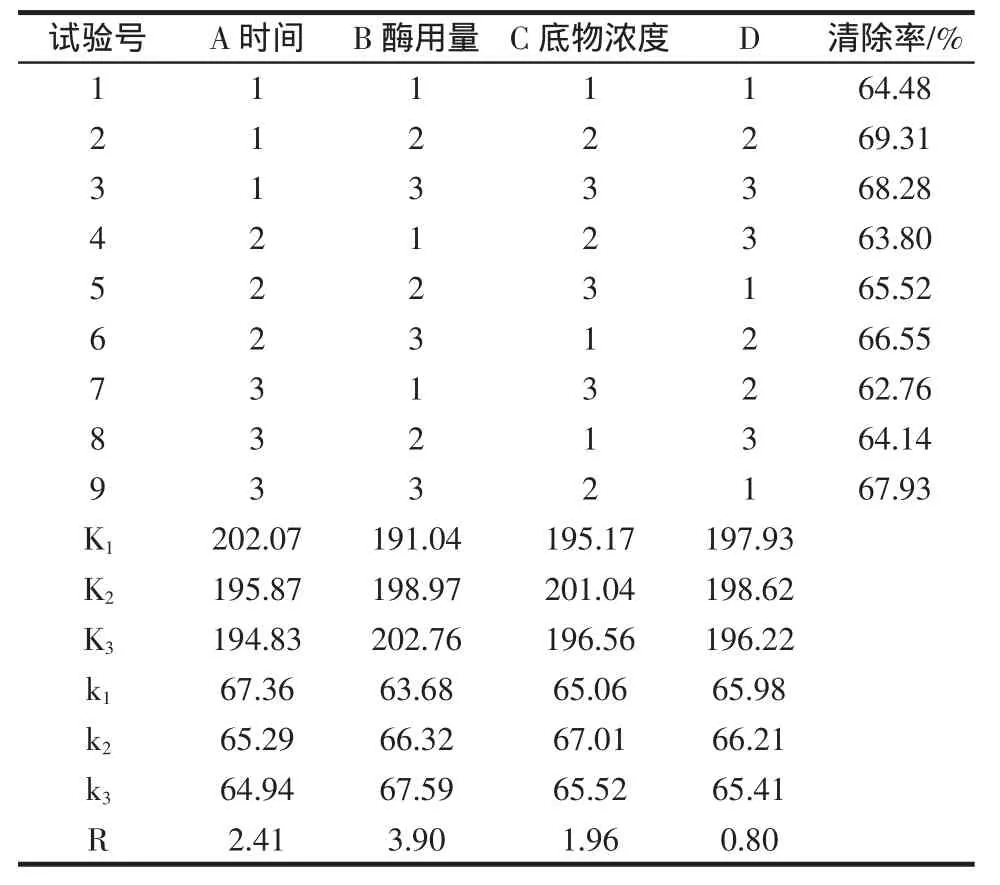
表3 猪皮胶原蛋白抗氧化肽制备的L9(34)正交试验结果Table 3 Results of L9(34)orthogonal test for preparation technology of the antioxidant peptides from pig skin collagen
3 讨论
近年来,水解蛋白质提取抗氧化多肽在医学、营养学界等备受关注。Prokomy提出,一些抗氧化肽能降低自动氧化速率和脂肪的过氧化物含量[14]。许多学者已从多种食物中提取出抗氧化多肽。任俊凤[15]等通过河豚鱼皮水解提取了胶原蛋白抗氧化多肽,其多肽对自由基清除率最高为 53.79%。Eresha Mendis[16]等研究表明,通过章鱼皮提取的胶原蛋白多肽具有较强的抗脂质过氧化能力。目前为止,已提出多种抗氧化肽,但不同的原料、水解酶以及不同的酶解条件都会影响胶原蛋白肽的抗氧化性。这可能因为不同原料胶原蛋白的氨基酸组成有一些差异,所得多肽也因氨基酸含量不同,抗氧化性也有所不同。另外,不同酶的作用位点不同,所得的胶原蛋白肽的氨基酸组成不同,也影响其抗氧化性的发挥。本实验使用相同酶提取胶原蛋白和抗氧化多肽,保持了作用位点前后一致,使得所得胶原蛋白肽的氨基酸组成与前期胶原蛋白的氨基酸组成也具有一定的相似性。但猪皮胶原蛋白明显没有优化条件下制得的胶原蛋白肽具有较好的抗氧化性,这为进一步研究胶原蛋白抗氧化肽提供了相关理论依据。同时也说明了,猪皮胶原蛋白肽具有较强的抗氧化性,可以废弃的猪皮为原料,开发一种天然抗氧化剂应用于食品、药品及化妆品中。
4 结论
采用胃蛋白酶酶解猪皮提取胶原蛋白,操作简单,易于掌握,且能耗低,无污染,提取的胶原蛋白较好的保存了蛋白的空间结构,平均回收率是81.69%,胶原蛋白提取率可达44.46%。
[1] 李开雄,赵志远,刘霞.猪皮中胶原蛋白的提取及其应用[J].肉类研究,1996(4):43-48
[2] 任俊莉,付丽红,邱化玉.胶原蛋白的应用及其发展前景[J].中国皮革,2004,3(1):36-38
[3] BINSI P K,SHAMASUNDAR B A,DILEEP A O,et al.Rheological and functional properties of gelatin from the skin of Bigeye snapper fish:influence of gelatin on the gel-forming ability of mince[J].Food Hydrocolloids,2009,23:132-145
[4] Montero P,Gomez-Guillen M.Extracting conditions for Megrim(Lepidorhombus boseii)skin collagen affects functional properties of the resulting gelatin[J].Food Chem Toxic,2000,65:434-438
[5] 冯怀蓉,张慧涛,茆军.多肽简介及应用[J].新疆农业科学,2002,39(1):38-39
[6] Byun H G,Kim S K.Purification and characterization of angiotensinⅠconverting enzyme(ACE)inhibitory peptides from Alaska Pollack(Theragra chalcogramma)skin[J].Process Biochemistry,2001,36:1155-1162
[7] BADII F,HOWELL N K.Fish gelatin:structure,gelling properties and interaction with egg albumen proteins[J].Food Hydrocolloids,2006,20:630-640
[8] 王树华,王树祥.抓紧发展生物活性肽[J].化工管理,2004(5):27
[9] 周玉惠,叶正涛,肖立芳,等.猪皮胶原蛋白的提取及其结构表征[J].湖北大学学报,2008,30(3):287-289
[10]朱夕波,周培根,李燕,等.猪皮胶原蛋白水解产物中的抗氧化活性肽的分离及其氨基酸组分[J].天然产物研究与开发,2009,21(1):122-124
[11]刁雪洋.猪皮胶原蛋白提取及理化特性的研究[D].四川:西南大学,2010:16-17
[12]秦玉青,刘承初,王慥,等.鱿鱼皮胶原蛋白的测定与回收[J].上海水产大学学报,2002,11(2):138-144
[13]王川,李燕,马志英.几种酶法从猪皮中提取胶原蛋白的对比研究[J].食品科学,2007,28(1):201-204
[14]Prokomy R.Natural antioxidants for food use[J].Trends Food Sci Technol,1991(2):223-227
[15]任俊凤,任婷婷,朱蓓薇.河豚鱼皮胶原蛋白多肽的提取及其抗氧化活性的研究[J].中国食品学报.2009,9(1):77-82
[16]Eresha Mendis,Niranjan Rajapakse,Hee-Guk Byun,et al.Investigation of jumbo squid skin gelatin peptide for their in vitro antioxidant effects[J].Life Sceence,2005(77):2166-2178

