胞内高迁移率族蛋白B1 对高糖诱导的小鼠心脏成纤维细胞转化生长因子-β1 表达的影响
潘皓,韩尧辉,张赢予,毛俊倩,周艳芳,王好,鲍永辉,赵龙,张国辉
(江苏大学附属人民医院心内科,江苏镇江212002)
糖尿病导致的心血管疾病是糖尿病患者健康的主要威胁之一。糖尿病引起的代谢紊乱直接影响心肌细胞、心脏成纤维细胞、内皮细胞的功能,促进心肌细胞的凋亡、坏死,心肌间质胶原的沉积,微血管病变,神经病变等,导致心功能下降,即糖尿病心肌病(diabetic cardiomyopathy,DCM)[1]。DCM 的发病过程是多因素共同作用的结果[1],主要包括高血糖,血脂异常,胰岛素抵抗,氧自由基产物的增加,细胞内钙超载等。炎症反应是糖尿病引起的靶器官损害的病理生理变化中的关键环节。胞内高迁移率族蛋白B1(high mobility group box-1,HMGB1)作为体内一个多种急、慢性炎症反应的重要的炎症介质和炎症调节分子,参与了高糖引起的炎症反应[2-3]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是一个多效性分子,广泛参与了细胞的增殖、分化、生长以及炎症和细胞外基质沉积的调节等多种活动。在各种原因导致的心脏重塑中TGF-β1通路是关键的信号通路之一[4]。本研究观察高糖作用心脏成纤维细胞不同时间后HMGB1、TGF-β1 表达量的变化以及HMGB1 siRNA 对高糖诱导的心脏成纤维细胞TGFβ1 表达量的影响。
1 材料与方法
1.1 动物和主要试剂
健康的3 周龄C57/BL6 小鼠,雌雄不限,由江苏大学动物实验中心提供。DMEM 低糖培养基、胰酶(美国Gibco 公司),标准胎牛血清(美国Hyclone公司),波形蛋白(vimentin)抗体、链霉素亲和素-生物素-过氧化物酶复合物(SABC)免疫组化试剂盒、DAB 显色试剂盒(武汉博士德生物工程有限公司),转染试剂RNAiMax、Trizol(美国Invitrogen 公司),cDNA 第一链合成试剂盒、qPCR 扩增试剂盒(加拿大Fermentas 公司)。其余生化试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1 小鼠原代心脏成纤维细胞的分离、培养 拉颈脱臼处死小鼠,75%乙醇浸泡消毒,无菌操作下取心脏,将心脏剪碎成1 mm3大小的碎块,加入消化液(0.08%胰酶和1%Ⅰ型胶原酶1 ∶1 混合)于37℃水浴,每10 min 收集消化后的上清并用等体积的含20%血清的培养基中和,直至组织块变透明消失,将收集的细胞离心重悬接种,4 h 后除去未贴壁的细胞,重新加入含10%血清的DMEM 低糖培养基,置于37 ℃、5%CO2培养箱培养。第2 天换液,以后每2 天换液1 次。待细胞长至80%融合时传代。5 代以后的细胞形态明显改变,实验选择2 ~4代细胞。高糖培养不同时间(0,6,12,24,48 h)后分别检测HMGB1、TGF-β1 mRNA 的表达量。
1.2.2 心脏成纤维细胞的形态观察和鉴定 显微镜下观察原代培养的心脏成纤维细胞形态。取传代后的心脏成纤维细胞严格按照试剂盒说明的免疫细胞化学方法进行波形蛋白鉴定。
1.2.3 siRNA 转染 siRNA 由上海吉玛公司设计合成,HMGB1 siRNA:上游序列5'-CUCGUUAUGAAA GAGAAAUTT-3,下 游 序 列5'-AUUUCUCUUUCAUAACGAGTT-3';阴性对照siRNA:上游序列5'-UUCUCCGAACGUGUCACGUTT-3',下游序列5'-ACGUGA CACGUUCGGAGAATT-3'。按照转染试剂RNAiMax说明操作,最终阴性对照siRNA 和HMGB1 siRNA 的浓度为60 nmol/L。siRNA 干扰24 h后换液。高糖培养6 h 后,分别检测对照组和HMGB1 siRNA 组的HMGB1 和TGF-β1 mRNA 的表达量。
1.2.4 RT-PCR 检测成纤维细胞HMGB1、TGF-β1 mRNA 的表达 Trizol 法提取细胞总RNA,以β-肌动蛋白为内参。引物由上海生工合成,HMGB1 上游引 物:5'-GGGTCACATGGATTATTAGTG-3',下 游引 物:5'-CAGGGCATGTGGACAAAAG-3',产 物73 bp;TGF-β1 上 游 引 物:5'-ACGCCTGAGTGGCTGTCTTTTGAC-3',下游引物:5'-GGGCTGATCCCGTTGATTTCCACG-3',产物149 bp;β-肌动蛋白上游引物:5'-TGGAATCCTGTGGCATCCAGAAAC-3',下 游引物:5'-TAAAACGCAGCTCAGTAACAGTCCG-3',产物349 bp。按试剂盒说明反转录合成cDNA,然后以cDNA 产物为模板进行目的片段的PCR 扩增。反应条件:95 ℃10 min,然后95 ℃15 s,60 ℃30 s,72 ℃30 s,共40 个循环。PCR 产物的特异性通过熔解曲线分析确认。反应结束后,数据以2-ΔΔCT法表达。
1.2.5 统计学方法 所有数据以均数±标准差表示,采用统计软件SPSS 17.00 进行数据分析,多组数据比较采用单因素方差分析,进一步两两比较采用LSD-t检验。两组数据比较采用两样本t检验。
2 结果
2.1 小鼠心脏成纤维细胞形态学观察
原代培养60 min 后即有部分细胞贴壁,呈椭圆形或不规则形,4 h 后大量细胞贴壁,培养1 ~2d后伸展为梭形或多角形,胞体较大,胞质透明,常可见2 ~3 个核,呈散在生长。3 ~4d 后增殖明显,开始聚集生长,呈漩涡状或放射状(图1)。传代后的细胞贴壁速度明显加快。第5 代以后细胞形态发生明显变化。
2.2 细胞鉴定
培养的成纤维细胞波形蛋白抗原免疫细胞化学染色阳性,胞质呈棕黄色(图2)。
2.3 高糖培养不同时间对心脏成纤维细胞HMGB1、TGF-β1 mRNA 表达的影响
高糖培养液处理6,12,24,48 h 心脏成纤维细胞的HMGB1 mRNA 表达量明显上升(F=42. 18,P<0.01)(图3),同时TGF-β1 mRNA 表达量也有增加(F=8.33,P<0.01)(图4)。其中在6 h,HMGB1、TGF-β1 mRNA 增加较明显。
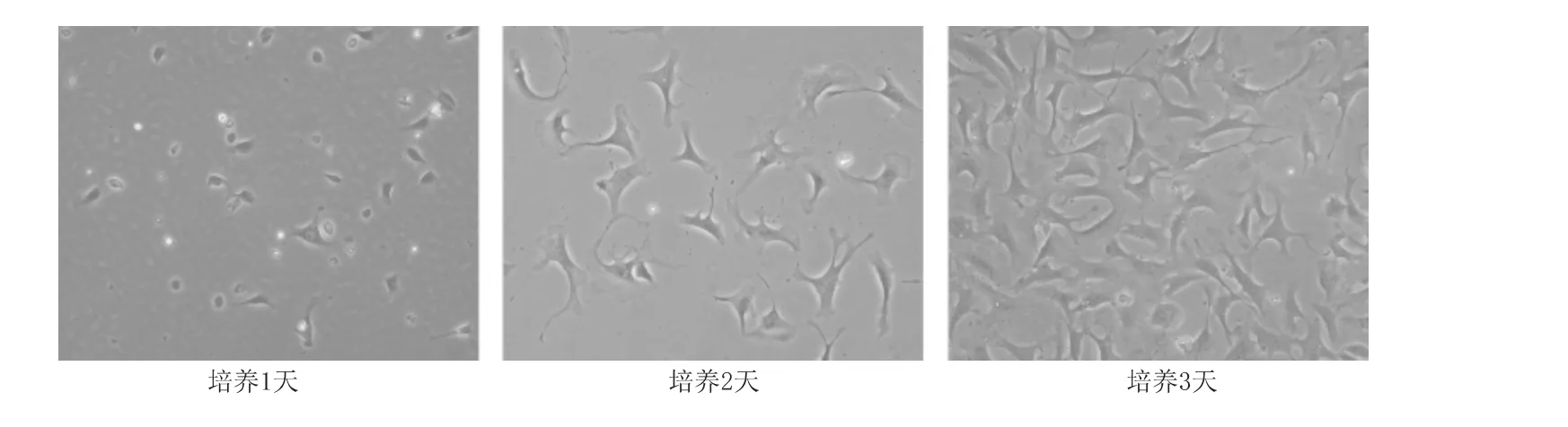
图1 原代培养小鼠心脏成纤维细胞(×200)Fig 1 The cultured cardiac fibroblasts isolated from C57/BL6 mice(×200)
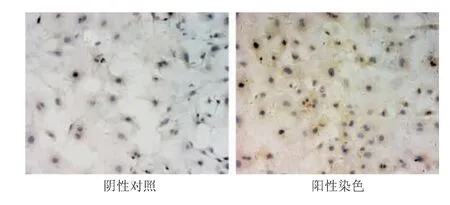
图2 心脏成纤维细胞波形蛋白表达情况(免疫细胞化学染色×200)Fig 2 Vimentin presentation of cardiac fibroblasts(immunocytochemical staining×200)
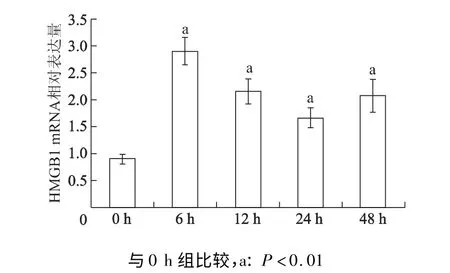
图3 心脏成纤维细胞高糖培养不同时间后HMGB1 mRNA 的表达Fig 3 The expression of HMGB1 mRNA of cardiac fibroblasts treated by high glucose fordifferent times
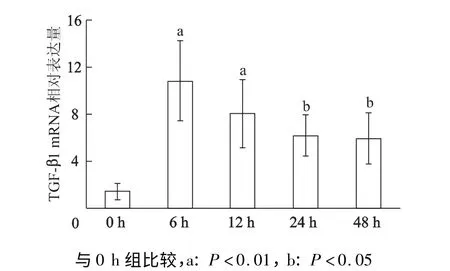
图4 心脏成纤维细胞高糖培养不同时间后TGF-β1 mRNA 的表达Fig 4 The expression of TGF-β1 mRNA of cardiac fibroblasts treated by high glucose fordifferent times
2.4 HMGB1 siRNA 转染后心脏成纤维细胞HMGB1、TGF-β1 mRNA 的表达
siRNA 组的HMGB1 mRNA 表达量较对照组明显下降(t=5.40,P<0.01)(图5),这说明HMGB1 siRNA 的转染是成功的。同时检测到HMGB1 siRNA 明显抑制了高糖培养6 h 后心脏成纤维细胞TGF-β1 mRNA 的表达(t= 2.55,P<0.05)。见图6。
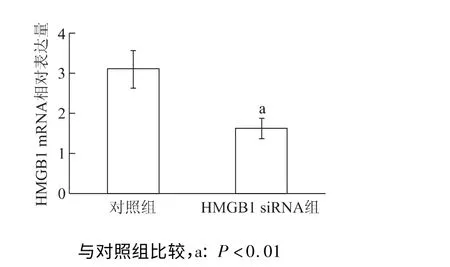
图5 HMGB1 siRNA 对高糖培养6 h 后心脏成纤维细胞表达HMGB1 mRNA 的影响Fig 5 The effect of HMGB1 siRNA on the expression of HMGB1 mRNA of cardiac fibroblasts treated by high glucose for 6 h

图6 HMGB1 siRNA 对高糖培养6 h 后心脏成纤维细胞表达TGF-β1 mRNA 的影响Fig 6 The effect of HMGB1 siRNA on the expression of TGF-β1 mRNA of cardiac fibroblasts treated by high glucose for 6 h
3 讨论
本研究对幼年小鼠心脏成纤维细胞的离体培养在传统方法的基础上做了一些改进。首先,采用较低浓度的胰蛋白酶和较高浓度的Ⅰ型胶原酶混合的双酶消化法,胶原酶的使用不仅减小了胰酶对细胞的损害而且有利于消化细胞间质,提高细胞获得率。其次,我们经过多次试验发现每次消化10 min 较合适,消化时间过长会造成细胞不可逆的损害,过短消化不完全,细胞数量不足。再次,由于非新生鼠的心脏成纤维细胞贴壁时间较长,并且利用酶消化法时非新生鼠的心肌细胞不贴壁,而成纤维细胞是优势细胞可以通过传代纯化,故我们延长了差速贴壁的时间至4 h。最终结果表明,我们获得了符合实验要求的细胞。
HMGB1 是与染色体结合的非组蛋白成分之一,可以被分泌至胞外,在胞内胞外发挥多种生物学功能,并参与多种病理生理过程。在小鼠脓毒症模型中[5],HMGB1 的产生晚于TNF-α、IL-1 等炎症介质,且能反过来刺激TNF-α、IL-1、IL-6 等的释放,诱发炎症扩大的正反馈效应。根据Volz 等[3]的报道,高糖能够促进心肌细胞、心脏成纤维细胞、巨噬细胞HMGB1 表达增高,HMGB1 作为一个重要的炎症介质和炎症调节因子可能是糖尿病引起炎症反应的一个新的分子机制。本研究结果亦表明高糖能够促进小鼠心脏成纤维细胞HMGB1 的表达。同时也发现高糖能够促进心脏成纤维细胞TGF-β1 的表达,与Tokudome 等[6]的研究结果一致。心肌纤维化在DCM 的发生发展中起着不可忽视的作用,TGF-β1能刺激成纤维细胞向肌成纤维细胞转化并促进胶原的合成与分泌,能通过抑制基质金属蛋白酶的活性和促进金属蛋白酶组织抑制剂的合成从而促进细胞外基质的沉积,能诱导结缔组织生长因子等多种促纤维化相关因子的生成,故TGF-β1 可能在DCM 的发生发展中起着不可忽视的作用。
我们使用siRNA 干扰HMGB1 的表达,高糖处理6 h 后心脏成纤维细胞的HMGB1 的表达量下降,同时TGF-β1 的表达量也下降,这说明HMGB1 可能影响高糖诱导的成纤维细胞的TGF-β1 表达。HMGB1 分泌至胞外后与胞膜上的RAGE 结合,通过p38 MAPK、c-Jun N 端激酶(JNK)、细胞外信号调节激酶1 和2(ERK1/2)等途径活化下游的核因子κB(NF-κB),促进TNF-α、IL-1、IL-6 等多种细胞因子的释放[7]。TNF-α 能够刺激肺成纤维细胞TGF-β1 表达增高[8],故对于高糖培养的心脏成纤维细胞,HMGB1 有可能通过TNF-α 促进TGF-β1 的表达,这能在一定程度上解释我们的实验结果,但确切的机制还需进一步研究。
综上,心脏成纤维细胞在高糖培养下HMGB1、TGF-β1 表达增高,siRNA 干扰HMGB1 后TGF-β1表达下降,提示HMGB1 可能参与了高糖培养时心脏成纤维细胞表达TGF-β1 的调节,这可能是糖尿病时心脏纤维化的重要机制之一。因此针对HMGB1 的治疗措施可能有助于抑制糖尿病心肌病的心脏纤维化。未来还需要进一步研究在糖尿病动物模型中是否也存在HMGB1 对TGF-β1 表达的影响。
[1]Voulgari C,Papadogiannis D,Tentolouris N. Diabetic cardiomyopathy:from the pathophysiology of the cardiac myocytes to currentdiagnosis and management strategies[J]. Vasc Health Risk Manag,2010,6:883-903.
[2]Yao D,Brownlee M.Hyperglycemia-induced reactive oxygen species increase expression of the receptor for advanced glycation end products (RAGE)and RAGE ligands[J]. Diabetes,2010,59(1):249-255.
[3]Volz HC,Seidel C,Laohachewin D,et al. HMGB1:the missing link betweendiabetes mellitus and heart failure[J]. Basic Res Cardiol,2010,105(6):805-820.
[4]Dobaczewski M,Chen W,Frangogiannis NG. Transforming growth factor (TGF)-β signaling in cardiac remodeling[J]. J Mol Cell Cardiol,2011,51(4):600-606.
[5]Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science,1999,285(5425):248-251.
[6]Tokudome T,Horio T,Yoshihara F,et al. Direct effects of high glucose and insulin on protein synthesis in cultured cardiac myocytes and DNA and collagen synthesis in cardiac fibroblasts[J]. Metabolism,2004,53(6):710-715.
[7]Yeh CH,Sturgis L,Haidacher J,et al.Requirement for p38 and p44/p42 mitogen-activated protein kinases in RAGEmediated nuclear factor-kappaB transcriptional activation and cytokine secretion[J]. Diabetes,2001,50(6):1495-1504.
[8]Sullivan DE,Ferris M,Nguyen H,et al. TNF-α induces TGF-β1-expression in lung fibroblasts at the transcriptional level via AP-1 activation[J]. J Cell Mol Med,2009,13(8B):1866-1876.

