两种乳源切达干酪成熟期间蛋白质降解状况对比
梁晓琳 白文娟 李冠霖 谢 毅 李全阳,2
LIANG Xiao-lin1 BAIWen-juan1 LIGuan-lin1 XIE Yi1 LIQuan-yang1,2
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.广西食品药品安全评价人才小高地建设载体单位—广西大学食品质量与安全研究中心,广西 南宁 530005)
(1.College of Light Industry and Food Engineering GuangxiUniversity,Nanning,Guangxi530004,China;2.Carrier of Guangxi Food and Drug Safety Evaluation Elite Group-Food Quality and Safety Research Center of GuangxiUniversity,Nanning,Guangxi530005,China)
切达干酪(cheddar cheese)是一种半硬质的成熟型干酪,颜色从白色到浅黄,产量居世界第一,是世界上最受欢迎的干酪之一,独特的切达化过程赋予了特定的质地和功能特性[1],与其他干酪相比,切达干酪清淡的口感也更受中国人青睐。
干酪的成熟对干酪最终的品质有极大的影响,在切达干酪的成熟过程中,蛋白质的水解是发生得最多的生化反应,且影响干酪的滋味;而脂肪的水解发生相对较少,其更多的是影响干酪的风味。干酪成熟过程中蛋白质的水解开始于αs1-酪蛋白的水解和β-酪蛋白的降解,其中产生的一些游离氨基酸在凝乳酶的作用下会形成某些风味化合物。所以在整个切达干酪成熟的过程中,蛋白质的降解是非常重要的,国内外人员对其进行了大量的研究。Sousa等[2]综述了在干酪成熟期间对蛋白质降解进行研究的进展。Roberto等[3]研究了升高初始成熟温度对Reggianito奶酪蛋白质降解的影响。Larsson等[4]分析了用微滤的原料乳生产的干酪的蛋白质降解情况。Costabel等[5]研究了用不同的工艺生产的mozzarella奶酪的蛋白质降解状况。Gaiaschi等[6,7]用αs-酪蛋白和β-酪蛋白的降解情况作为Grana Padano奶酪成熟的标志。张富新等[8]研究了羊奶干酪成熟期间的蛋白质降解情况。邹鲤岭等[9]发现:切达干酪在成熟过程中pH 4.6-SN、12%TCA-SN和5%PTA-SN都上升,蛋白氮和酪蛋白氮逐渐降低,多肽氮上升和下降交替出现。刘会平等[10]探索了Mozzarella干酪成熟期间蛋白质的降解。但是很少有对以水牛乳为原料生产的切达奶酪成熟期间蛋白质降解情况进行研究的报道。
本研究以中国水牛乳为原料生产的切达干酪为研究对象,用荷斯坦牛乳的切达干酪做对照,对二者在不同成熟条件下成熟过程中(3种成熟温度:4,10,20℃和4个成熟阶段:0,30,60,90 d)蛋白质降解情况进行对比。为揭示中国水牛乳切达干酪的特殊性提供理论基础,为指导有关干酪制品的生产提供理论指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
中国水牛乳切达干酪和荷斯坦牛乳切达干酪:本实验室自制;
三氯乙酸(TCA)、磷钨酸(PTA)等:分析纯,国药集团化学试剂有限公司。
1.1.2 仪器
全自动凯式定氮仪:K9860型,济南海能仪器有限公司;
台式高速冷冻离心机:TL-18M型,上海市离心机械研究所;
摇床:TS-1000型,江苏海门其林贝尔仪器制造有限公司;
电泳仪:Mini-Protean 3型,美国伯乐公司。
1.2 方法
测定在3种成熟温度(4,10,20℃)和 4个成熟阶段(0,30,60,90 d)两种切达干酪的蛋白质降解情况,其中 B-代表中国水牛乳切达干酪,H-代表荷斯坦牛乳切达干酪。各指标测定方法如下。
1.2.1 蛋白质含量测定 采用凯氏定氮法,参照GB 5009.5——2010。
1.2.2 总氮(TN)测定 称取约 1~2 g干酪样品,精确至0.000 1 g,使用凯式定氮法测定含氮量[11]。
1.2.3 磷钨酸可溶性氮(PTA-SN)测定 水溶性氮样品(WSN)处理按参考文献[12]进行。
取上述WSN 10mL,再加入330 g/L的磷钨酸溶液3mL和3.95mol/L的硫酸溶液7mL。混匀4℃过夜后过滤,用凯式定氮法测定含氮量,表示为占总氮百分比。
1.2.4 三氯乙酸可溶性氮(TCA-SN)测定 取240 g/kg的三氯乙酸溶液25 mL加入到25 mL的WSN溶液中,混匀后室温自然放置2 h再过滤,测定其含氮量表示为占总氮的百分比。
1.2.5 pH 4.6可溶性氮(pH 4.6-SN)测定 称取研碎干酪20 g加入40mL蒸馏水混合后均质5min。用稀盐酸将均质后的匀浆调至pH 4.6再40℃水浴1 h,水浴后离心20 min(3 000×g)。将离心后的液体去除浮在上层的脂肪后过滤,测定含氮量,表示为总氮的百分比。
2 结果与讨论
2.1 蛋白质含量的变化
不同贮藏条件下两种干酪蛋白质含量变化结果见表1。
由表1可知,在成熟期90 d内,两种原料制作的干酪的蛋白质含量都随时间的延长呈下降趋势,其中中国水牛乳切达干酪在3种成熟温度下,下降范围约为1.3%~3.6%,荷斯坦牛乳干酪在3种成熟温度下蛋白质含量下降约为2.0%~3.0%,显然中国水牛乳干酪蛋白质的下降百分比高于荷斯坦牛乳干酪,且温度越高下降量越大。除4℃成熟30 d内的中国水牛乳干酪外,其余的干酪在不同的成熟时期内蛋白质含量差异显著(P<0.05)。

表1 干酪成熟过程中蛋白质含量变化覮Table1 The change of protein during ripening
2.2 磷钨酸可溶性氮(PTA-SN)含量变化
干酪成熟过程中PTA-SN含量变化的结果见图1。

图1 干酪成熟过程中PTA-SN含量变化Figure 1 The change of PTA-SN content during ripening
由图1可知,随着成熟时间的延长,两种原料制成的切达干酪的PTA-SN含量逐渐增加,和成熟初期相比,最终含量增加了约为2%~5%,PTA-SN含量前30 d内增加较快,30~90 d增势变缓。并且随着成熟温度的提高,PTA-SN的增量也越多,在20℃成熟时,在成熟期的前30 d,水牛乳干酪PTA-SN增加了6.36%,荷斯坦牛乳干酪的PTA-SN增量为3.79%,前者约为后者的两倍,这也许是因为中国水牛乳中非发酵剂肽酶比荷斯坦牛乳中高。由图1曲线可以看出,在成熟末期,中国水牛乳切达干酪的PTA-SN含量显著高于荷斯坦牛乳干酪,并且不仅是同一温度下含量更高,尤其值得注意的是在4℃下成熟的中国水牛乳干酪的PTA-SN含量都高于在20℃下成熟的荷斯坦牛乳干酪。PTA具有很强的辨别能力,因此PTA-SN被作为用于评价干酪中游离氨基酸含量的指标,干酪中分子量小于600 Da的肽和氨基酸(赖氨酸、精氨酸除外)都会溶于5%PTA,而分子量大于600 Da则会沉淀出来[13]。Voigt等[14]也报道了用不同压力处理的原料乳生产的切达干酪其成熟期内PTA-SN含量上升。所以可以看出,中国水牛乳切达干酪中的蛋白质在成熟期间降解的程度更大,说明中国水牛乳蛋白对蛋白酶更加敏感,容易水解消化。
2.3 三氯乙酸可溶性氮(TCA-SN)含量变化
两种原料制成的干酪在成熟期间TCA-SN含量变化结果见图2。
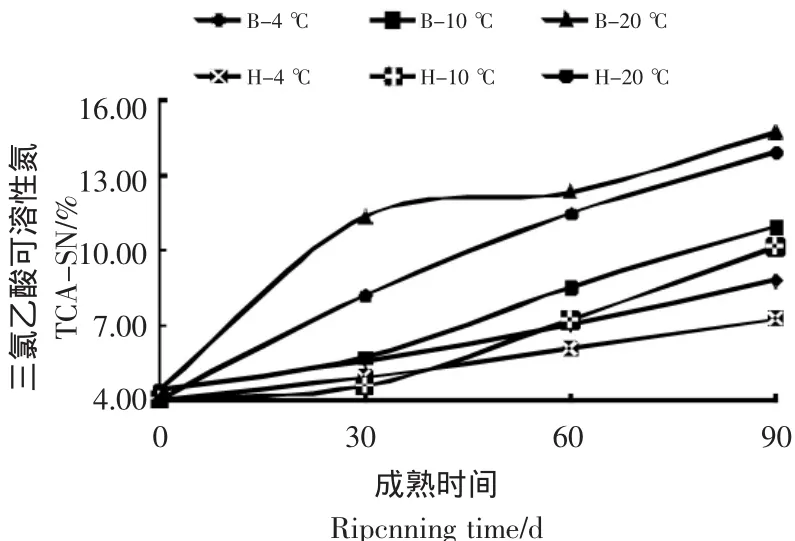
图2 干酪成熟过程中TCA-SN含量变化Figure 2 The change of TCA-SN content during ripening
由图2可知,两种干酪的12%TCA-SN含量随成熟时间的延长而逐渐增加,增加量约为1%~10%,并且发现在同一成熟温度下中国水牛乳干酪的12%TCA-SN高于荷斯坦牛乳干酪。其中在20℃成熟时,前90 d内TCA-SN变化显著,中国水牛乳干酪和荷斯坦牛乳干酪比初期分别增加了10.26%和9.48%。与前述的PTA-SN变化趋势不同,其在30 d内变化十分缓慢,说明较高的温度使得蛋白质进一步降解。TCA-SN组分传统上被认为是“成熟深度”的指标[15]。Mallatou[3]研究的羊乳Teleme奶酪也有类似的变化趋势,正因为其是成熟深度的标志,所以越到后期,含量变化越显著,在本研究中到成熟中后期30~90 d阶段时,各样品之间的差异变得显著。
2.4 pH 4.6可溶性氮(pH 4.6-SN)含量的变化
pH 4.6可溶性氮含量变化的结果见图3。
由图3可知,在90 d成熟过程中,两种原料制成的干酪,其pH 4.6-SN都呈上升趋势,最终增加量约为5%~10%,且在60 d内含量变化较小,在60~90 d内含量迅速增加,其中20℃成熟温度下增加得最多,10℃和4℃成熟温度下依次递减。同一温度下,两种干酪对比,除20℃外均是中国水牛乳干酪的pH 4.6-SN含量更高,Fox等[16]认为是更高的盐浓度影响了β-酪蛋白的降解。本实验室前期的研究也发现中国水牛乳干酪的最终盐分显著高于荷斯坦牛乳干酪,而20℃的情况则可能是温度对其的影响已经超过了盐分。干酪成熟过程中pH 4.6-SN的形成反映了蛋白水解速率和程度,一般被认为是蛋白“水解广度”的一种指标,是干酪成熟程度的一种标志。pH 4.6-SN含有中分子量的肽和氨基酸,这些化合物均为酪蛋白水解产物[17]。pH 4.6-SN主要是酪蛋白被凝乳酶和牛乳蛋白酶降解而形成的,此外,一些NSLAB(非发酵剂乳酸菌)也会促使可溶性氮的形成,而较高的成熟温度对凝乳酶和血纤维蛋白溶酶有更大的影响[18]。Francisco等[19]研究发现山羊奶酪在成熟的不同时期其pH 4.4-SN也呈上升趋势。在成熟期30 d内,Cacioricotta奶酪的可溶性氮含量也显著增加[20]。这都与本试验结果有相似的变化趋势,但本研究的急剧变化时间在60~90 d这个区域内。M.DeWit等[21]也发现在切达干酪成熟的前120 d内,WSN占总氮的百分比含量没有显著差异,但是此后的120~150 d,其百分比含量却显著增加。说明到成熟后期时可溶性氮变化更剧烈。

图3 干酪成熟过程中pH 4.6-SN含量变化Figure 3 The change of pH 4.6-SN content during ripening
3 结论
在切达干酪的成熟过程中,蛋白质的降解对其风味及质构有很大的影响。本研究发现两种原料乳制成的切达干酪的pH 4.6可溶性氮,三氯乙酸可溶性氮,磷钨酸可溶性氮含量都呈平稳上升的趋势,且温度越高增加的量越多,最终分别上升了约5%~10%,1%~10%,2%~5%。两种干酪对比结果是中国水牛乳干酪的3种可溶性氮含量高于荷斯坦牛乳干酪,因此水牛乳干酪降解程度更深。这对于促进切达干酪在中国的发展,特别是研发附加值更高,营养价值更为丰富的水牛乳切达干酪具有重要的意义。
1 罗金斯基H,富卡JW,福克斯P F.乳品科学百科全书[M].北京:科学出版社,2009:452.
2 Sousa M J,Ardo Y,McSweeney P L H.Advances in the study of proteolysis during cheeseripening[J].International Dairy Journal,2011(11):327~345.
3 Heleni Mallatou,Eleni C Pappa,Vasiliki A Boumba.Proteolysis in Teleme cheesemade from ewes’,goats’or amixture of ewes’and goats’milk[J].International Dairy Journal,2004(14):977~987
4 Larsson M,Zakora M,Dejmek P,et al.Primary peoteolysis studied in a cast cheesemadefrom micofiltered milk[J].International Dairy Journal,2006(16):623~632.
5 Costabel L,Pauletti M S,Hynes E.Proteolysis in Mozzarella cheesesmanufactured by different industrial processes[J].Journal of Dairy Science,2007,90(5):2 103~2 112.
6 Gaiaschi A,Beretta B,Poiesi C,et al.Proteolysis ofαs-casein as a marker of grana padano cheese ripening[J].Journal of Dairy Science,2000,83(12):2 733~2 739.
7 Gaiaschi A,Beretta B,Poiesi C,et al.Proteolysis ofβ-casein as a marker of grana padano cheese ripening[J].Journal of Dairy Science,2001,84(1):60~65.
8 张富新,艾启俊.羊奶干酪成熟期间蛋白质降解的研究[J].北京农学院学报,1996,11(2):51~56.
9 邹鲤岭,李昌盛.切达干酪成熟期间蛋白质降解的研究[J].乳业科学与技术,2010(2):69~71.
10 刘会平,南庆贤,马长伟.Mozzarella干酪成熟中蛋白水解与功能特性的变化[J].农业工程学报,2006,22(6):182~187.
11 刘雅楠.蓝纹干酪加工与成熟的研究[D].天津:天津科技大学,2007.
12 Dimitra Dimitrellou,Panagiotis Kandylis,Athanasios Mallouchos.Effect of freeze-dried kefir culture on proteolysis in feta-type and whey-cheeses[J].Food Chemistry,2010(119):795~800.
13 Park YW,Jin Y K.Photolytic patterns of Caciotta and Monterey Jack hard goatmilk cheeses as evaluated by SDS-PAGE and densitometric analyses[J].Small Ruminant Research,1998(28):263~272.
14 Daniela D Voigt,Francois Chevalier,John A Donaghy,et al.Effect of high-pressure treatment ofmilk for cheesemanufacture on proteolysis,lipolysis,texture and functionality of Cheddar cheese during ripening[J].Innovative Food Science and Emerging Technologies,2012(13):23~30.
15 Freni K Tavariaa,Inmaculada Francob,F Javier Carballo.Amino acid and soluble nitrogen evolution throughout ripening of Serra da Estrela cheese[J].International Dairy Journal,2003(13):537~545.
16 Fox PF,Walley B F.Influence of sodium chloride on the proteolysis of casein by rennet and by pepsin[J].Journal of Dairy Research,1971(38):165~170.
17 Roberto JCeruti,Susana E Zorrilla,Guillermo A Sihufe.The influence of elevated initial ripening temperature on the proteolysis inReggianito cheese[J].Food research international,2012(48):34~40.
18 Shakeel-Ur-Rehman,Banks JM,McSweeney P L H.Effect of ripening temperature on the growth and significance of non-starter lactic acid bacteria in Cheddar cheese made from raw or pasteurisedmilk[J].International Dairy Journal,2000(10):45~53.
18 Francisco JoséDelgado,JoséGonzález-Crespo,Ramón Cava,et al.Changes in microbiology,proteolysis,texture and sensory characteristics of raw goatmilk cheeses treated by high-pressure at different stages ofmaturation[J].LWT-Food Science and Technology,2012(48):268~275.
20 Faccia M,Picariello G,Trani A,et al.Proteolysis of Cacioricotta cheesemade from goatmilk coagulated with caprifig (Ficus carica sylvestris)or calf rennet[J].Eur Food Res Technol,2012(234):527~533.
21 DeWit M,Osthoff G,Viljoen B C.A comparative study of lipolysis and proteolysis in Cheddar cheese and yeast-inoculated Cheddar cheeses during ripening[J].Enzyme and Microbial Technology,2005(37):606~616.

