半枝莲多糖提取工艺优化
黄秀香 覃 玥 黄艳梅
HUANG Xiu-xiangQIN YueHUANG Yan-mei
(河池学院化学与生命科学系,广西 河池 546300)
(Departmentof Chemistry and Life Science,Hechi University,Hechi,Guangxi546300,China)
半枝莲(Scutellaria barbata D.Don)为唇形科黄芩属植物,主产于江苏、浙江、福建、广西和广东等地,全草入药。具有解热、抗癌、免疫调节等药理作用[1]。半枝莲中的化学成分主要含有生物碱、糖类及黄酮类化合物[2]。多糖是半枝莲中一种重要的活性成分,对半枝莲多糖的提取工艺研究并不多见,而采用超声波协同复合酶法提取半枝莲多糖更是少见。由于超声波有独特的机械效应、热学效应及空化效应,以及其粉碎和搅拌的特殊作用[3];复合酶对降解细胞壁,不仅有利于多糖的溶出,还可以降低溶液的黏度,从而提高多糖得率,所以本试验利用超声波协同复合酶法提取半枝莲多糖。
1 材料与方法
1.1 材料与试剂
半枝莲干品:购自广西宜州市;
葡萄糖标准品:汕头市西陇化工厂;
铝片、无水乙醇、95%乙醇、苯酚、碳酸氢钠、浓硫酸、石油醚(60~90℃)、活性炭、柠檬酸、磷酸氢二钠:分析纯,汕头市西陇化工厂;
纤维素酶:活性≥1 800 U/mg,上海源叶生物科技有限公司;
果胶酶:活性≥1 000 U/mg,上海源叶生物科技有限公司。
1.2 主要仪器
微型植物粉碎机:FZ102型,天津市泰斯特仪器有限公司;
紫外分光光度计:UV-2501型,日本岛津公司;
精密pH计:PHS-25型,上海精密科学仪器有限公司;
电子天平:AL204型,奥豪斯仪器有限公司;
数控超声波清洗器:KQ2200DE型,昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 半枝莲多糖提取工艺
(1)材料预处理:称取试样半枝莲粉末,按照料液质量体积比为1∶3的比例加入石油醚(60~90℃)浸渍4~5 h,脱脂处理,然后进行减压抽滤,收集滤渣,置烘箱中,在50℃的条件下烘干,12 h后取出,放入干燥器内备用。
(2)提取工艺流程:
称取半枝莲粉末(10 g)→加100mL蒸馏水→调节pH 4.5→加复合酶(纤维素酶与果胶酶质量比为1∶1)0.020 g→50℃酶解30 min→超声波作用20 min→沸水浴灭酶→抽滤→脱色→抽滤→95%乙醇沉淀→静置过夜→洗涤→烘干→得粗多糖→20 mL蒸馏水溶解(50℃)→浓缩(去杂)→乙醇沉淀→无水乙醇洗涤→得精多糖
1.3.2 标准葡萄糖溶液的配制 精密称取在105℃干燥至恒重的葡萄糖100mg,加蒸馏水溶解,转移到100mL的容量瓶中,定容至刻度,摇匀,备用。
1.3.3 苯酚—硫酸法葡萄糖标准曲线的制作 根据文献[4],得回归方程:A=12.121C+0.008 1(r=0.999 6),线性范围0.005~0.015mg/mL,符合线性关系。
1.3.4 换算因子的测定 精密称取半枝莲多糖121 mg于100 mL容量瓶中,加少量蒸馏水溶解并稀释至刻度,摇匀。精密吸取配置好的多糖溶液 4.0,6.0,8.0,10.0,12.0 mL 于50mL容量瓶中,定容后从中分别吸取2 mL于比色管中,再加入1 mL新配置的5%苯酚和5 mL浓硫酸,振荡,静置30min后测量其吸光度[5]。按式(1)计算换算因子:

式中:
f——换鼻因子;
W——称取多糖的质量,mg;
C——多糖中葡萄糖的质量浓度,mg/mL;
D——半枝莲多糖的稀释倍数。
经过式(1)求得换算因子为2.70。
1.3.5 多糖得率的计算方法 多糖得率按式(2)计算:

式中:
R——多糖得率,%;
C——半枝莲多糖溶液中葡萄糖的质量浓度,mg/mL;
D——多糖溶液的稀释倍数;
f——换算因子;
W——半枝莲样品的质量,mg。
1.3.6 半枝莲多糖提取单因素条件的研究
(1)pH对多糖得率的影响:准确称取2.000 0 g半枝莲粉末,蒸馏水做提取剂,料液比1∶40(m∶V),并摇匀,分别调节pH 为 4.0,4.5,5.0,5.5,6.0,加入酶量 0.015 g(纤维素酶与果胶酶质量比为1∶1),在50℃水浴下酶解30 min,超声20min后,沸水浴灭酶10 min,抽滤,用活性炭脱色,减压抽滤,收集滤液,将滤液转移到容量瓶中,加入蒸馏水定容,按方法1.3.3测其吸光度,计算多糖得率。
(2)复合酶量对多糖得率的影响:准确称取干燥半枝莲粉 末 2.000 0 g,pH 4.5, 酶 量 0.010,0.015,0.020,0.025,0.030 g(纤维素酶与果胶酶质量比为1∶1),按方法1.3.6(1)提取半枝莲多糖,计算得率。
(3)料液比对多糖得率的影响:准确称取干燥半枝莲粉末2.000 0 g,pH 4.5,酶量0.020 g(纤维素酶与果胶酶质量比为 1∶1),料液比 1∶10,1∶20,1∶30,1∶40,1∶50,1∶60(m∶V),按方法1.3.6(1)提取半枝莲多糖,计算得率。
(4)超声时间对多糖得率的影响:准确称取干燥半枝莲粉末2.000 0 g,pH 4.5,酶量0.020 g(纤维素酶与果胶酶质量比为 1∶1),料液比 1∶20(m∶V),超声时间10,15,20,25,30,35min,按方法1.3.6(1)提取半枝莲多糖,计算得率。
(5)酶解温度对多糖得率的影响:准确称取干燥半枝莲粉末2.000 0 g,pH 4.5,酶量0.020 g(纤维素酶与果胶酶质量比为 1∶1),料液比 1∶40(m∶V),超声时间 20min,酶解温度30,40,50,60,70 ℃,按方法 1.3.6(1)提取半枝莲多糖,计算得率。
2 结果与分析
2.1 单因素提取半枝莲多糖的结果
2.1.1 pH对多糖得率的影响 由图1可知,pH在4.0~5.0条件下,酶活性逐渐升高,与底物作用的速度加快,当pH值达到5.0时,多糖的得率达到最大值;随着pH值继续增大,多糖的得率开始下降。这可能是因为pH值过高或过低都会影响酶的活性,从而造成多糖得率的下降。
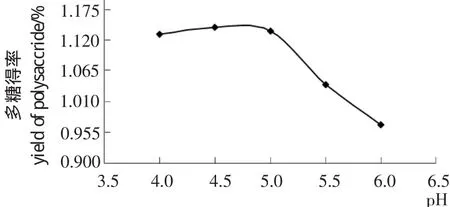
图1 pH对多糖得率的影响Figure 1 Effectof pH on the extraction yield
2.1.2 复合酶量对多糖得率的影响 由图2可知,随着复合酶量的增加,复合酶与底物接触机会增加,多糖得率随之升高;复合酶量大于0.020 g时,得率开始下降。这可能是由于当酶含量升高到一定程度,酶分子过于饱和,一部分没有机会与底物结合,酶解速度降低[6],得率下降。
2.1.3 料液比对多糖得率的影响 由图3可知,料液比为1∶20~1∶40(m∶V)时,多糖得率随溶剂量比例的增大而升高,之后继续增大料液比,酶浓度降低,酶与底物的结合不充分,多糖得率下降。
2.1.4 超声时间对多糖得率的影响 由图4可知,半枝莲多糖的得率随超声时间的增加,有所提高,20min后,多糖得率呈现下降。因为长时间超声会使多糖分子在超声波的剪切作用下发生破坏或降解。

图2 复合酶用量对多糖得率的影响Figure 2 Effectof compound enzyme dosage on the extraction yield

图3 料液比对多糖得率的影响Figure 3 Effect of ratio of scutellaria barbata D.Don to ethanol on the extraction yield
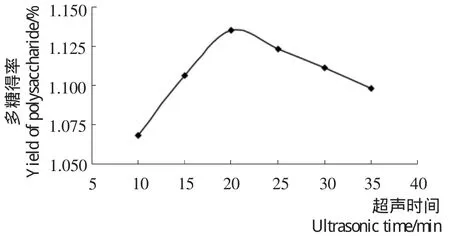
图4 超声时间对多糖得率的影响Figure 4 Effectof ultrasonic time on the extraction yield

图5 酶解温度对多糖得率的影响Figure 5 Effectof enzymolysis temperrature on the extraction yield
2.1.5 酶解温度对多糖得率的影响 由图5可知,多糖得率随着酶解温度的增高而逐渐增大,50℃时,多糖得率达最大,而后,随酶解温度增高呈现下降。这是由于酶的活性与温度有着密切的关系,每一种酶都有特定的最适温度。若温度继续升高,酶在高温下出现变性,酶活力逐渐下降,反应速度降低,多糖得率下降[6]。
2.2 正交试验设计
影响超声波协同复合酶提取的主要因素为pH、复合酶量、料液比、超声波时间、酶解温度,以多糖得率为考察指标,由单因素试验初步筛选出5个单因素的取值范围(见表1),利用L16(45)正交正交试验,确定最佳提取工艺。
由表2、3可知,各因素对半枝莲多糖得率的影响程度强弱为料液比>超声时间>复合酶量>pH>酶解温度。通过极差分析可知最优工艺组合为A2B4C4D1E3,即pH 4.5,复合酶量0.025 g,料液比 1∶60(m∶V),超声时间 15 min,酶解温度50℃,其中料液比对试验的影响显著。
2.3 最佳工艺的验证实验
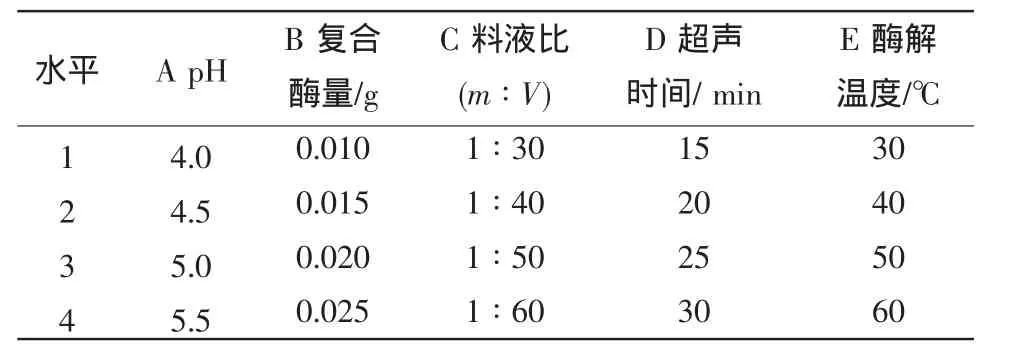
表1 正交试验因素水平表Table1 Orthogonal factor level table
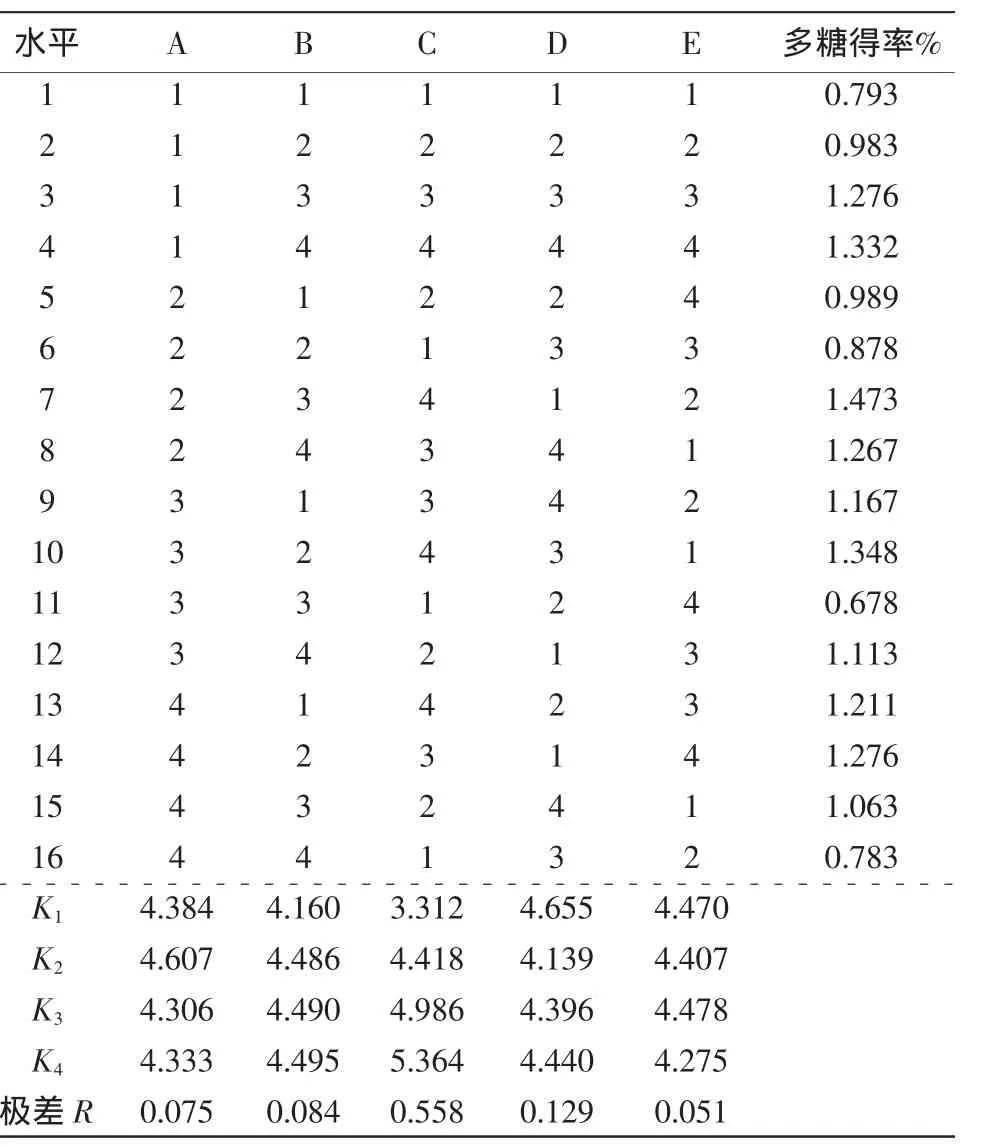
表2 正交设计结果Table2 The resultof orthogonal design
按该工艺的最佳提取条件A2B4C4D1E3,进行5次验证实验,测得多糖的平均得率2.166%,优于正交试验中的任何一组,RSD为0.005%,说明提取工艺可行。
2.4 稳定性试验
取样品溶液2.0mL,按1.3.3中标准曲线法的操作方法于室温条件下每隔20min测定1次吸光度值,重复做6次,结果发现此样品溶液放置100min内基本稳定,相对标准偏差RSD=0.014%,结果见表4。
表3 方差分析结果Table3 Analysis of variance orthogonal design

表3 方差分析结果Table3 Analysis of variance orthogonal design
F0.10(3,3)=9.28,F0.01(3,3)=29.46。
偏差来源 自由度F值ABCDE离差平方和0.014 0.020 0.736 0.034 0.007 33333均方0.005 0.007 0.246 0.011 0.002 2.500 3.500 123.0 5.500显著性不显著不显著显著不显著
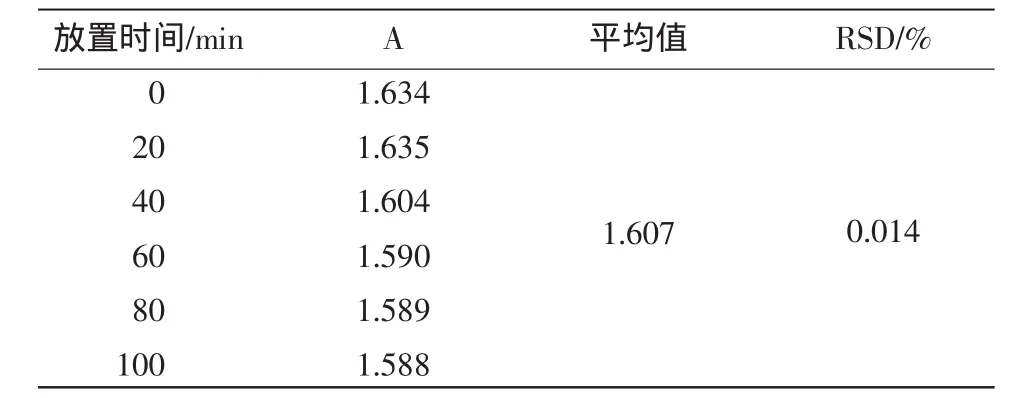
表4 稳定性试验结果Table4 Results of test stability
2.5 加样回收率试验
精密移取已知含量的半枝莲粗多糖样品溶液1 mL 6份,别置于6个25mL容量瓶中,分别加入葡萄糖标准溶液1mL,按方法1.3.3测定其吸光度,计算回收率。由表5可知,在A2B4C4D1E3条件下,样品加样平均回收率为90.918%,RSD为2.168%,说明此方法具有较好的加样回收率。
3 结论
本试验采用超声波协同复合酶法提取,用正交试验的方法对半枝莲水溶性多糖的提取工艺进行了优化研究,采用苯酚—硫酸法测定半枝莲多糖的得率,结果表明,料液比对多糖得率的影响最大,其次是超声时间,然后是复合酶量,再次是pH,酶解温度影响最小。其最优工艺组合为pH 4.5,复合酶量0.025 g,料液比为1∶60(m∶V),超声时间15min,酶解温度50℃,该条件下多糖得率为2.166%,而且该提取工艺稳定性、重复性良好。

表5 加样回收率试验结果Table5 Results of test recover
超声波协同复合酶提取半枝莲多糖,超声波能产生较大剪切力,再加上复合酶的酶解作用,从而使得半枝莲细胞壁破裂,加速活性成分多糖的溶出,从而提高得率。该法具有条件温和、节能、省时、操作简单等优点[7],具有一定的推广意义。
1 蒋小岗,顾振纶.半枝莲的化学成分和药理作用[J].中国野生植物资源,2004,23(1):3~5.
2 谭永红,王诗华,梁容梅.中药半枝莲的研究进展[J].西南国防医药,2002(12):152~153.
3 杜柯,孙润广,赵凯.超声波在中药多糖提取中的应用[J].声学技术,2009,28(6):98~100.
4 官波,郑文诚.山药多糖提取工艺优化[J].食品与机械,2010,26(1):98~101.
5 黄秀香,赖红芳,罗丽程.超声波协同复合酶法提取半边莲多糖工艺优选[J].中国实验方剂学杂志,2012,18(5):20~22.
6 章斌,李远志,陈宇,等.复合酶法提取广佛手多糖的工艺研究[J].安徽农业科学,2010,38(15):7 833~7 835,7 873.
7 亓树艳,王荔,莫晓燕.大枣多糖的提取工艺及抗氧化作用研究[J].食品与机械,2012,28(4):117~120.

