1-L-脯氨酸-1-脱氧-D-果糖纯化研究
舒俊生 张尚明 陈开波 毛 健
SHU Jun-sheng1 ZHANG Shang-ming1 CHEN Kai-bo1 MAO Jian2
(1.安徽中烟工业有限公司技术中心,安徽 合肥 230088;2.江南大学食品学院,江苏 无锡 214122)
(1.Research and Development Centre,China Tobacco Anhui Industrial Co.,LTD,Hefei,Anhui230088,China;2.School of Food Science and Technology,Jiangnan University,Wuxi,Jiangsu 214122,China)
在卷烟中应用的许多香料具有较强的挥发性,且在抽吸过程中释放不均匀。这些香料不但造成了卷烟生产的污染,还影响了卷烟产品质量的稳定性。为了克服这些缺陷,开发非挥发性香料前体势在必行。香料前体自身没有香味,只有在高温分解后才会生成大量香味成分。许多天然植物中糖苷、糖酯、Maillard反应的中间体都是重要的天然香味前体[1-3]。1-L-脯氨酸-1-脱氧-D-果糖(1-L-proline-1-deoxy-D-fructose,PDF)是葡萄糖和脯氨酸Maillard初级反应的中间体,是一种没有香味的白色固体,在烤烟中含量较高[4]。其在高温时热解可以生成大量呋喃类、吡喃类、吡嗪类等多种香味成分,是理想的卷烟香料前体物[5]。有关1-L-脯氨酸-1-脱氧-D-果糖合成方法的文献[6,7]较多,如保护法、固相合成法等,但关于其分离纯化的研究较少。因此,本试验采用沉淀法、纳滤法和树脂法对其进行分离纯化,并对这些方法纯化得到的PDF的纯度进行比较,以确定PDF最佳的纯化方法,为非挥发性香料前体的开发奠定基础。
1 材料与方法
1.1 试剂与仪器
脯氨酸、葡萄糖:食品级,上海国药集团;
无水乙醇、异丙醇、无水甲醇、乙酸乙酯、丙酮:分析纯,上海国药集团;
1-L-脯氨酸-1-脱氧-D-果糖:纯度≥98%,凯氏(上海)科技有限公司;
旋转蒸发仪:R-215型,瑞士Buchi公司;
超滤纳滤仪:LNG-NF-101型,上海朗吉化工公司;
离子色谱仪:ICS3000型,美国Dionex公司;
超纯水器:Milli-Q型,美国密理博公司;
纳滤膜:M360型,截留分子量360 D,上海朗极化工科技有限公司;
阴离子交换树脂:201×7、SQD56和D301型,安徽皖东树脂有限公司;
阴离子交换树脂:Dowex50WX8型,陶氏化学公司。
1.2 方法
1.2.1 葡萄糖、脯氨酸及PDF离子色谱法分析 色谱条件:阴离子交换柱:CarboPac PA-1;柱温:30℃;淋洗液100 mM氢氧化钠溶液和50 mM醋酸钠溶液;流速:0.25 mL/min;进样量:10 μL;检测器:ED50;工作电极:金电极;参比电极:Ag/AgCl参比电极;分析时间:30min。
1.2.2 PDF的制备 称取葡萄糖0.3mol、脯氨酸0.6mol置于圆底烧瓶中,加入700mL无水甲醇,水浴72℃下回流7 h。
1.2.3 PDF的纯化 分别采用溶剂沉淀法、纳滤法、离子交换树脂层析法提纯PDF。
(1)溶剂沉淀法:将1.2.2制备的甲醇反应液浓缩至300mL,分别采用极性大小相近的有机溶剂丙酮、乙酸乙酯、异丙醇对目标物进行沉淀。
(2)纳滤法:将1.2.2得到的反应液中的溶剂减压蒸馏至干,加入1 L去离子水溶解。将此水溶液加入到纳滤装置的料液斗里,选用M360纳滤膜进行分离。
(3)离子交换树脂层析法:称取20 g Dowex50WX8(100~200目)树脂,使用0.5 mol/L HCl溶液活化0.5 h,湿法填柱,超纯水冲洗层析住,直至流出液pH至中性。取1.2.2反应液5 g减压挥干,10mL超纯水溶解,加入到层析柱进行分离,并收集含目标组分的滤液。
称取20 g D301树脂,使用0.5mol/L HCl活化4 h;用去离子水冲洗至中性后,用0.5mol/LNaOH溶液浸泡4 h,用去离子水冲洗至中性。201×7及SQD56阴离子交换树脂活化方法与D301树脂相同。3种树脂均采用湿法填柱。
1.2.4 PDF纯度分析 采用1.2.1的方法进行离子色谱分析,测定出葡萄糖、脯氨酸和PDF含量,计算出PDF纯度。
2 结果与讨论
2.1 葡萄糖、脯氨酸及PDF分析
糖类分子具有电化学活泼型及在强碱溶液中呈离子化状态,Rocklin等[8]报导了采用离子交换色谱柱分离,脉冲安培检测器测定糖的新方法。按照1.2.1色谱分离条件,对葡萄糖、脯氨酸和PDF进行了分离并绘制了标准曲线。由图1可知,葡萄糖、脯氨酸、PDF 3种物质得到良好的分离。葡萄糖、脯氨酸和PDF标准曲线的相关系数分别为0.999 9、0.999 9和1(图2),为后续研究奠定了基础。
2.2 PDF不同提纯方法比较
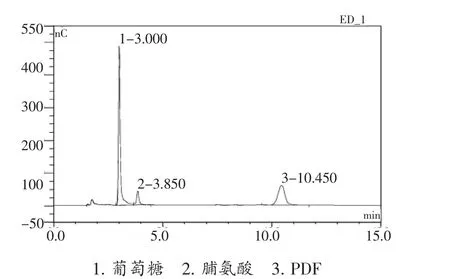
图1 葡萄糖、脯氨酸、PDF离子色谱图Figure 1 Ion chromatograph of glucose,proline and PDF
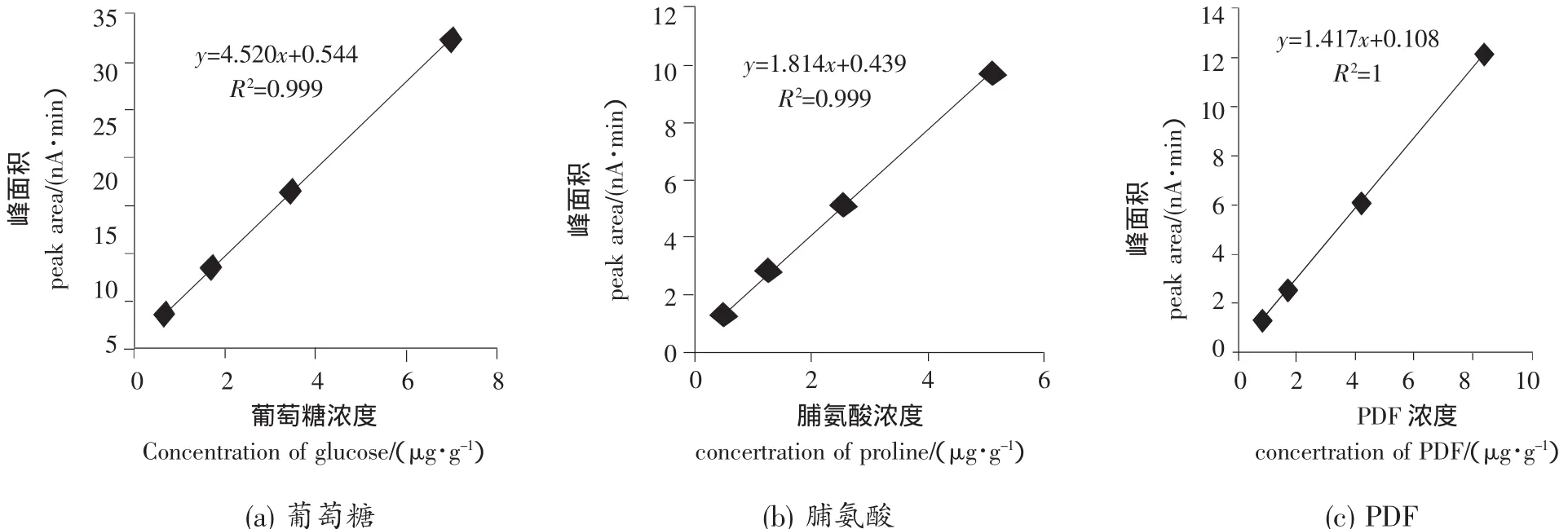
图2 葡萄糖、脯氨酸和PDF的标准曲线Figure 2 Standard curves of glucose,proline and PDF
2.2.1 溶剂沉淀法 不同的有机溶剂如丙酮、乙酸乙酯、异丙醇沉淀得到PDF的纯度不同(表1),比较后发现,采用丙酮沉淀下来的PDF混合物极容易潮解变黄,且纯度只有42%;采用乙酸乙酯沉淀得到的PDF纯度也只有35%,PDF混合物在乙酸乙酯中的溶解度较高,使得PDF不能得到很好的纯化;而采用异丙醇沉淀PDF比较理想,纯度可达62%,能有效克服上面两种沉淀溶剂的缺点。葡萄糖、脯氨酸和PDF在3种溶剂中都具有一定的溶解度,这可能是由于葡萄糖、脯氨酸和PDF都具有一定的极性,与不同溶剂间的作用力不同从而得到不同纯度的PDF。
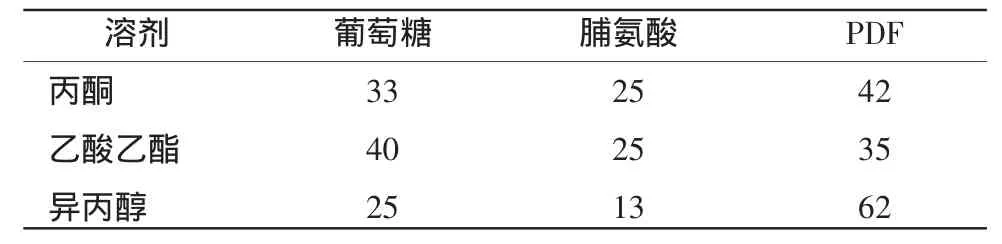
表1 溶剂对PDF纯度的影响Table1 Effectof solvent on PDF purity /%
2.2.2 纳滤法 纳滤法的起始压力为2 000 kPa,流量为18.2 L/h。本试验研究了压力和流量对PDF纯度的影响。结果表明,流量为36.4 L/h,压力2 500 kPa,PDF纯度最高,可达92%(表2)。纳滤法比溶剂沉淀法具有更高的选择性,这可能是由于葡萄糖、脯氨酸和PDF 3种化合物的分子量(分别为180.16,115.13和277.29)差别较大,因此,纳滤法比溶剂沉淀法选择性较高。
2.2.3 离子交换树脂层析法 制备PDF的反应溶液中主要含有PDF、葡萄糖、脯氨酸,在水溶液状态下,皆为带负电荷阴离子极性化合物,可以采用阴离子交换树脂进行分离纯化。本试验研究了4种阴离子交换树脂对PDF纯度的影响。201×7和Dowex50WX8为强阴离子型,而D301和SQD56为弱阴离子型。阴离子交换树脂分离后,PDF的纯度见表3。由表3可知,两种强阴离子型交换树脂对PDF的纯化效果较好,纯度高达 93%(201×7)和 97%(Dowex50WX8)。而两种弱阴离子型树脂D301和SQD56的效果较差,PDF的纯度仅为78%(D301)和 80%(SQD56)。可能是因为脯氨酸 pKa=1.99,葡萄糖pKa=12.28,PDF是二者缩合物,其pKa值介于二者之间,3种化合物pKa相差较大,因此强阴离子交换树脂能够对这3种化合物具有较高分离度。
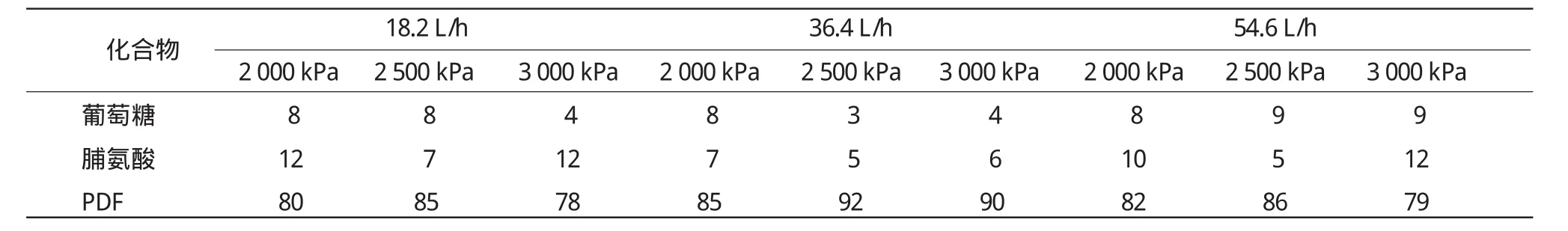
表2 纳滤流量和压力对PDF纯度的影响Table2 Effectof nanofiltration flow and pressure on PDF purity /%
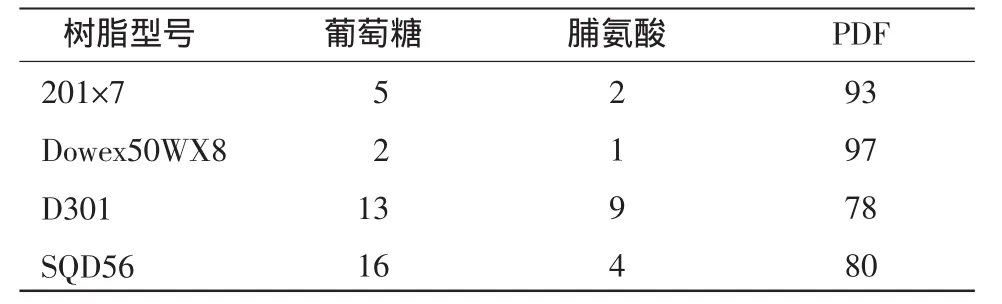
表3 不同离子树脂对PDF纯度的影响Table3 Effect of different ion resin on PDF purity /%
综合比较以上3种分离纯化方法,离子交换树脂层析法优于其他两种方法,与要分离纯化物质的特性有关,脯氨酸、葡萄糖以及PDF的PKa相差较大,有利于使用强阴离子交换树脂进行离子交换。
3 结论
近年来,关于PDF化学制备的方法较多,但缺乏对其分离纯化的研究报道。因此,本试验对PDF纯化的方法进行了研究、比较,结果发现强阴离子交换树脂可以较好的分离纯化PDF,其纯度达90%以上。这是因为PDF是带负电荷的多羟基极性化合物,且离子交换树脂具有离子交换和吸附的双重作用,能对其进行有效的分离和纯化[9]。这为非挥发性香料前体的开发提供了科学的数据。
1 张正竹,宛晓春,陶冠军.茶鲜叶中糖苷类香气前体的液质联用分析[J].茶叶科学,2005,25(4):275~281.
2 Lin Y,Wagner G J.Rapid and simplemethod for estimation of sugar esters[J].J.Agr.Food Chem.,1994,42(8):1 709~1 712.
3 Ames JM.Applications of themaillard reaction in the food industry[J].Food Chem.,1998,62(4):431~439.
4 杨金英,牟定荣,梅勇,等.HPLC-ELSD法测定烟草中的脯氨酸Amadori化合物[J].分析试验室,2010,29(8):97~100.
5 张敦铁,殷发强,何佳文.三种Amadori化合物的热解研究[J].中国烟草学报,2006(2):13~16.
6 Blank I,Devaud S,Matthey-Doret W,et al.Formation of odorants in Maillard model systems based on L-proline as affected by pH[J].J.Agr.Food Chem.,2003,51(12):3 643~3 650.
7 Frolob A,Singer D,Hoffmann R.Solid-phase synthesis of glucosederived Amadori peptides[J].J.Pept.Sci.,2007,13(12):862~867.
8 Rocklin D,Pohl C A.Determination of carbohydrate by anion exchange chromatography with pulse amperometric detection[J].Liquid Chrom,1983,6(9):1 577~1 590.
9 莫晓燕,詹谷宇,项昱红.二磷酸果糖的纯化研究[J].中国医药工业杂志,2001,32(3):100~101.

