平面波导硅基结构表面的APTES修饰研究*
王景雪,薛晨阳,刘 超,王永华,臧俊斌,韦丽萍
(1.中北大学仪器科学与动态测试教育部重点实验室,太原030051)
平面波导生物传感器是最近发展比较迅速的传感器之一。在硅基波导结构上固定功能性生物分子,使其与待测物质发生特异结合改变对波长的吸收等光学特性,进而改变谐振峰位置的偏移或大小,通过探测谐振峰的变化实现被测物的检测[1]。将功能性生物大分子键合在硅结构表面是构成平面波导生物传感器的一个关键步骤。常用的方法为通过表面修饰技术将表面改性剂以化学键键合的方式键合在硅表面,形成一层特殊的分子膜结构,用以改变结构表面的化学特性与物理特性[2-3]。
灵敏度是平面波导光学生物传感器性能指标的一项重要指标。在光栅、微环等硅基平面波导结构固定的前提下,结构表面修饰形成的生物分子膜特性成为影响其灵敏度的主要因素[4]。表面修饰作为构建平面波导生物传感器的必要步骤,优化修饰后结构表面膜层的化学物理特性显得尤为重要[5]。
3-氨丙基三乙氧基硅烷(APTES)是一种常用的表面修饰剂,通过化学键合的方式覆盖在硅结构表面形成APTES膜层,用以链接功能性生物分子[6]。将APTES溶于不同的稀释液所形成的分子膜特性不同,常用的稀释液为有机试剂甲苯、乙醇和无机试剂磷酸盐缓冲液(PBS),多篇文献对3种稀释液的应用均有报导,但是没有系统的对比3种试剂作为稀释液生成分子膜的特性。本文就3种不同性质的配液进行研究,通过对接触角、RMS、XPS的研究分析,表面修饰产生APTES分子膜层的特性的对比,选择合适的试剂作为APTES的配液,优化器件表面生成APTES膜的特性,降低结构表面微粗糙度,为提高平面波导生物传感器灵敏度奠定实验基础。
1 实验部分
1.1 实验原理
3-氨丙基三乙氧基硅烷(APTES)分子两端含有化学性质不同且具有两亲性的两种基团:一端为硅烷基,可以与硅表面的羟基(—OH)发生化学反应,形成强固的化学键合,将APTES固定在硅结构表面;另一端为极性氨基基团,具有很好的反应活性,可以与有机分子发生化学反应或物理缠绕,从而将两种性质不同的材料牢牢的结合在一起[7]。
硅是一种较为活泼的半导体材料,在自然界中会发生氧化形成一层厚度约为0.6 nm的氧化硅层[8],利用双氧水的强氧化性可以加厚氧化层的厚度。在氧化硅上修饰APTES通常有两种方法:液相修饰法和凝胶溶胶法[9],本文采用的是液相修饰法。
液相修饰法是在液体环境下对样品进行表面修饰的一种常用方法。在水环境下,APTES先发生水解反应:

生成的Si—OH进而与氧化硅表面的Si—OH发生缩水反应,最终生成Si—O—Si键。APTES水解后相互之间会发生缩水反应:
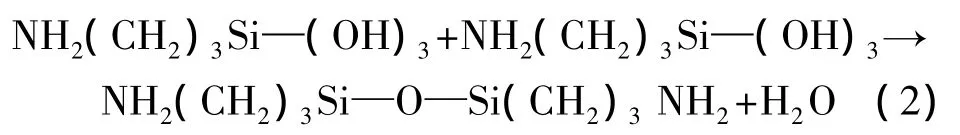
生成不规则的多分子层。在没有水的有机环境中,APTES直接与氧化硅表面的—Si—OH发生缩醇反应:
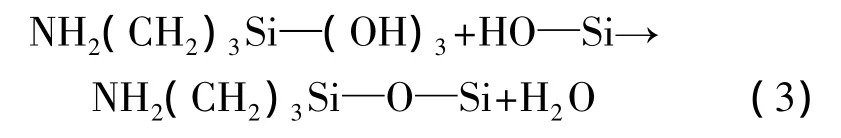
形成Si—O—Si键将APTES键合在氧化硅表面。
1.2 实验原料与试剂
3-氨丙基三乙氧基硅烷(APTES),分析纯,Fluck公司;磷酸二氢钠、磷酸氢二钠,分析纯,国药集团化学试剂有限公司;戊二醛(GA),浓度50%,分析纯,国药集团化学试剂有限公司;无水乙醇,分析纯,上海振兴化工厂;双氧水,浓度30%,分析纯,国药集团化学试剂有限公司;浓硫酸,分析纯,西陇化工股份有限公司;甲苯,分析纯,沈阳市新化试剂厂;所用水溶液均为18 MΩ去离子水。
1.3 测试仪器
接触角测定仪,JC-2000CD,北京中仪远大科技有限公司;原子力扫描探针显微镜,CSPM5000,中国本原纳米仪器公司;XPS能谱分析仪,AXIS Ultra,英国Kratos公司。
1.4 实验过程
(1)表层硅氧化:将1 cm×1 cm大小的硅片置于双氧水溶液中,80℃水浴加热5 h,表面形成一层(6±1)nm的氧化硅层。
(2)羟基化:将样品放置于配置好的食人鱼溶液(浓硫酸∶双氧水=4∶1 v/v)中,80℃水浴加热10 min[10],样品表面分子末端形成亲水性羟基,标记为“羟基化”。
(3)分子膜淀积:分别将样品放置在装有不同溶液(APTES∶PBS=1 ∶20 v/v;APTES ∶乙醇=1 ∶15 v/v;APTES∶甲苯=1 ∶15 v/v[11-12])的烧杯中,振荡反应4 h,APTES以化学键的形式键合在样品表面。取出样品后真空80℃放置2 h,使分子横向交联,取出分别放标为“PBS”、“乙醇”、“甲苯”,以备后续测试。
2 结果与讨论
2.1 接触角分析
接触角是指在气液固三相交叉处所做的气液界面的切线穿过液体与固液界线之间的夹角,用来测量样品的润湿程度,并从侧面反映样片表面分子末端的基团属性及含量。接触角大,表明样品表面分子末端亲水性基团少,反之则亲水性基团多。对样品接触角的测试可以判定表面修饰后样品表面分子的末端基团进行定性及半定量分析[13]。此次实验测试方法为悬滴法,测试条件为室温(20±1)℃、相对湿度50% ~60%,选取蒸馏水为测定液。
由经过双氧水氧化过后,硅片表面氧化硅层出现羟基,经测得接触角为53.13,呈现为亲水性(如表1所示);利用浓硫酸以及双氧水混合溶液的强氧化性使得表面的羟基浓度变大,接触角进一步降低。APTES一端为—OH,与样品表面的—OH发生缩水反应,使得另一端的氨基裸露于表面,亲水性下降,表现为接触角变大。无机溶液(PBS)为稀释液时接触角最大,为89.04;利用有机稀释液(甲苯、乙醇)接触角较小,两者差距不大(67.11、65.61)。

图1 接触角测试图

表1 接触角测试数据
2.2 微粗糙度分析
微粗糙度是指样品表面在纳米尺度内的微起伏,一般用均方根值RMS(Root Mean Square)表征。光学器件表面的RMS值严重制约器件的电光学特性及光在器件间传输的效率,因此在表面修饰过程中必须控制各个阶段样品的RMS值。
经“食人鱼”溶液对硅片羟基化处理以后,对片子进行原子力电镜扫描,测得硅片的RMS值约为0.7 nm。完成APTES于硅片表面的链接后,3种不同稀释液所生成的APTES层的RMS分别为:RMSPBS=3.4 nm、RMS乙醇=1.7 nm、RMS甲苯=2.1 nm,其三维图如图2所示,标记为PBS的硅片表面形貌比较粗糙,且有不规则成簇的突起产生,分析为APTES在无机溶液中进行水解反应后相互之间的缩合反应产生的分子团所致,相比之下甲苯的表面微粗糙度小一些,标记为乙醇的硅片表面最为平整且规则。
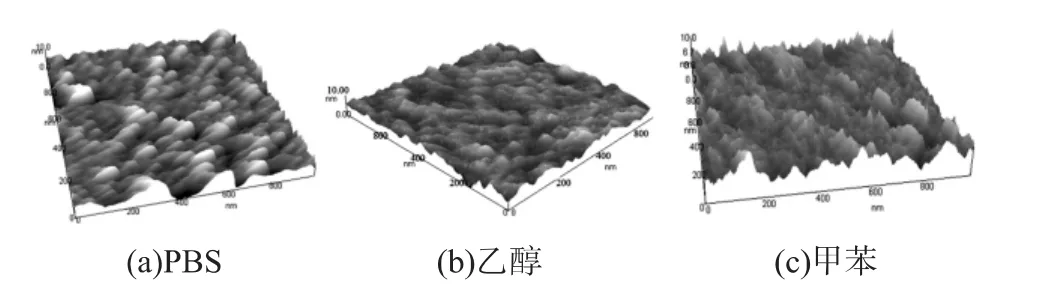
图2 原子力扫描三维图
2.3 XPS 分析
X-射线光电子能谱分析可以对样品进行定性和半定量分析,并且可对元素的存在价态做出分析,是研究APTES层中元素组成和原子状态的有效手段[14]。
羟基化后结构表面主要为Si、O元素,由于反应试剂在样品表面的残留,测试结果中含有微量的C元素,如表2所示。对样品进行APTES膜层生成后,各样品中Si的含量基本不变,O元素含量均下降,与理论缩醇反应和缩水反应相符;同时链接了APTES膜层,表面元素中出现了N元素和大量的C元素。在表2中同样可以清楚看到,不同的稀释液反应后表面C、N的含量差距较大,无机溶液PBS为APTES的稀释液时,C、N元素的含量比有机溶液(甲苯、乙醇)的样品含量高出40% ~60%,推测原因为APTES分子发生水解反应后相互之间引发缩水反应固定在样品表面引起的,这与PBS样品表面粗糙度大相符。有机试剂甲苯与乙醇之间的差距不大,标记为甲苯的样品C、N元素的含量略微比乙醇的高,O元素略低。其XPS光谱图分析见图3。
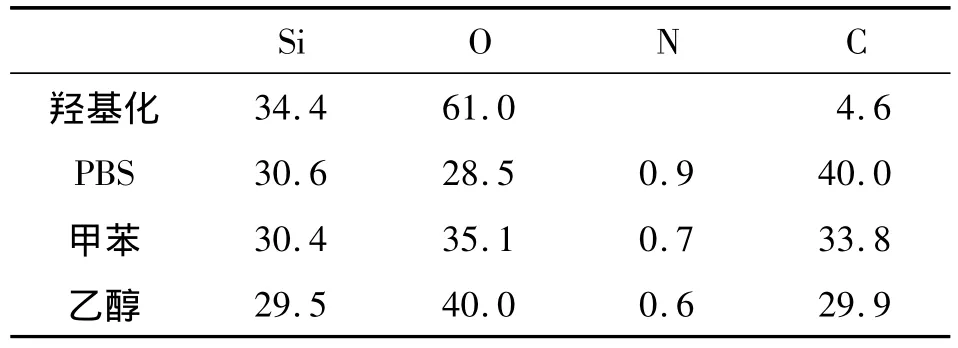
表2 XPS分析样品表面各元素含量
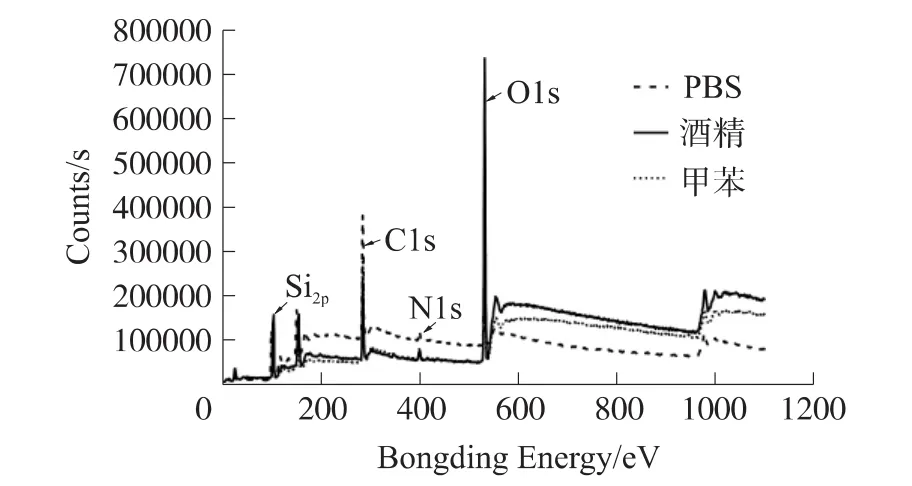
图3 XPS全元素光谱分析
利用戊二醛(GA)溶液对有机试剂样品表面膜层的活性进行实验。戊二醛分子两端均为醛基(—CHO),其一端与样品表面裸露的氨基发生键合反应,另一端—CHO裸露于样品表面,用于链接生物分子[15]。醛基是戊二醛分子的标志性基团,在结构表面APTES膜上检测醛基含量可以判定APTES膜层的活性,数量多代表膜层活性高,反之则活性较低。

图4 有机试剂C1s光谱图分析
应用XPS技术对两种样品表面C元素的结合键能分析戊二醛分子醛基的含量,两种样品的C1s谱图如图4所示。在结合键能为284.8 eV处可以看到C—C/C—H键的峰,为C元素在样品表面的主要存在方式,R—CH2—NH—(CO)—与R—CHO中的CO双键的峰出现在288.3 eV处,前者为戊二醛键合在膜层表面形成的分子结构,后者为戊二醛分子键合后裸露于样品表面的基团,测试结果中含有少量的游离戊二醛分子,在分析中给予忽略。在图4中可以看到以乙醇为稀释液的样品在288.3 eV处—CO—的峰值比较尖锐,曲线覆盖面积大,醛基结合数量较多,而甲苯的在图中显示的较为平缓,表明戊二醛分子在乙醇试剂为APTES的稀释液所生成的APTES膜上可以更好的固定。
3 结束语
光学器件结构表面的物理化学特性对光学生物传感器的敏感度有非常大的影响,如何有效降低表面粗糙度,提高表面分子膜层活性一直以来是人们关注的重点。本文从样品表面接触角、微粗糙度、元素含量及结合键能等方面,系统的对比三种不同稀释液生成分子膜层的物理化学特性。理论分析和实验数据表明,在相同的实验环境下,有机溶液乙醇作为稀释液所生成的膜层表面粗糙度仅为使用无机溶液PBS的50%,应用甲苯为稀释液效果略差于乙醇;在键合戊二醛分子后,通过XPS测试样品表面GA分子的含量对比APTES膜层表面活性,标记为乙醇的样品优于甲苯。综上所述,在硅结构表面修饰过程中以乙醇为APTES的稀释液效果为最佳,经修饰后不仅表面膜层的微粗糙度低,而且分子活性高,更适用于光学器件表面修的应用。
[1]李育红,王克逸.基于平面光波导的生物传感器[J].安徽教育学院学报,2001,19(6):23-26.
[2]单薇,廖明义.纳米SiO2的表面处理及其在聚合物基纳米符合材料中的应用进展[J].高分子通报,2006(3):1-9.
[3]姚超,高国生,林西平,等.硅烷偶联剂对纳米二氧化钛表面改性的研究[J].无机材料学报,2006(4):315-320.
[4]崔丹凤,薛晨阳,仝小刚,等.垂直纳米光栅耦合器偶和效率分析与测试[J].传感技术学报,2011(8):1131-1135.
[5]Lisa A Delouise,Peng Meng Kou,Benjiamin L Mille.Cross-Correlation of Optical Microcavity Biosensor Response with Immobilized Enzyme Activity-Insights into Biosensor Sensitivity[J].Anal Chem,2005,77:3222-3230.
[6]李玲.表面活性剂与纳米技术[M].化学工业出版社,2001.
[7]Nirmalya K.Chaki.Self-Assembled Monolayers as a Tunable Platform for Biosensor Appliacation[J].Biosensors & Bioelectronics,2002,17:1-12.
[8]储佳,马向阳,杨德仁.硅片清洗研究进展[J].半导体技术,2001,26(3):17-20.
[9]彭倚天,胡元中,王慧.碳纳米管在APTES自组装膜表面沉积的研究[J].微细加工技术,2006,8(3):54-58.
[10]Yuan Yanling,Xue Chenyang,Zhang Qiang,et al.The Production and Testing of Optical Sensor Based on SU-8 and AU-S[J].Chinese Journal of Sensors and Actuators,2012(5):589-593.
[11]Joonyeong Kim.Investigation of the Formation and Structure of APTES Films on Silicon Substrates[J].Pike Technologies,2010,4(1):47-49.
[12]谭秀民,冯安生,赵恒勤.硅烷偶联剂对纳米二氧化硅接枝改性研究[J].中国粉体技术,2011,17(1):14-17.
[13]石新颖,田学雷.金属表面有机疏水层的研究进展[J].材料导报,2010(1):76-79.
[14]Sebania Libertino,Filippo Giannazzo,Venera Aiello.XPS and AFM Characterization of the Enzyme Glucose Oxidase Immobilized on SiO2Surfaces[J].Langmuir,2008,24:1965-1972.
[15]Katrien De Vos,Irene Bartolozzi,Etienne Schacht,et al.Silicon-on-InsulatorMicroring Resonator forSensitive and Label-Free Biosensing[J].Optics Express,2007,12(15):7610-7615.

