呼出气体冷凝物中肺癌标志物采集装置的改进和优化设计*
王 林,邹莹畅,张 希,王 镝,赵 聪,王 平
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027)
有研究报道,目前癌症已经成为人类最致命的疾病之一[1]。据统计,在2012年美国新增癌症患者163万人,超过57万人死于癌症[2]。根据中国肿瘤登记中心对肿瘤监测结果显示,2012年中国新增癌症患者312万例,因癌症死亡病例达270万[3]。而肺癌是癌症中发病率和致死率排前三的恶性肿瘤,早发现、早治疗能够增加肺癌的存活率。因此如何能够快速、简便地实现肺癌的筛查成为研究重点。
呼出气体冷凝液EBC(Exhaled Breath Condensate)检测具有无创、快速、收集简单等优点[4-5],并具有一定的稳定性[6],近年来利用EBC进行疾病检测的研究成为热点。有研究表明EBC中含有氮氧化物、蛋白质、核酸等物质,这些标志物可直接和间接地反映肺癌等疾病[7-8].然而EBC至今仍然没有采集标准,ATS/ERS对EBC进行研究,建议在采集EBC时采用惰性材料,采集时间设置为10 min,并禁止唾液等的污染,同时ATS/ERS通过研究发现不同采集物质所需采集时间、温度设置等并不相同,并建议在研究中根据研究物质、研究对象的不同进行适当的参数设置[9]。
董敬军等[10]使用商品化EBC采集仪器Ecoscreen采集EBC,并检测并分析CEA的含量从而研究了不同分期、不同癌症类型EBC中CEA的水平,最终得出结论通过检测EBC中CEA可以很好地区分非小细胞肺癌不同类型及分期。他们的研究为检测EBC中CEA提供了很好的思路。我们在进行EBC中CEA采集时发现不同采集温度和采集时间对EBC采集及检测有很大的影响,而之前的研究中并未报道EBC采集CEA的最佳采集温度、最佳采集时间等信息。
目前国际上通过呼出气体冷凝物EBC中肺癌标志物(Biomarkers)进行肺癌和肺部疾病早期、无创和快速诊断[11],是一个新的研究热点。然而呼出气体冷凝物国际上尚没有统一的标准,且针对呼出气体冷凝物中不同的标志物采集标准也不相同,因此,需要进一步的改进和规范化。目前国际上商业化的EBC采集仪器主要是德国耶格公司生产的Ecoscreen采集仪,但经过预实验发现该仪器采集CEA时效率偏低,且受试者在使用该仪器进行EBC采集时会产生不适反应。基于上述问题,我们提出了EBC采集仪器改进设计方法。目前采集EBC中癌胚抗原(CEA)的研究中缺乏最佳的采集条件,如最佳采集温度、最佳采集时间等,这些都可能导致EBC中CEA测量不准确。基于以上问题我们对EBC采集装置进行改进设计。
1 EBC采集装置改进设计
EBC是通过冷凝呼出气体水蒸汽而获得,因此EBC采集装置中包含吹嘴、EBC收集器、冷凝装置等部分。不同的设计者在设计EBC采集装置时使用不同的方法,耶格公司生产的Ecoscreen是一款商业化EBC采集装置,Ecoscreen的EBC采集器主要包含以下部分:吹嘴、唾液收集器、长管及EBC收集器,如图1所示。
Ecoscreen使用了咬合式吹嘴,使得受试者能够很好地适应吹气过程,吹嘴后的唾液收集器能够很好地将唾液收集,从而很好地避免唾液受到污染。使用长管结构能够在一定程度上消除呼吸死腔的干扰,这些都是Ecoscreen的优势。目前有学者使用Ecoscreen采集EBC中的PH、H2O2、小分子有机物等物质并取得很好的效果。然而根据ATS/ERS的建议,EBC收集装置吹嘴与EBC收集器之间应尽量减小阻力,这样可以保证气路的通畅并收集更多的物质。目前,Ecoscreen仪器的主要不足是吹嘴与EBC收集器之间的距离太长,导致收集的过程中EBC中部分水蒸汽冷凝在长管中,另外,由于病人在使用Ecoscreen时会吸入收集管内的冰冷气体,这导致很多受试者产生不适的反应。
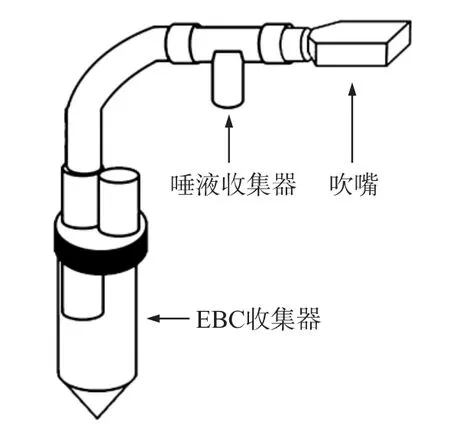
图1 商业化仪器Ecoscreen EBC采集装置示意图
针对Ecoscreen仪器的不足,在我们的改进设计中,使用了短管连接吹嘴与EBC收集器以减少吹气的阻力,同时设计了单向阀,包含吸入单向阀和呼出单向阀以保证受试者没有重复吸入呼出的气体,如图2所示。单向阀的存在还可以让受试者呼吸EBC收集管外的气体,使用这样的设计可以增加受试者的舒适度。

图2 我们设计的EBC采集装置示意图
2 EBC的临床采集实验
采用我们设计的EBC收集装置放置在温度可调的冷凝仪器中,保证采集过程温度保持不变。所有受试者要求禁食禁烟12 h,于晨起空腹时进行EBC采集。所有受试者在25℃的室温环境下进行平静呼吸。所有受试者要求戴鼻夹,采集EBC所有通气通过口腔进行。对所有收集的EBC检测唾液淀粉酶也排除唾液的污染。EBC采集完毕在1 h内使用雅培公司Architect i2000 System进行癌胚抗原(CEA)检测,该仪器使用化学发光法对CEA进行检测,检测下限为0.5 ng/mL.
2.1 最佳采集温度的确定
有研究表明EBC收集量与采集温度有相关性,采集温度越低则EBC收集量越大。然而采集温度越低会加大采集成本,在使用干冰制冷的情况下甚至会在采集器中产生冰块从而影响采集的持续性。另外,EBC中CEA浓度与采集温度是否相关尚无研究报道。为研究采集量、CEA浓度与采集温度的关系,采用图2所示EBC收集装置收集10个肺癌病人呼出气体冷凝液,分别在 0℃、-5℃、-10℃、-15℃的温度设置中采集EBC,每个病人收集时间为5 min,收集结束后检测收集量及CEA的含量,结果如表1所示。
表1 不同温度条件下EBC收集量(±s,mL)及CEA浓度(±s,ng/mL)
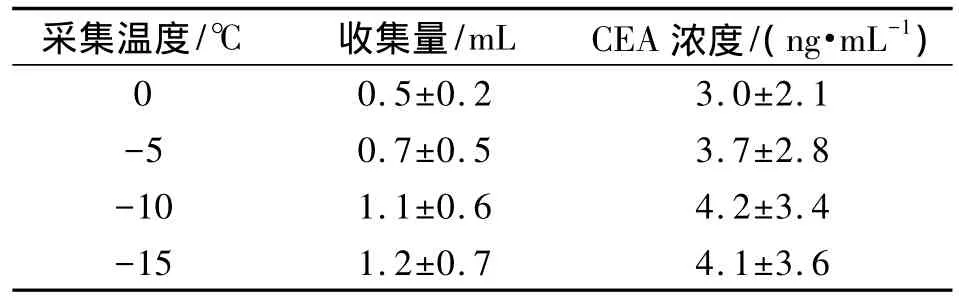
表1 不同温度条件下EBC收集量(±s,mL)及CEA浓度(±s,ng/mL)
采集温度/℃ 收集量/mL CEA浓度/(ng·mL-1)0 0.5±0.2 3.0±2.1-5 0.7±0.5 3.7±2.8-10 1.1±0.6 4.2±3.4-15 1.2±0.7 4.1±3.6
2.2 最佳采集时间的确定
EBC采集时间越长则采集量越多,然而采集时间加长会导致受试者产生不适反应,如口干、胸闷、心慌、头晕等不良反应。另外,EBC中CEA浓度与采集时间是否有相关性尚无研究。为明确EBC采集量、EBC中CEA浓度与采集时间之间的关系,采用图1所示采集装置对10名肺癌患者进行EBC采集,分别采集5 min、10 min、15 min,并检测收集量及CEA浓度,结果如表2所示。
表2 不同采集时间EBC收集量¯±s,mL)及CEA浓度¯±s,ng/mL)

表2 不同采集时间EBC收集量¯±s,mL)及CEA浓度¯±s,ng/mL)
采集时间/min 收集量/mL CEA浓度/(ng·mL-1)5 1.1±0.6 4.2±3.4 10 1.8±1.2 4.5±3.6 15 2.4±1.4 4.4±3.9
其中,采集时间为5 min时10个受试者均未出现不适反应,采集时间为10 min时有两个受试者出现口干,采集时间为15 min时7个受试者出现口干,5个受试者出现头晕。
2.3 与Ecoscreen仪器的比较分析
本研究对10名受试者进行EBC采集,采集对象分别使用自制的EBC收集器以及耶格公司生产的Ecoscreen进行EBC采集,采集温度为-10℃,采集时间为5 min,结果如表3所示。
表3 EBC收集量¯±s,mL)及CEA浓度¯±s,ng/mL)对比

表3 EBC收集量¯±s,mL)及CEA浓度¯±s,ng/mL)对比
采集装置 收集量/mL CEA浓度/(ng·mL-1)我们研制的EBC收集器 1.1±0.6 4.2±3.4 Ecoscreen 仪器 0.6±0.6 1.6±0.9
3 采集肺癌病人及健康人EBC
使用我们研制的EBC采集装置针对65例肺癌患者样本及56例体检健康者进行EBC采集,并将采集后的样本进行CEA检测。肺癌组及健康对照组在年龄、性别、吸烟情况均无统计学差异。其中肺癌组均经病理证实为肺癌,健康对照组通过体检确认未得恶性肿瘤,各组均排除严重的肝肾功能不全及血液系统疾病。
使用SPSS11.0软件对肺癌病人及健康人EBC中CEA检测数据进行处理,使用ROC曲线分析EBC中CEA浓度水平,并获取阳性阈值,并计算EBC中CEA检测灵敏度及特异性。
3.1 肺癌组与健康对照组EBC中CEA水平
比较肺癌组与健康对照组EBC中CEA检测值,如表4所示,最终 p<0.01,说明两组间有显著差别。
表4 肺癌组与健康对照组EBC中CEA水平(±s,ng/mL)

表4 肺癌组与健康对照组EBC中CEA水平(±s,ng/mL)
分组 人数 EBC中CEA检测值肺癌组 65 3.9±3.3健康对照组 56 1.9±1.7
3.2 ROC 曲线
ROC曲线(ReceiverOperatingCharacteristic curve,受试者工作特征曲线)是以不同的阈值计算敏感度和特异性的曲线。以“敏感度”为纵坐标,“1-特异性”为横坐标,画出EBC中CEA检测水平的ROC曲线,如图3所示。根据ROC曲线,综合考虑敏感性与特异性指标,定出EBC中CEA阳性指标值为2.55 ng/mL,此时敏感性为49.2%,特异性为83.9%。

图3 肺癌患者及健康对照组EBC中CEA水平的ROC曲线
4 分析与讨论
EBC是通过对人体呼出气体进行冷凝而获得的呼出气体冷凝物,其中水蒸汽冷凝而成的液态水是主要成分,约占99%[12]。有研究表明,在人体呼出气的水蒸汽中仅有少部分水滴含有非挥发性有机分子,这些有机分子包裹在水蒸汽的这些小水滴中,包括脂溶性物质和水溶性物质[13],因此如何将这些水滴有效冷凝成为EBC采集的关键。
作为一种最新发展起来的技术,EBC具有无创、安全、重复性好等优点,但是目前EBC并没有特定的采集标准。不同的研究者在研究不同的物质时EBC采集方法并不相同,甚至在收集同样的物质也会有不同的采集方法[14]。ATS/ERS据此指出EBC采集应针对采集的物质、采集对象等进行采集条件探索,并就EBC采集材料、采集温度、唾液收集器、保存等提出一些建议[9]。本研究在进行EBC检测时充分考虑并采用了这些建议。
在采集温度的研究中,0℃、-5℃、-10℃条件下EBC采集量及CEA浓度呈增加的趋势,显示随着温度的降低EBC采集量增加,同时CEA浓度也有所增加,这说明温度为0℃、-5℃时呼出气体中的水蒸汽并未完全冷凝为液态水进入收集器中。温度为-10℃、-15℃时EBC采集量及CEA浓度相差不大,无统计学意义,说明在温度达到足够低的程度时采集量与CEA浓度已经近乎达到饱和,这时呼出气体中水蒸汽近乎全部转化为液态水进入收集器中。考虑到温度过低会加大采集成本,并可能造成受试者的不适等因素,而在-10℃时采集量及CEA浓度已经接近峰值,说明-10℃是采集EBC中CEA的最佳采集温度。
在采集时间的研究中,采集 5min、10 min、15 min的条件下EBC采集量呈递增趋势,而CEA浓度则相差不大(p<0.05,说明差异没有统计学意义),说明采集时间长短对CEA浓度并无影响。考虑到运用检测仪器Architect i 2000自动进样系统进行CEA检测的最低样本量为0.5 mL,而5 min采集时间内10个受试者采集量为0.5 mL~2 mL,样本量可以满足仪器检测的需求,因此5 min是采集EBC中CEA的最佳采集时间。
通过装置的改进及最佳采集条件的设置对肺癌组和健康对照组进行EBC采集,并对CEA进行检测,结果发现肺癌组EBC中CEA浓度为(3.9±3.3)ng/mL,而健康对照组为(1.9±1.7)ng/mL,两组差异有统计学意义,说明EBC中CEA能够区分肺癌组和健康对照组。通过ROC曲线确定EBC中CEA的阳性阈值为2.55 ng/mL,此时敏感性为49.2%,特异性为83.9%,说明通过本装置进行的EBC中CEA采集分析可以很好地检测出肺癌中EBC的标志物。
我们接下来的工作是设计SAW传感器(Surface Acoustic Wave Sensor,声表面波传感器)进行CEA的检测,如图4所示。SAW传感器通过压电效应进行能量传递,传播路径上质量的变化能够导致输出频率的改变,由于SAW传感器的这种特性导致其得到广泛的研究和应用[15-16]。SAW传感器通过体声波进行传导,振荡频率可以达到500 MHz,因此具有很高的灵敏度。在SAW传感器上植被CEA抗体,通过微流控控制芯片将EBC导入敏感区,此时CEA将与CEA抗体结合,引起敏感区表面质量变化,从而导致波传导属性发生变化,通过检测输出叉指电极的频率变化可以检测CEA浓度。我们将在后面的论文中进行报道。
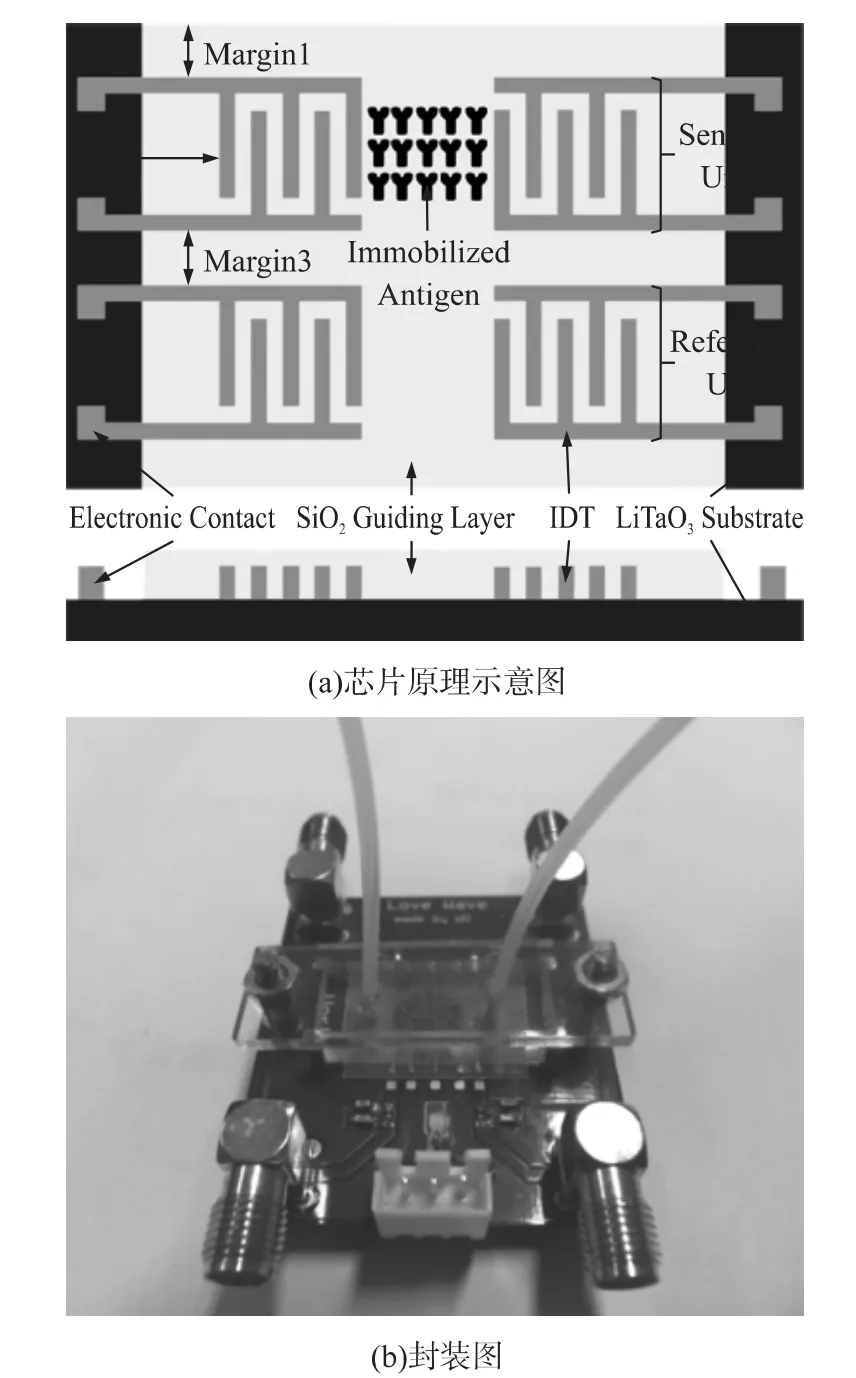
图4 检测EBC中CEA的SAW传感器芯片原理示意及封装图
5 结论
本研究设计了一种新型的呼出气体EBC中肺癌标志物的采集装置,并通过临床实验确定了该采集装置的最佳采集时间、最佳采集温度等参数。与国际上采用的商业仪器Ecoscreen进行了对比实验,结果表明,本装置在5 min内能够收集到更多的EBC,且CEA的浓度要高于Ecoscreen,说明本装置比Ecoscreen更适合采集EBC中的CEA。将采集仪器设置在最佳采集时间和采集温度下,采集肺癌病人及健康对照组EBC,并对CEA进行检测,发现肺癌组EBC中CEA浓度明显高于健康对照组。通过ROC曲线获得EBC中CEA检测的阳性阈值,并由此获得EBC中CEA检测肺癌的灵敏度和特异性。最终结果表明,本研究设计的EBC采集装置能够更好地检测EBC中CEA,具有更高的灵敏度和特异性。
[1]World Health Organization.Global Cancer Rates Could Increase by 50%to 15 Million by 2020[EB/OL].http://www.who.int/mediacentre/news/releases/2003/pr27/en/print.html,2003-04-03.
[2]Siegel R,Naishadham D,Jemal A.Cancer Statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[3]赫捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:12-25.
[4]Hunt J F,Fang K,Malik R,et al.Endogenous Airway Acidification:Implications for Asthma Pathophysiology[J].American Journal of Respiratory and Critical Care Medicine,2000,161(3):694-699.
[5]Montuschi P.Analysis of Exhaled Breath Condensate in Respiratory Medicine:Methodological Aspects and Potential Clinical Application[J].Therap Adv Respir Dis,2007,1(1):5-23.
[6]Carpagnano G E,Resta O,Fosehino-Barbaro M P,et al.Interleukin-6 is Increased in Breath Condensate of Patients with Non-Small-Cell Lung Cancer[J].International Journal of Biological Markers,2002,17(2):141-145.
[7]Paul P,Todd A,Ite A.DNA Methylation-Based Biomarkers for Early Detection of Non-Small Cell Lung Cancer:An Update[J].Molecular Cancer,2008,7:81.
[8]Christian G,Hartmut K,Katja T,et al.Detection of p53 Gene Mutations in Exhaled Breath Condensate of Non-Small Cell Lung Cancer Patients[J].Lung Cancer,2009,64(2):219-225.
[9]Montuschi P.Analysis of Exhaled Breath Condensate in Respiratory Medicine:Methodological Aspects and Potential Clinical Application[J].Therap Adv Respir Dis,2007,1(1):5-23.
[10]董敬军,陶一江,陈建荣,等.非小细胞癌患者呼出气冷凝液中CEA检测的临床意义[J].临床肺科杂志,2008,13(7):828-830.
[11]Hiang P C,Craig L,Paul S.Exhaled Breath Analysis:Novel Approach for Early Detection of Lung Cancer[J].Lung Cancer,2009,63(2):164-168.
[12]Effros R M,Hoagland K W,Bosbous M,et al.Dilution of Respiratory Solutes in Exhaled Condensates[J].Respir Crit Care Med,2002,165(5):663-669.
[13]Scheideler L,Manke H G,Schwulera U,et al.Detection of Nonvolatile Macromolecules in Breath.A Possible Diagnostic tool[J].Am Rev Respir Dis,1993,148(3):778-784.
[14]Massimo C,Matteo G,Andrea C,et al.Collecting Exhaled Breath Condensate(EBC)with Two Condensers in Series:A Promising Technique for Studying the Mechanisms of EBC Formation,and the Volatility of Selected Biomarkers[J].Journal of Aerosol Medicine and Pulmonary Drug Delivery,2008,21(1):35-44.
[15]何鹏举,戴冠中,陈明,等.谐振式SAW压力传感器敏感元件研究与设计[J].传感技术学报,2006,19(2):318-322.
[16]王乐,王镝,於锦,等.基于谐振型SAW传感器的呼吸检测系统设计[J].传感技术学报,2011,24(4):498-502.

