腹泻康片对小鼠体内抑菌作用的实验研究
严 枫 邓义德 杨 华 广西壮族自治区岑溪市中医院(岑溪543200)
随着社会生活节奏的加快,饮食失调和不洁引起胃肠功能紊乱,导致感染性腹泻的现象日益增加,目前临床采用抗生素治疗感染性腹泻比较普遍,不合理使用、滥用抗生素导致耐药菌株不断增多,治疗难度加大[1,2],而运用中药治疗感染性腹泻可减少抗生素使用量,一定程度上能缓解抗生素耐药问题。腹泻康片处方由秦皮、木香等四味药材组成,源自临床应用多年的方剂,对感染性腹泻有很好的治疗效果,具有清热燥湿,行气止痛,涩肠止泻之功效。主要用于感染性腹泻,症见泻下急迫或泻下不爽,大便色黄秽臭,肛门灼热。我们对腹泻康片药效学进行了系统的研究,现将腹泻康片对小鼠体内抑菌作用的实验研究结果报道如下。
1 材 料 1.1 药 物 腹泻康片干浸膏粉:由广西岑溪市中医院自制,批号20111012,常温密封保存,含量:1g干浸膏相当于3.6g生药。肠康片:张家界元尔药业有限公司,批号:20100802。诺氟沙星:哈药集团三精千鹤制药有限公司,批号20110402。
1.2 菌 种 大肠杆菌(ATCC44136)、乙型副伤寒杆菌(H901)、痢疾杆菌为广西医科大学微生物学教研室提供。
1.3 动 物 SPF级昆明种小鼠,雌雄各半,体重18~22g,广西医科大学实验动物中心提供,合格证号:SYXK桂2009-0004。
1.4 试 剂 无菌水:广西岑溪市中医院自制。普通肉汤琼脂培养基:杭州微生物试剂有限公司生产,批号20100916212。普通肉汤培养基:杭州天和微生物试剂有限公司生产,批号:20100801。
1.5 仪 器 无菌操作台,苏州亿达净化实验室设备有限公司;电热恒温培养箱,厦门医疗电子仪器厂;手提式压力蒸气灭菌锅,北京市永光明医疗仪器厂;电子天平,德国赛多利斯。
2 方 法 2.1 配制及给药 受试药液配制:取28.8g腹泻康片干浸膏粉,加蒸馏水搅拌均匀至240mL,混悬液浓度为0.432g生药/mL,即高剂量组给药浓度。取高剂量浓度依次稀释50%的中、低剂量组给药浓度(0.216g生药/mL、0.108 g生药/mL)。
给药:腹泻康片组给药体积为20mL/kg,高中低三组给药剂量分别为8.64g生药/kg、4.32g生药/kg、2.16g生药/kg。肠康片组:0.62g成药/kg。诺氟沙星组:0.16g/kg。
2.2 最小致死量(mLD)测定 感染菌的制备:按无菌法操作,从制备好的菌液中采用麦氏计数法制成分别为大肠杆菌1013、1012、1011、1010、109cfu/mL;乙型副伤寒杆菌1011、1010、109、108、107cfu/mL;痢疾杆菌1010、109、108、107、106cfu/mL不同浓度菌液。
动物致死试验:取SPF级昆明种小鼠150只先按性别分层,苦味酸标记编号,称重,随机分成15组,每组10只,分别腹腔注射不同浓度的细菌溶液(大肠杆菌、乙型副伤寒杆菌、痢疾杆菌)(0.5mL/只),观察小鼠在7d内的死亡情况,找出一个最小致死量(mLD),即感染后引起小鼠100%死亡的菌液浓度。
2.3 对细菌感染致死小鼠的保护作用 取SPF级昆明种小鼠190只先按性别分层,苦味酸标记编号,称重,随机分成19组,每组10只,随机分为空白对照组,大肠杆菌:模型组、肠康片、诺氟沙星及腹泻康片高、中、低3个不同剂量共6组;乙型副伤寒杆菌:模型组、肠康片、诺氟沙星及腹泻康片高、中、低3个不同剂量共6组;痢疾杆菌:模型组、肠康片、诺氟沙星及腹泻康片高、中、低3个不同剂量共6组;每组动物10只。除正常组外,其余各组小鼠置于造模室(温度30±2℃,相对湿度80-90%)5天,第6天移出置于屏障环境(室温20±2℃,相对湿度65±5%)。禁食不禁水12h后,除正常组外,其余各组每鼠腹腔注射mLD细菌0.5mL,除正常组和模型组灌胃蒸馏水外,其他组分别于1、12h给小鼠灌胃给药1次(灌胃体积:20mL/kg)。以后每隔24h以同样的方法灌胃7d,并观察、记录各组动物的存活情况,计算各组保护率,第8天处死所有动物。
保护率=每组存活动物数÷每组动物总数×100%
2.4 统计学方法 数据经SPSS16.0软件包统计,计量资料用均数±标准差(±s)表示,采用单因素方差分析,多组间比较采用LSD检验,多组与同一组比较用Dunnett法检验。计数资料用χ2检验。
3 结 果 根据mLD试验结果,大肠杆菌对小鼠的最小致死量mLD为1×1012cfu/mL;乙型副伤寒杆菌对小鼠的最小致死量mLD为1×109cfu/mL;痢疾杆菌对小鼠的最小致死量mLD为1×109cfu/mL。结果见表1~3。

表1 大肠杆菌对小鼠最小致死量(mLD)的测定结果
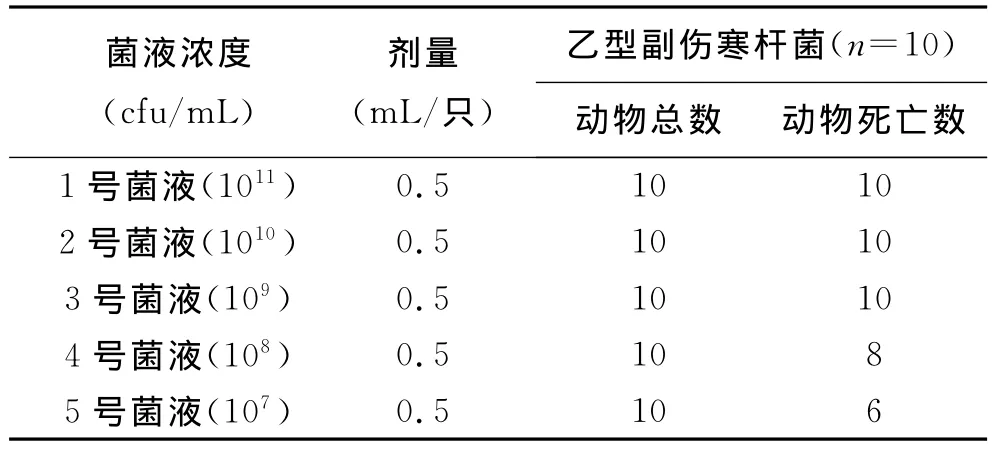
表2 乙型副伤寒杆菌对小鼠最小致死量(mLD)的测定结果

表3 痢疾杆菌对小鼠最小致死量(mLD)的测定结果
腹泻康片对感染小鼠模型保护率影响的结果:模型组与空白组相比,保护率明显降低差异具有统计学意义(P<0.01);诺氟沙星组、各药物组与模型组相比,保护率明显升高差异具有统计学意义(P<0.01);大肠杆菌感染实验中腹泻康高剂量组、腹泻康中剂量组与肠康片组相比,保护率明显升高(P<0.01),腹泻康低剂量组与肠康片组相比,差异无统计学意义(P>0.05);乙型副伤寒感染实验中,腹泻康高剂量组与肠康片组比较,保护率明显升高(P<0.05),低剂量和中剂量与肠康片比较无统计学意义(P>0.05);痢疾杆菌感染实验中,腹泻康高剂量组和肠康片组比较,保护率明显升高差异具有统计学意义(P<0.01),腹泻康中剂量组和肠康片组比较,保护率明显降低明显升高差异具有统计学意义(P<0.05),低剂量组与肠康片组比较无统计学意义(P>0.05)。结果见表4。

表4 腹泻康片对3种不同细菌感染小鼠模型保护率的影响(n=10)
表5 腹泻康片对3种不同细菌感染小鼠模型存活时间的影响(±s,n=10)

表5 腹泻康片对3种不同细菌感染小鼠模型存活时间的影响(±s,n=10)
注:与空白组比△P<0.01;与模型组比◇P<0.01;与肠康片组比▲P<0.05,◆P<0.01
感染小鼠存活天数组 别7 7 7模型组 0.4±0.7△ 0.7±1.1△ 0.9±1.0△肠康片组 3.1±3.2◇ 3.9±3.3◇ 3.1±3.2◇诺氟沙星组 7◇ 5.7±2.8◇ 6.3±2.1◇腹泻康低剂量组 3.8±3.1◇ 2.9±2.8◇ 3.8±3.2◇腹泻康中剂量组 5.1±3.1◇◆ 4.3±2.8◇ 4.8±2.8◇◆腹泻康高剂量组 5.8±2.6◇◆ 5.4±2.6◇▲ 4.9±2.7大肠杆菌 乙型副伤寒杆菌 痢疾杆菌空白组◇◆
腹泻康片对3种不同细菌感染小鼠模型存活时间影响的结果:与空白相比,感染致死量大肠杆菌、乙型副伤寒杆菌、痢疾杆菌的小鼠模型小鼠存活时间显著缩短差异具有统计学意义(P<0.01);与模型组相比,诺氟沙星组和各药物组小鼠存活时间明显延长差异具有统计学意义(P<0.01);大肠杆菌致死量感染实验中,腹泻康高、中剂量组与肠康片组比小鼠存活时间明显延长差异具有统计学意义(P<0.01),腹泻康低剂量组与肠康片组比较无差异(P>0.05);乙型副伤寒杆菌致死量感染实验中,腹泻康高剂量组与肠康片组比小鼠存活时间明显延长差异具有统计学意义(P<0.05),中剂量组与肠康片组比较无差异(P>0.05);痢疾杆菌致死量感染实验中,腹泻康高、中剂量组与肠康片组比小鼠存活时间明显延长(P<0.01),腹泻康低剂量组与肠康片组比较无差异(P>0.05);腹泻康片各组之间,随着剂量增加感染小鼠存活时间延长差异具有统计学意义(P<0.05)。结果见表5。
4 讨 论 感染性腹泻是由多种病原微生物及其产物引起的以腹泻为主要表现的肠道疾病,为当今全球重要的公共卫生问题之一[3-5]。本方源自临床用于治疗感染性腹泻的经验方,方中君药为秦皮,文献也有报道秦皮煎剂对痢疾杆菌、大肠杆菌、绿脓杆菌、金黄色葡萄球菌均有抑制作用:秦皮甲素、秦皮乙素、秦皮苷均有明显抑菌作用[6-7]。体外试验表明,秦皮对金黄色葡萄球菌、福氏痢疾杆菌、宋内氏痢疾杆菌有显著的抑制作用,对伤寒杆菌、副伤寒杆菌也有一定程度的敏感性[8-10]。秦皮体内抗菌试验显示,秦皮可降低由伤寒杆菌引起的小鼠急性腹腔感染的死亡率[11]。
本实验结果表明,腹泻康片低、中、高3个不同剂量均可延长大肠杆菌、乙型副伤寒杆菌、痢疾杆菌感染小鼠的存活时间和减少感染小鼠的死亡率,与感染模型组比较差异具有统计学意义(P<0.01)。腹泻康高剂量组对感染大肠杆菌和痢疾杆菌小鼠模型保护率与肠康片组比,保护率显著升高,差异有统计学意义(P<0.01),腹泻康高剂量组对感染乙型副伤寒杆菌小鼠模型保护率与肠康片组比,保护率升高,差异有统计学意义(P<0.05)。结果提示腹泻康片对大肠杆菌、乙型副伤寒杆菌、痢疾杆菌感染小鼠具有一定的保护作用,有望开发成治疗感染性腹泻的中药新药。
[1] 孙友发,钱焕如.我院七月份门、急诊腹泻患者情况统计及抗生素使用分析[J].医药前沿,2011,1(22):222-223.
[2] Feng-Qin Hou,Xin-Ting Sun,Gui-Qiang Wang.Inappropriate use of empirical antibiotics in adults with acute infectious diarrhea in a large teaching hospital[J].Journal of Chinese Pharmaceutical Sciences,2010,19(3):229-234.
[3] Santosham M,Chandran A,Fitzwater S,et al.Progress and barriers for the control of diarrhoeal disease[J].Lancet,2010,376(9734):63-67.
[4] 聂青和.感染性腹泻的研究现状[J].传染病信息,2007,20(4):193-196.
[5] Nylund CM,Densen LA,Noel JM.Bacterial enteritis as a risk factor for childhood intussusception:a retrospective cohort study[J].J Pediatr,2010,156(5):761-765.
[6] 姚丽芳,杨逢春.秦皮类中草药抗菌作用的研究[J].中华医学丛刊,2003,(6):56-57.
[7] 国家中医药管理局《中华本草》编委会.中华本草:6册[M].上海:上海科学技术出版社,1999:163.
[8] 汪松国,杨亚滨,丁忠涛.秦皮的研究进展[J].国外医药:植物药分册,2007,22(3):108-111.
[9] 方莲花,吕 扬,杜冠华.秦皮的药理作用研究进展[J].中国中药杂志,2008,33(23):2732-2736.
[10] 张 霞,艾启俊,孙宝忠.秦皮提取物抑菌活性及稳定性研究[J].安徽农业科学,2010,38(5):2358-2361.
[11] 杨天鸣 ,葛 欣,王晓妮.秦皮抗菌作用研究[J].西北国防医学杂志,2003,24(5):387-388.

