死后不同时间对小鼠皮肤切创组织中CB2R检测影响的研究
郑吉龙李晓娜张 岷含温洪洋官大威
(1 中国刑警学院 辽宁 沈阳 110035;2 中国医科大学 辽宁 沈阳 110001)
死后不同时间对小鼠皮肤切创组织中CB2R检测影响的研究
郑吉龙1李晓娜2张 岷含1温洪洋1官大威2
(1 中国刑警学院 辽宁 沈阳 110035;2 中国医科大学 辽宁 沈阳 110001)
为观察不同死后间隔时间对CB2R检测的影响,本文应用Western blot和Real-Time RT-PCR技术检测了40只健康成年雄性BALB/c小鼠在生前皮肤切创5d处死后不同时间点对CB2R表达变化的影响。发现小鼠皮肤切创愈合过程中,CB2R表达变化具有时间规律性,并且死后6h内CB2R稳定存在于皮肤组织中,有望用于皮肤损伤时间的推断。
皮肤损伤 CB2R Western blotReal-TimeRT-PCR 死亡时间
损伤时间推断,对划定嫌疑人的范围、现场重建及判断死亡方式等,均有重要意义,可以为案件的侦破与审理提供可靠的医学证据,一直是法医病理学研究的重点和难点。现有的检测方法主要是根据损伤局部病理组织学改变,局部酶的活性的改变以及炎性介质的生物化学检测来推断损伤时间。为了寻求更精确、更可靠的判断指标,近年来国内外许多法医学者应用免疫组织化学及分子生物学技术对创伤愈合中相关因子进行了诸多研究,研究证实bFGF、VEGF、TGF-131、fibronectin、TGF-a、IL-6等在创伤愈合中的表达均具有时间规律性变化,有望作为法医学损伤时间的判断指标。法医学实践中往往不能在人死后立即进行解剖、取材,以往的实验性研究也均未涉及到死后因素对各检测指标的影响,故很少考虑到死后变化对于所研究指标的影响。某些可以用于损伤时间推断的指标,很可能由于死后变化的影响而失去其实际应用价值。因此,本实验在前期研究小鼠皮肤切创愈合过程中CB2R受体表达和分布的时序变化的基础上,研究小鼠皮肤切创后死后早期时间内对CB2R检出时限的影响,以探讨其在法医实践中用于推断损伤时间的可行性。
1 实验材料与方法
1.1 试剂和材料
1.1.1 实验动物
健康成年雄性BALB/c小鼠40只,体重30g~35g,由中国医科大学实验动物中心提供。
1.1.2 主要试剂和材料
6条带预染蛋白Marker(Fermentas公司,立陶宛)、硝酸纤维素膜(PVDF膜,Millipore公司,美国)、乙二胺四乙酸二钠(广州化学试剂厂)、ECL发光试剂盒(Santa Cruz公司,美国)、β-actin引物(Takara公司,中国)、CB2R引物(Takara公司,中国)、PrimeScriptTMRT reagents Kit(Perfect Real Time)(DRR037S)(Takara公司,中国)、SYBR® Premix Ex TaqTMΙΙ(Perfect Real Time, DRR081S,Takara公司,中国)。
1.1.3 主要实验仪器
匀浆仪 (IKA公司,德国)、电泳仪(BIO-RAD)、转印仪(BIO-RAD)、酶标光度计(Tecan公司,瑞士)、紫外可见光分光光度计(Implen公司,德国)、电泳凝胶成像分析系统(DNR Bio-Imaging Systems公司,以色列)、Real Time RT-PCR扩增仪(Applied Biosystems,USA)。
1.2 实验方法
1.2.1 动物模型的制作
为观察死后不同时间对CB2R检测的影响,另取健康成年雄性BALB/c小鼠40只,体质量30g~35g,随机分为8组,每组均为5只小鼠。在生前伤5d后脱颈椎处死,置22℃室温,湿度70%,以死后放置时间不同,分别于死后0h、0.5h、1h、3h、6h、12h、1d、3d提取皮肤样本进行Western blot和Real-Time RT-PCR方法的检测。
1.2.2 Western blot技术检测
1.2.2.1 蛋白样品制备
将剪碎的皮肤组织检材放入2ml EP管中,加入裂解液(组织与裂解液体积比为1∶3)和苯甲基磺酰氟化物(PMSF);冰上匀浆,超声破碎;4℃条件下12000r/min(离心半径9.35cm)离心30min,提取上清液;BCA法进行蛋白定量;计算每个损伤时间组含50μg总蛋白所需样品体积,-20℃保存。
1.2.2.2 实验步骤
灌胶:灌注12%分离胶,待分离胶凝固后,再灌注5%浓缩胶;蛋白变性:样品加适量比例上样缓冲液,混匀置于 100℃金属浴中加热 5min,离心3000r/min,20s;上样:向泳道内加入20μl样品(含40μg总蛋白)及分子量Marker;12%SDS-PAGE凝胶电泳,浓缩胶电压设置为40V,时间30min,分离胶电压设置为100V,时间100min;剥胶后把胶置于转印缓冲液中,摇床中浸湿15min后将滤纸浸入转印缓冲液中浸泡;将PVDF膜放在甲醇中浸泡5min后,放入转印缓冲液中浸湿30 min;半干转法,转印电压设置为 5V,转印时间 35min;TTBS中洗膜,5min×3次,将PVDF膜浸入5%脱脂奶粉中,封闭2h,室温摇床上进行;加入一抗(兔抗大鼠CB2R多克隆抗体,1∶400脱脂奶粉稀释)4ml,塑料薄膜密封,4℃孵育过夜;TTBS中洗膜5min×2次,TBS中5min×1次。然后加入二抗(羊抗兔IgG,1∶6000稀释)5ml,塑料薄膜密封,室温孵育2h;TTBS中洗膜5min×2次,TBS中5min×1次,ECL发光。
1.2.2.3 判断标准
以标准分子量Marker作指示,CB2R蛋白在34kD附近显示阳性谱带。以GAPDH为内参照,利用Scion Image(Scion Corporation,Maryland,USA)软件检测CB2R在各组的相对蛋白水平,从而进行单因素方差分析。
1.2.3 Real-time RT-PCR技术检测
1.2.3.1 RNA提取
将剪碎的皮肤组织检材放入1.5ml EP管中,加入1ml的Trizol溶液,颠倒混匀10下,室温静置5min;加入0.2ml氯仿,用力摇晃EP管15s,使其充分混匀,室温静置5min,12000r/min离心15min;将上层水相转入新的1.5ml EP管中(约 400μl~500μl),加入0.5ml异丙醇,混匀后放于-20℃中1h,后12000rmp离心10min;小心倒掉上清,留取沉淀。加1ml现配的75%的乙醇(预冷)振荡洗涤RNA沉淀一次,7500r/min离心5min;小心倒掉上清,取沉淀置超净工作台开风机吹干,再在管中加20μl的 DEPC水溶解;测定 OD260/OD280值和RNA浓度,将样品部分RNA稀释成0.5μg/μl。
1.2.3.2 反转录反应
按PrimeScriptTM RT reagents Kit说明,20μl反应体系如下:已配好的RNA工作液(0.5μg/μl)2μl,5×PrimeScript®Buffer 4μl,PrimeScript®RT Enzyme Mix I 1μl,Oligo dt Primer 1μl,Random 6 mers 1μl,RNase Free dH2O 11μl。加入2ml薄壁PCR反应管中,先瞬时离心混匀,置PCR仪中,37℃孵育15min(反转录反应),85℃孵育5sec(反转录酶的失活反应)。
1.2.3.3 Real-Time RT-PCR反应
Takara公司设计特异性引物见表1。PCR试剂购自Takara公司SYBR®Premix Ex TaqTMΙΙ。应用ABI PRISM®7500 Real-Time PCR System进行PCR扩增。20μl反应体系组成如下:SYBR®Premix Ex TaqTMII 10μl,PCR Forward Primer 0.8μl,PCR Reverse Primer 0.8μl,ROX Reference Dye II 0.4μl,cDNA溶液2μl和dH2O 6.0μl。两步法PCR扩增标准程序:1个预变性循环(95℃,30sec);40个PCR反应循环(95℃,5sec;60℃,34sec)。连续采集荧光信号绘制融解曲线。
1.2.3.4 统计分析
实时定量 PCR结果由 ABI PRISM®7500 Real-Time PCR System自动采集给出目的基因和参比基因的Ct值,基因表达量采用实验组/对照组=2-ΔΔCt进行计算,其中ΔΔCt=(Ct目的-Ct参比)实验-(Ct目的-Ct参比)对照。每组中目的基因和参比基因加入的量一致,所以可以对每个样本ΔCt值(Ct目的-Ct参比)采用SPSS13.0 for Windows统计软件进行组间比较后再进行2-ΔΔCt计算倍数。
2 实验结果
2.1 宏观形态学改变
死后即刻,痂皮与创缘皮肤分离,部分已剥离,创口表面被增生的上皮覆盖,可见皮下红色肉芽组织。死后6h~12h创壁变化较小,较湿润;皮肤及皮下组织未见腐败。死后24h~48h皮肤变薄,创壁略变干,尸体腐败,尸臭、尸绿出现;取材时见肌肉部分混浊、变软。死后3d,尸体腐败显著,取材时见肌肉混浊、变软。
2.2 CB2R蛋白水平检测
以GAPDH(分子量34kD)为内参,计算CB2R蛋白在死后不同时间组表达的相对值(CB2R灰度值/GAPDH灰度值)。CB2R在死后各时间组均有阳性条带,CB2R大约位于34kD处,死后各时间组CB2R蛋白表达相对水平有一定规律(图1)。和死后0h组比较,死后6h组CB2R蛋白表达相对水平开始显著降低;至死后3d,CB2R蛋白表达相对水平降至最低值。CB2R蛋白表达相对水平(x±s) 参见图2,统计学分析结果参见表2。

图1 切创后5d皮肤样本在死后不同时间点CB2R蛋白的表达变化

表2 Western blot法检测小鼠皮肤切创5d皮肤样本在死后不同时间点CB2R蛋白表达水平(n=5,x±s)

图2 切创后5d皮肤样本在死后不同时间点CB2R蛋白的相对表达水平
2.3 Real-time RT-PCR 技 术 检 测 CB2R mRNA表达水平
小鼠切创5d后不同死后间隔时间CB2R mRNA在皮肤组织中的表达随时间变化结果见表3。和死后0h组比较,死后6h组CB2R mRNA表达相对水平开始降低;至死后3d,CB2R mRNA表达相对水平降至最低值。CB2R mRNA表达相对水平(x±s)参见图5,统计学分析结果参见表3。β-actin和CB2R基因的溶解曲线呈单峰,溶解温度分别为87℃和83℃(图3、图4)。
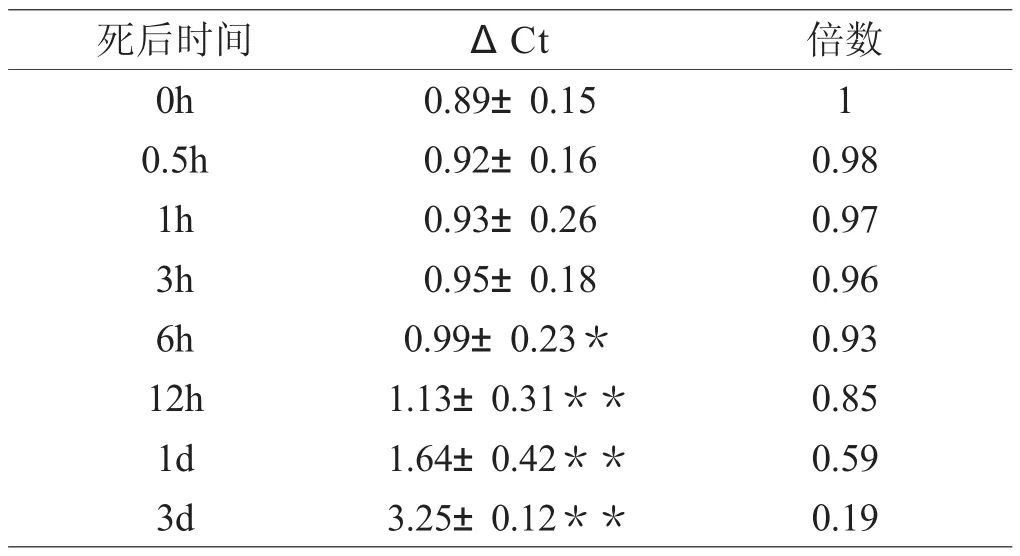
表3 Real-time PCR法检测小鼠皮肤切创5d皮肤样本在死后不同经过时间CB2R mRNA表达水平(n=5,x±s)

图3 β-actin基因的溶解曲线

图4 CB2R基因的溶解曲线

图5 切创后5d皮肤样本在死后不同经过时间CB2R mRNA相对Ct值
3 讨论
在法医学的实践中,法医病理学家必须要面对死后不同时间段的尸体。随着死后间隔时间的增加,许多生物学物质因为腐败或自溶的作用而发生降解。如果CB2R的蛋白或mRNA水平在死后不同时间段的尸体伤口样本中可以得到客观的评价,那么CB2R将会为损伤时间推断的实际应用提供更有价值的信息。
本实验研究了不同死后间隔时间CB2R表达变化规律,以探讨死后CB2R的稳定性以及在法医学推断损伤时间方面的可行性和可信度。Western blot和Real-time RT-PCR实验结果显示:死后3h,CB2R蛋白和mRNA表达量与生前伤相比仍无显著性差异,受死后时间影响较小。死后6h,CB2R mRNA水平开始下降;死后12h,CB2R蛋白水平开始降低;但直至死后3d,CB2R蛋白和mRNA仍可以检测出。研究结果揭示了CB2R蛋白和mRNA水平在个体死后的降解规律。
尸体中各种生物学物质的蛋白或mRNA水平通常被用于推断死亡时间。大多数学者认为,由于RNA酶的广泛存在,mRNA和蛋白相比更加容易降解。然而,几例观察尸体样本mRNA降解的研究却得出了相反的结论。Johnson等报道了死后36h的尸检,发现脑组织样本的mRNA没有发生实质上的降解。Marchuk等报道了死后在室温放置96h的兔组织样本没有发生显著的mRNA或rRNA的减少。在推断损伤时间方面,Bai等报道了在兔皮肤切创样本中细胞因子IL-1β、COX-2、MCP-1的mRNA水平于死后6h依然没有显著下降;而Sun等发现在大鼠骨骼肌挫伤样本中troponin I mRNA水平于死后0.5h即发生显著的降解。本研究发现CB2R mRNA在死后6h开始发生降解,早于CB2R蛋白在死后开始发生降解的时间。可见,不同生物学物质mRNA的降解在不同物种、不同模型、不同组织中呈现不同的变化规律。因此,确定不同生物学物质mRNA在人体死亡后的降解规律将是法医学工作者今后必须面对和解决的问题之一。总之,本研究阐明了在小鼠皮肤损伤后不同死后间隔CB2R蛋白和mRNA降解的时间规律性,这为CB2R应用于法医实际检案工作中奠定了基础。
1.StanderS,SchmelzM,MetzeD,etal.Distribution ofcannabinoid receptor 1(CB1)and 2(CB2)on sensorynerve fibersandadnexalstructureainhuman skin.JDermatolSci. 2005;38:177-188
2.Abood ME,Rizvi G,Sallapudi N,etal.ActivationoftheCB1cannabinoid receptor protectscultured mouse spinal neurons against excitotoxicity.Neurosci Lett.2001;309:197-201
3.Nagayama T,Sinor AD,Simon RP,etal.Cannabinoids and neuroprotection in global and focal cerebral ischemia and in neuronal cultures.J Neurosci.1999;19:2987-2995
4.Shen M, Thayer SA.Cannabinoid receptor agonist sprotect cultured rat hippocampal neurons from excitotoxicity.MolPharmacol.1998;54:459-462
5.Pryce G, Ahmed Z, Hankey DJ, etal.Cannabinoids inhibit neurodegeneration in models of multiplesclerosis.Brain.2003;126:2191-2202
6.MarsicanoG,Moosmann B,Hermann H,etal.Neuroprotective properties of cannabinoids against oxidative stress: role ofthe cannabinoid receptor CB1.J Neurochem.2002;80:448-456
7.Hampson AJ,Grimaldi M,Axelrod J,etal.Cannabidiol and(-)Delta9-tet rahydrocannabinol are neuro-protective antioxidants.Proc Natl Acad Sci USA.1998;95:8268-8273
8.El-RemessyAB,KhalilIE,MatragoonS,etal.Neu2roprotective effect of rahydrocannabinol and cannabidiol in N-methyl-D-aspartate-induced retinal neurotoxicity: involvementof peroxynitrite.Am J Pathol.2003;163:1997-2008

