维汉民族高血压伴阻塞性睡眠呼吸暂停低通气综合征患者动脉硬化差异性研究
陈玉岚,孙 丽,珠勒皮亚·司马义,张向阳,徐新娟,陈 曦,沙巴尔·肉孜阿吉
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是睡眠呼吸暂停综合征中最常见的一种类型,研究表明近50%的高血压患者合并OSAHS,50%~60%的OSAHS患者合并高血压[1],近年来高血压与OSAHS的关系引起国内外普遍关注,但目前对不同民族间高血压伴OSAHS病例对比研究较少。新疆是一个多民族聚集的地区,少数民族中以维吾尔族居多,其独特的遗传背景、饮食、生活习惯、体质指数标准及其并存疾病状况等均与汉族有较大差别。本研究旨在通过回顾性分析我院高血压伴OSAHS患者病历资料,初步探讨新疆维汉民族高血压伴OSAHS患者动脉硬化差异性,为更好地开展高血压伴OSAHS疾病的早期干预和治疗提供有效临床依据。
1 对象与方法
1.1 研究对象 选择2011年1月—2013年1月新疆医科大学第一附属医院高血压科住院的高血压伴OSAHS患者183例,按民族不同分为两组:维吾尔族组39例,汉族组144例。诊断标准:(1)高血压诊断标准参考2010年中国高血压防治指南[2]:在未用抗高血压药物情况下,收缩压≥140 mm Hg(1 mm Hg=0.133 kPa)和(或)舒张压≥90 mm Hg;既往有高血压史,虽然血压低于140/90 mm Hg但目前仍正在用抗高血压药者。(2)OSAHS诊断标准参照文献[3]:对本人及其家属述及有典型的夜间睡眠时打鼾、白天嗜睡者、其他原因不能解释的唇舌发绀者、不明原因的高血红蛋白血症者及难治性高血压患者(难治性高血压定义为联合应用包括利尿剂在内的3种或以上药物血压仍不能达标)进一步行整夜多导睡眠图(PSG)监测,按美国睡眠医学学会标准睡眠呼吸暂停低通气指数(AHI)≥5 次/h且以阻塞性为主者诊断为OSAHS。(3)高血压伴OSAHS定义为患者同时符合高血压和OSAHS诊断标准。(4)颈动脉粥样硬化诊断标准参照文献《欧洲高血压治疗指南2003年版》[4]:颈动脉内膜中层厚度(IMT)≥0.09 cm判断为动脉壁增厚;动脉斑块判断标准:局部隆起,增厚,向管腔内突起,IMT≥0.12 cm。检查中发现一侧内中膜增厚和(或)斑块则定义为颈动脉硬化。
排除标准:(1)有鼻部疾病和慢性肺疾病如慢性阻塞性肺疾病、支气管哮喘及结核等;(2)明确诊断的其他继发性高血压;(3)心脏瓣膜病及原发性心肌病变;(4)心功能不全、肝肾功能不全等疾病。
1.2 研究方法
1.2.1 颈部动脉超声检查 采用Philips iE33彩色多普勒超声诊断仪进行检测,探头频率为7.5 mHz。检查时患者平卧,头略偏向对侧,在颈部下颌角后方确定颈总动脉,超声探头纵行由前向后逐渐移动,寻找最清晰的显影位置。先后测定左右颈总动脉、颈内动脉、颈外动脉及膨大处,观察内中膜厚度及有无粥样硬化斑块。IMT测定:颈总动脉近分叉处远端1 cm处测定,远离皮肤侧的管腔内膜界面与中外膜界面之间的距离为IMT,左右颈总动脉各测量3次,取其平均值。
1.2.2 四肢多普勒血流图监测 采用日本欧姆龙公司全自动动脉硬化监测仪VP-1000测定患者脉搏波传导速度(PWV)和踝臂指数(ABI)。进行检查前患者静息10 min,消除紧张情绪,检查时取标准仰卧位,将测量血压的袖带缚于两侧上臂、两侧脚踝处,连接好心音心电装置,仪器将在5 min内根据身高自动测量上臂到脚踝间的传播距离(L)和脉搏波传导时间(T),根据PWV=L/T计算两侧PWV;监测仪同步测量四肢血压,将每一侧下肢的血压与上肢血压相比,得到两侧ABI值。
1.2.3 PSG监测 通过详细询问病史,所有受试者均经过夜间连续7 h睡眠监测,仪器采用澳大利亚PSG仪Com2pumedics2 E型分析仪进行分析,同步监测血氧饱和度、胸腹呼吸运动、鼾声、口鼻气流等。监测结束后由专门技术人员进行数据分析,包括AHI、平均血氧饱和度(MSaO2)、最低血氧饱和度(LSaO2)及血氧饱和度小于85%的时间(TS85%),并于监测前当晚测量身高、体质量、计算出体质指数(BMI)。所得数据经电脑自动分析和人工判读。
1.2.4 24 h动态血压监测 患者入院后进行24 h动态血压的监测,采用美国伟伦Welch Allyn动态血压监测仪6100,动态血压设定测量间隔为白天30 min,夜间60 min。监测结束记录其最高血压、最低血压及平均血压并计算出脉压(PP)。
1.2.5 其他检测指标 所有纳入患者禁食8 h后次日晨抽取空腹静脉血,采用罗氏C8000全自动生化分析仪测定总胆固醇(TC)、三酰甘油(TG),DCA2000测定糖化血红蛋白(HbA1c),Acl TOP700全自动凝血分析仪测定纤维蛋白原(Fg),GC-2016r放射免疫计数仪测定血浆肾素、血管紧张素、醛固酮活性。

2 结果
2.1 基本资料 两组性别、年龄、病程、吸烟史、饮酒史、总胆固醇及糖化血红蛋白比较,差异均无统计学意义(P>0.05),BMI、Fg、三酰甘油水平间差异有统计学意义(P<0.01,见表1)。
2.2 维汉民族间血压及OSAHS比较 两组平均收缩压、舒张压间差异均无统计学意义(P>0.05);PP间差异有统计学意义(P<0.01)。两组间OSAHS诊断评价指标AHI、LSaO2、MSaO2、TS85%间差异均无统计学意义(P>0.05,见表2)。
2.3 维汉民族间动脉硬化比较 两组IMT间差异有统计学意义(P<0.05),左、右ABI间差异有统计学意义(P<0.05),维吾尔族组动脉硬化发生率大于汉族组,差异有统计学意义(P<0.05),但两组间左、右PWV差异无统计学意义(P>0.05,见表3)。

表1 不同指标在维汉两组的检测结果比较
注:*为χ2值,△为t值,余检验统计量值为Z值;BMI=体质指数
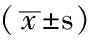
表2 维汉两组血压及OSAHS诊断检查指标比较
注:*为t值,余检验统计量值为Z值;PP=脉压,AHI=睡眠呼吸暂停指数,LSaO2=最低血氧饱和度,MSaO2=平均血氧饱和度,TS85%=血氧饱和度小于85%的时间
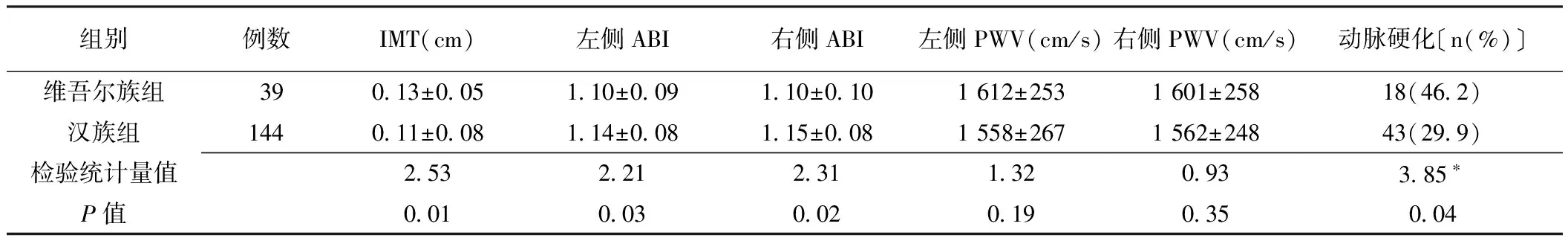
表3 维汉两组反映动脉硬化各指标比较
注:*为χ2值,余检验统计量值为Z值;IMT=颈动脉内膜中层厚度,ABI=踝臂指数,PWV=脉搏波传导速度
2.4 维汉民族间肾素-血管紧张素-醛固酮(RAA)系统活性 两组患者血浆卧立位肾素、血管紧张素、醛固酮活性比较,差异均无统计学意义(P>0.05,见表4)。

表4 维汉两组RAA系统活性比较
注:RAA=肾素-血管紧张素-醛固酮
3 讨论
高血压和OSAHS均为发病率较高且对健康危害较大的疾病,临床中高血压合并OSAHS患者数量呈逐年递增趋势[5]。动脉硬化的发生和发展与多种危险因素有关。高血压血管的主要损害表现为动脉粥样硬化[6],既往研究表明 OSAHS患者动脉僵硬度有所增高[7]。新疆是高血压伴OSAHS疾病的高发区,同时新疆又是一个多民族聚居的地区,少数民族以维吾尔族居多,结合临床诊疗实际需求,高血压伴OSAHS疾病对血管靶器官损害在维汉民族间是否存在差异值得探讨。
IMT、ABI、PWV均为动脉硬化的指标。研究表明,ABI可以反映全身动脉粥样硬化程度[8-9]。PWV指脉搏波在外周动脉两个既定点之间的传播速度,主要取决于管壁的生物学、几何特征和血液密度。由于血管几何特征和血液密度变化相对较小,因此该指标可以直接反映动脉壁僵硬度,并可预测心血管疾病的发生[10]。本研究结果显示,维吾尔族患者IMT大于汉族患者,左、右ABI小于汉族患者。由IMT和ABI结果说明高血压伴OSAHS疾病中维吾尔族患者动脉硬化程度更加严重,监测指标中左右PWV维吾尔族患者均大于汉族患者但无统计学差异,可能与本研究样本量较小有一定关系。同时维吾尔族患者中颈动脉硬化发生率高于汉族患者,所以在临床诊疗过程中更应警惕维吾尔族高血压伴OSAHS患者血管靶器官的损害,做到早期发现并积极进行干预,做好早期预防,以改善预后。
本研究结果显示维吾尔族患者BMI高于汉族患者,这可能与其遗传背景、饮食及生活方式有关。李南方等[5]研究表明,肥胖与高血压伴OSAHS患者发病密切相关,故高BMI可能是导致维吾尔族患者动脉硬化更加严重的影响因素,所以维吾尔族患者更应注意改善饮食、减肥,以降低BMI。本研究维吾尔族患者三酰甘油低于汉族患者,与众多维汉民族间相关研究不符,分析原因,一方面可能为患者所服用药物对血脂有影响,有待进一步查证;另一方面是本研究维吾尔族组样本量较小,可能存在选择性偏倚。尽管如此,维吾尔族患者的动脉硬化程度及发病率仍高于汉族患者,提示维吾尔族患者动脉硬化较汉族严重并不受三酰甘油影响。
马庆春等[11]研究表明原发性高血压合并OSAHS患者交感神经兴奋增强,RAA系统紊乱等机制可加重患者血管靶器官损害,导致动脉弹性下降,动脉硬化增加。Pratt-Ubunama等[12]研究也发现:醛固酮与原发性高血压合并OSAHS患者的血管损害严重程度相关。而本研究中维汉两民族高血压伴OSAHS患者血浆肾素、血管紧张素、醛固酮活性并无差异,说明RAA系统紊乱导致动脉硬化的机制在维汉族间的差异性不大,在两民族中对疾病的发生发展中作用相同。
有研究显示Fg是引起冠心病、动脉疾病的重要危险因素,与动脉粥样硬化也具有一定的相关性[13]。Fg是凝血反应中的关键凝血因子,Fg及其降解产物大量存在于动脉粥样斑块中,可刺激平滑肌细胞增生和迁移,促进血管内膜吸附脂蛋白,增加脂质在纤维斑块中的聚集,是动脉粥样硬化和血栓形成的重要因素[14]。本研究结果显示,维吾尔族患者Fg高于汉族患者,所以维吾尔族患者血管靶器官损害更加严重的原因可能与其Fb有关。因此,应针对性地关注维吾尔族患者Fg,注意对高Fg进行药物干预降纤治疗,动脉硬化患者进行饮食调整后,可能会阻止Fg的升高,但对降纤并无明显作用[15],故应早期对患者采取降纤药物治疗及饮食干预。
随着人们对血压规律的进一步认识,大量基础和临床研究表明PP是导致血管靶器官损伤的独立危险因素。首先,PP的增大使得大动脉僵硬度逐渐增加、弹性逐渐降低,大动脉内中膜厚度增加,使得血管弹性进一步减低;其次,由于僵硬的大动脉对心脏输出后的动脉压力的缓冲作用减弱,导致动脉张力作用的减弱从而诱发斑块破裂,促进血管壁的进行性损害和粥样硬化,使得心脑血管疾病的发病率和病死率增加[16]。本研究结果显示,维吾尔族患者PP高于汉族患者,提示维吾尔族高血压伴OSAHS患者血管靶器官损害更加严重的原因可能与其高PP有关。所以在高血压伴OSAHS患者临床治疗中,面对维吾尔族患者更应注意降低其收缩压,以达到降低其PP的目的。
综上所述,高血压伴OSAHS疾病中维吾尔族患者中动脉硬化程度更加严重,且发病率更高,这可能与维吾尔族患者BMI、Fg及PP高于汉族有一定联系。故临床工作中应更有针对性地开展防治工作。本研究尚存在不足之处,仅能通过Fg、PP等差异粗略推断维、汉族患者动脉硬化病变程度差异的相关影响因素,有待扩大样本量后进一步比较,得出更为确切的结论。建议根据不同危险分层决定控制目标和干预力度,对其临床治疗提供指导,不但有益于降低维吾尔族高危患者心血管疾病风险,提高疗效,更能满足不同民族患者的需要。
1 Goodfriend TL,Calhoun DA.Resistant hypertension,obesity,sleep apnea,and aldosterone:theory and therapy[J].Hypertension,2004,43(3):518-524.
2 《中国高血压防治指南》修订委员会.中国高血压防治指南2010[J].中华高血压杂志,2011,19(8):701-743.
3 中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J].中华结核和呼吸杂志,2012,35(1):9-12.
4 吴士荛.2003年欧洲高血压治疗指南的内容简介[J].国外医学:心血管疾病分册,2003,30(4):199-205.
5 李南方,韩瑞梅.高血压合并阻塞性睡眠呼吸暂停低通气综合征患者心血管危险因素分析[J].中华高血压杂志,2011,19(4):361-364.
6 黄慧琳,冷吉燕.高血压患者血清脂联素与左心室肥厚及颈动脉粥样硬化的关系[J].中国老年学杂志, 2012,32(13):2695-2697.
7 Tsioufis C,Thomopoulos K,Dimitriadis K,et al.The incremental effect of obstructive sleep apnoea syndrome on arterial stiffness in newly diagnosed essential hypertensive subjects[J].J Hypertens,2007,25(1):141-146.
8 Wang DZ,Tang Q,Hua Q.Prediction of coronary artery disease using pulse wave velocity and retinal artery lesions[J].Tohoku J Exp Med,2011,225(1):17-22.
9 Parr B,Noakes TD,Derman EW.Factors predicting walking intolerance in patients with peripheral arterial disease and intermittent claudication[J].S Afr Med J,2008,98(12):958-962.
10 Mitchell GF,Hwang SJ,Vasan RS,et al.Arterial stiffness and cardiovascular events:the Framingham Heart Study[J].Circulation,2010,121(4):505-511.
11 马庆春,孙宁玲,韩芳,等.高血压合并睡眠呼吸暂停综合征患者的肾素血管紧张素醛固酮活性与动脉弹性改变[J].中华高血压杂志,2008,16(9):793-796.
12 Pratt-Ubunama MN,Nishizaka MK,Boedefeld RL,et al.Plasma aldosterone is related to severity of obstructive sleep apnea in subjects with resistant hypertension[J].Chest,2007,131(2):453-459.
13 Chuang SY,Bai CH,Chen WH,et al.Fibrinogen independently predicts the development of ischemic stroke in a Taiwanese population:CVDFACTS study[J].Stroke,2009,40(5):1578-1584.
14 Loukas M,Dabrowski M,Wagner T,et al.Fibrinogen and smooth muscle cell detection in atherosclerotic plaques from stable and unstable angina——an immunohistochemical study[J].Med Sci Monit,2002,8(4):144-148.
15 谢丽华,侯玉立.动脉粥样硬化过程中血浆纤维蛋白原动态变化研究[J].中国药物与临床,2012,12(3):294-296.
16 Ludwig M,von Petzinger-Kruthoff A,von Buquoy M,et al.Intima media thickness of the carotid arteries:early pointer to arteriosclerosis and therapeutic endpoint[J].Ultraschall Med,2003,24(3):162-174.

