双联抗血小板聚集治疗的急性冠脉综合征患者在经皮冠状动脉介入术后应用雷贝拉唑的安全性研究
常 奕,马 腾,王 斌
急性冠脉综合征(ACS)是以冠状动脉粥样硬化斑块不稳定为基本病理生理特点,以急性心肌缺血为共同特征的一组临床综合征,包括不稳定性心绞痛(UA)、非ST段抬高型心肌梗死(NSTEMI)和ST段抬高型心肌梗死(STEMI)。目前,经皮冠状动脉介入(PCI)已经成为解决冠状动脉狭窄的最常用的治疗方法,PCI术后患者联合应用阿司匹林和氯吡格雷的双联抗血小板聚集治疗已成为常规治疗方案,但双联抗血小板聚集治疗增加了患者消化道溃疡、出血等不良事件的发生风险。因此,很多指南和共识推荐在双联抗血小板聚集治疗的基础上联合使用质子泵抑制剂(PPI)[1-2],但部分研究表明PPI可能影响氯吡格雷的疗效,进而增加不良心血管事件发生风险[3-4]。本研究为前瞻性随机对照试验,旨在探讨双联抗血小板治疗的ACS患者在PCI术后应用雷贝拉唑的安全性。
1 资料与方法
1.1 一般资料 选择我院2011年7月—2012年7月收住院的ACS患者120例,其中STEMI 37例,NSTEMI 18例,UA 65例,患者均符合美国心脏病学会/美国心脏协会(ACC/AHA)关于STEMI、NSTEMI及UA的诊断标准并接受PCI治疗。排除标准:(1)近两周内使用华法林等影响血小板聚集功能的药物;(2)血小板计数低于100×109/L;(3)贫血,血红蛋白(Hb)低于100 g/L;(4)对阿司匹林或氯吡格雷过敏或有禁忌证;(5)入组前1个月内已服用PPI、H2受体阻滞剂等;(6)伴有血液系统疾病、出血性疾病或有出血倾向;(7)伴有严重肝肾疾病或恶性肿瘤。根据计算机产生的随机数字号将入选患者分为雷贝拉唑组和对照组,每组60例,两组患者一般资料比较,差异无统计学意义(P>0.05,见表1),具有可比性。入组患者均签署知情同意书。
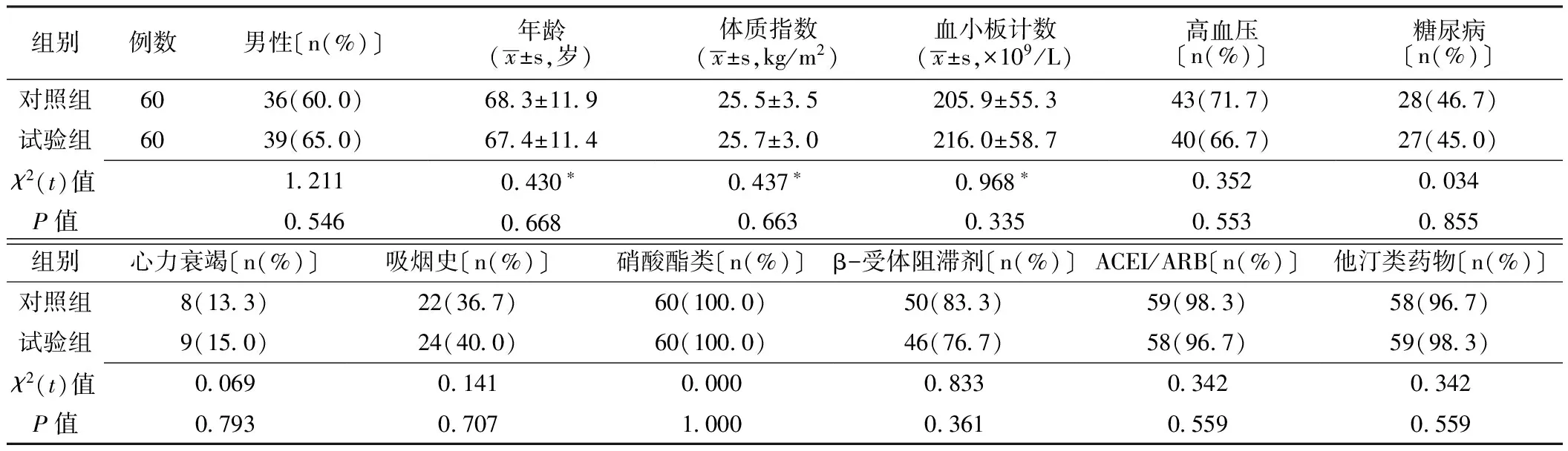
表1 两组患者一般资料比较
注:*为t值;ACEI=血管紧张素转换酶抑制剂,ARB=血管紧张素受体阻滞剂
1.2 治疗方法 两组患者均在PCI术前完善血、尿、便常规,肝肾功能,血脂等相关检查,常规给予硝酸酯类药物、β-受体阻滞剂、他汀类药物等进行治疗。术前均给予阿司匹林和氯吡格雷,首次氯吡格雷(波立维,杭州赛诺非安万特制药有限公司)负荷量300 mg/d,次日开始75 mg/d;首次阿司匹林负荷量300 mg/d,次日开始100~300 mg/d。雷贝拉唑组患者PCI术后加用雷贝拉唑钠肠溶胶囊(济诺,江苏济川制药有限公司)20 mg,1次/d,连续服用30 d为1个疗程;对照组不加用雷贝拉唑钠肠溶胶囊。
1.3 观察指标 两组患者均于PCI术后12 h内复查血常规、肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白I(TnI)等,出现临床症状或其他异常情况时加做心电图;PCI术前及术后7 d、1个月时晨起空腹采血,测定血小板聚集率,计算血小板聚集抑制率,血小板聚集抑制率=(基础血小板聚集率-用药后血小板聚集率)/基础血小板聚集率×100%;观察Hb变化情况及便隐血情况。
1.4 随访 两组患者PCI术后均随访3个月,随访方式包括门诊复查、再住院和(或)电话随访,记录其安全性终点事件:(1)主要消化系统安全性终点事件:胃十二指肠出血(通过胃镜或X线摄影证实),不明原因的消化道出血(Hb下降>2 g/L),胃十二指肠溃疡(通过胃镜或X线摄影证实),胃十二指肠糜烂(通过胃镜证实)、梗阻或穿孔。(2)主要心血管系统安全性终点:心源性死亡、非致死性心肌梗死、冠状动脉血运重建或因冠状动脉缺血而再次入院。

2 结果
2.1 血小板聚集抑制率 对照组血小板聚集抑制率为(34.8±0.58)%,雷贝拉唑组为(32.3±1.51)%,两组比较差异无统计学意义(t=0.115,P=0.909)。
2.2 Hb及便隐血 治疗前,对照组Hb水平为(130.6±13.9)g/L,雷贝拉唑组为(127.9±16.4)g/L,两组比较差异无统计学意义(t=1.004,P=0.317);治疗后,对照组Hb水平为(120.5±11.8)g/L,雷贝拉唑组为(125.6±14.2)g/L,两组比较差异有统计学意义(t=2.119,P=0.036)。对照组7例发生便隐血,雷贝拉唑组2例发生便隐血,两组比较差异无统计学意义(χ2=1.922,P=0.166)。
2.3 安全性终点事件 对照组4例发生不明原因的消化道出血,雷贝拉唑组无一例出现,两组比较差异无统计学意义(χ2=2.328,P=0.127);对照组2例发生非致死性心肌梗死,雷贝拉唑组1例发生心源性死亡,2例发生非致死性心肌梗死,两组比较差异无统计学意义(χ2=0.000,P=1.000)。
3 讨论
氯吡格雷是无活性的药物前体,进入体内经肝脏细胞色素P450混合功能氧化酶(CYP450酶)系氧化成为有活性的代谢产物,该活性产物有一个活化巯基基团,可与P2Y12受体(ADP的一种受体)的半胱氨酸残基形成二硫键,进而阻断ADP激活的血小板聚集的整个过程[5]。氯吡格雷必须经过两步代谢才能生效,CYP2C19在两步代谢中都起到了举足轻重的作用[6]。PPI在肝脏中的氧化代谢是由特异性或选择性CYP450同工酶催化的,参与PPI代谢的同工酶主要有CYP2C19和CYP3A4。因此,理论上讲,两药合用会对彼此应发挥的疗效产生相互影响,有学者认为PPI合用氯吡格雷会增加患者心血管不良事件的发生风险。
Gilard等[7]观察了105例采用氯吡格雷和阿司匹林进行抗血小板聚集治疗的患者,发现合用PPI的患者血管扩张刺激磷蛋白(VASP)水平明显高于未合用PPI患者,而VASP水平越高患者发生血栓栓塞的可能性就越大,即对氯吡格雷的反应性越低。Small等[8]以兰索拉唑作为研究用药,发现氯吡格雷和兰索拉唑合用时血小板聚集抑制率明显低于单纯使用氯吡格雷患者。Juurlink等[3]对13 636例急性心肌梗死患者进行的多因素分析发现,合用PPI增加了再发心肌梗死的风险,但服用泮托拉唑的患者中未发现这种影响。2010年4月,Ray等[9]针对冠心病患者进行的一项回顾性队列研究表明,合用PPI可有效地防止消化道出血的发生,且并未增加不良心血管事件的发生风险〔HR=0.99,95%CI(0.82,1.19)〕。Siriswangva等[10]在研究奥美拉唑与雷贝拉唑对氯吡格雷抑制血小板聚集率影响的试验中,通过测定平均最大血小板聚集率证实了奥美拉唑和雷贝拉唑均减少了氯吡格雷抑制血小板聚集率的效果,且雷贝拉唑并不优于奥美拉唑。
对PPI合用氯吡格雷治疗ACS的安全性研究表明,PPI是否会对氯吡格雷的疗效产生影响以及是否增加心血管不良事件的发生风险主要取决于PPI的类型。Li等[11]使用人类肝脏微粒体制备物和重组CYP2C19比较了目前临床上使用的5种PPI(奥美拉唑、兰索拉唑、泮托拉唑、雷贝拉唑、埃索拉唑)对CYP2C19的抑制能力,结果发现5种PPI对CYP2C19具有竞争性抑制作用,兰索拉唑和奥美拉唑的抑制能力较大,泮托拉唑和雷贝拉唑的抑制能力较小。由此可以推论,兰索拉唑和奥美拉唑对氯吡格雷的抗血小板聚集作用影响较大,而泮托拉唑和雷贝拉唑对氯吡格雷的抗血小板聚集作用影响较小。
本研究选取了对CYP2C19抑制能力较小的雷贝拉唑进行前瞻性随机对照试验,结果显示,雷贝拉唑组与对照组血小板聚集抑制率无明显差异,说明雷贝拉唑对氯吡格雷的抗血小板聚集作用无不良影响;而两组患者治疗前Hb水平无明显差异,治疗后雷贝拉唑组Hb水平要高于对照组,提示雷贝拉唑有助于减少消化道出血的发生。之后进行的随访发现,雷贝拉唑组3例发生主要不良心血管事件,对照组2例发生再发心肌梗死,但两组主要不良心血管事件发生率间无明显差异;雷贝拉唑组2例发生便隐血,无一例发生消化道出血,对照组7例发生便隐血,4例发生消化道出血,但两组便隐血和消化道出血发生率均无明显差异。由此可见,双联抗血小板治疗的ACS患者PCI术后应用雷贝拉唑并未增加患者心血管不良事件发生率,具有保护消化道、减少消化道出血的作用,与国内外多数研究结果是一致的。但由于本研究样本量较小,观察时间较短,雷贝拉唑对消化道的保护作用并未充分体现,仍需更大规模和更长观察时间的临床研究以进一步观察其长期安全性。
1 Bhatt DL,Scheiman J,Abraham NS,et al.ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use:a report of the America College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents[J].Circulation,2008,118(18):1894-1909.
2 Abraham NS,Hlatky MA,Antman EM,et al.ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines:a focused update of the ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use[J].Am J Gastroenterol,2010,105(12):2533-2549.
3 Juurlink DN,Gomes T,Ko DT,et al.A population-based study of the drug interaction between proton pump inhibitors and clopidogrel[J].CMAJ,2009,180(7):713-718.
4 Ho PM,Maddox TM,Wang L,et al.Risk of adverse outcomes associated with concomitant use of clopidogrel and proto pump inhibitors following acute coronary syndrome[J].JAMA,2009,301(9):937-944.
5 Clarke TA,Waskell LA.The metabolism of clopidogrel is catalyzed by human cytochrome P450 3A and is inhibited by atorvastatin[J].Drug Metab Dispos,2003,31(1):53-59.
6 Steinhubl SR.Genotyping,clopidogrel metabolism,and the search for the therapeutic window of thienopyridines[J].Circulation,2010,121(4):481-483.
7 Gilard M,Arnaud B,Le Gal G,et al.Influence of omeprazole on the antiplatelet action of clopidogrel associated to aspirin[J].J Thromb Haemost,2006,4(11):2508-2509.
8 Small DS,Farid NA,Payne CD,et al.Effects of the proton pump inhibitor lansoprazole on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel[J].J Clin Pharmacol,2008,48(4):475-484.
9 Ray WA,Murray KT,Griffin MR,et al.Outcomes with concurrent use of clopidogrel and proton-pump inhibitors:a cohort study[J].Ann Intern Med,2010,152(6):337-345.
10 Siriswangvat S,Sansanayudh N,Nathisuwan S,et al.Comparison between the effect of omeprazole and rabeprazole on the antiplatelet action of clopidogrel[J].Circulation,2010,74(10):2187-2192.
11 Li XQ,Andersson TB,Ahlström M,et al.Comparison of inhibitory effects of the proton pump-inhibiting drugs omeprazole,esomeprazole,lansoprazole,pantoprazole,and rabeprazole on human cytochrome P450 activities[J].Drug Metab Dispos,2004,32(8):821-827.

