老年2型糖尿病合并亚临床甲状腺功能减退症患者血管舒张功能的影响因素研究
付秀立,赵 湜,毛 红,王中京
亚临床甲状腺功能减退症(甲减)可引起血脂异常、动脉粥样硬化和心功能不全等[1-2],2型糖尿病患者亚临床甲减发生率高于普通人群,且合并亚临床甲减的2型糖尿病患者血管并发症发生风险增加,病死率升高[3-4]。内皮功能受损是动脉粥样硬化的始动环节,与心血管疾病密切相关,亚临床甲减患者内皮功能障碍在动脉粥样硬化的发生发展过程中发挥着重要作用。超敏C反应蛋白(hs-CRP)和白介素6(IL-6)是炎症过程中的标志性因子。本研究旨在探讨老年2型糖尿病合并亚临床甲减患者血管舒张功能的影响因素。
1 对象与方法
1.1 研究对象 选择华中科技大学同济医学院附属武汉市中心医院内分泌科2009年4月—2011年10月住院老年2型糖尿病患者241例,均符合世界卫生组织(WHO)1999年制定的2型糖尿病诊断标准,排除糖尿病急性并发症、恶性肿瘤、肝肾功能异常、感染、已知甲状腺疾病并服用甲状腺激素类药物或抗甲状腺药物及服用影响甲状腺功能的药物如糖皮质激素、雌激素等。将患者中未合并亚临床甲减者144例纳入对照组,合并亚临床甲减者97例纳入观察组。两组患者的性别构成、平均年龄、糖尿病病程、吸烟史、高血压病史、冠心病病史比较,差异均无统计学意义(P>0.05,见表1)。
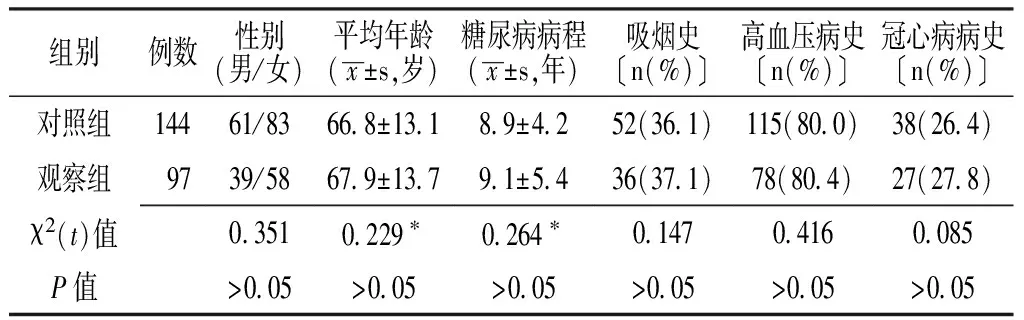
表1 两组患者的一般资料比较
注:*为t值
1.2 诊断标准 游离三碘甲状腺原氨酸(FT3)参考值为3.43~5.55 pmol/L,游离甲状腺素(FT4)参考值为10.68~17.77 pmol/L,促甲状腺激素(TSH)参考值为0.35~4.94 mU/L。以TSH>4.94 mU/L,FT4在参考值范围内定义为亚临床甲减。吸烟史指每天至少吸烟1支且连续吸烟>1年,现在仍在吸烟或入组时戒烟时间不足0.5年。高血压病史指收缩压≥140 mm Hg(1 mm Hg=0.133 kPa)和(或)舒张压≥90 mm Hg,或目前正在服用降血压药物,排除继发性高血压。冠心病病史指冠状动脉造影显示左主干、前降支、回旋支、右冠状动脉或其主要分支血管直径狭窄超过50%。
1.3 观察指标 测量所有患者身高、体质量,计算体质指数(BMI),BMI(kg/m2)=体质量(kg)/身高2(m2)。所有患者禁食12 h后清晨统一采集空腹静脉血,采用全自动生化分析仪检测空腹血糖(FPG)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),化学发光法检测FT3、FT4、TSH,离子交换高压液相色谱法(HPLC法)检测糖化血红蛋白(HbA1c),免疫比浊法检测hs-CRP,放射免疫法检测IL-6。
1.4 肱动脉血流介导的血管舒张功能(FMD) 采用高频彩色多普勒超声仪检测FMD并同步记录心电图,探头频率为11 mHz。操作方法:患者休息10 min后平卧,右上肢外展15°,掌心向上,采用二维超声成像扫描肱动脉,测定舒张末期内径(D0),再用带袖套式充气止血带的血压计在肘关节以上加压至200 mm Hg,5 min后快速放松止血带以增加血流量,即反应性充血,放气后60 s内记录肱动脉内径(D1)。FMD=(D1-D0)/D0×100%。

2 结果
2.1 观察指标 两组患者BMI、FT3、FT4、FPG、HbA1c、HDL-C比较,差异均无统计学意义(P>0.05);观察组患者的TSH、TG、TC、LDL-C、hs-CRP、IL-6高于对照组,FMD低于对照组,差异均有统计学意义(P<0.05,见表2)。
2.2 相关性分析 Pearson相关分析结果显示,观察组患者的TSH、hs-CRP、IL-6、TG、TC与FMD呈负相关(P<0.01,见表3),hs-CRP、IL-6与TSH呈正相关(P<0.05,见表4)。
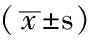
表2 两组患者的观察指标比较
注:BMI=体质指数,FT3=游离三碘甲状腺原氨酸,FT4=游离甲状腺素,TSH=促甲状腺素,FPG=空腹血糖,HbA1c=糖化血红蛋白,TG=三酰甘油,TC=总胆固醇,LDL-C=低密度脂蛋白胆固醇,HDL-C=高密度脂蛋白胆固醇,FMD=肱动脉血流介导的血管舒张功能,hs-CRP=高敏C反应蛋白,IL-6=白介素6

表3 各观察指标与FMD之间的Pearson相关分析

表4 各观察指标与TSH之间的Pearson相关性分析
2.3 多因素Logistic回归分析 为避免血脂异常对血管舒张功能的影响,在校正TC、TG、LDL-C、HDL-C后进行多因素Logistic回归分析,结果显示,TSH、hs-CRP、IL-6对回归方程的影响均有统计学意义(P<0.01,见表5)。
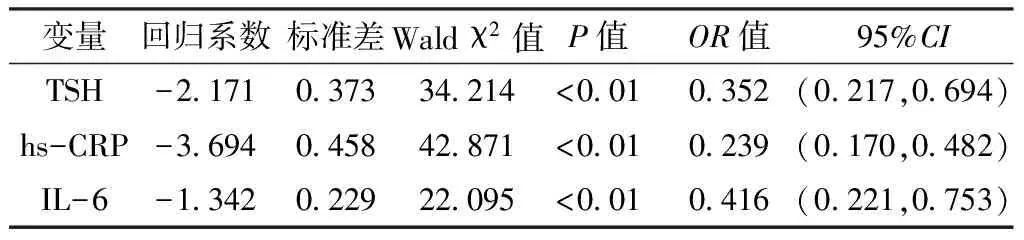
表5 2型糖尿病合并亚临床甲减患者FMD的影响因素多因素Logistic回归分析
3 讨论
血管内皮功能受损是动脉粥样硬化的重要环节,内皮功能障碍对动脉粥样硬化的发生发展具有始动和促进作用,而动脉粥样硬化可以加重内皮功能损伤,FMD是衡量内皮功能的重要指标。本研究结果显示,观察组患者FMD明显下降,Pearson相关分析结果显示,TSH与FMD呈负相关;在校正TC、TG、LDL-C、HDL-C后进行的多因素Logistic回归分析结果显示,TSH与FMD仍呈负相关,提示亚临床甲减可加重2型糖尿病患者的内皮功能损伤。Shavdatuashvili等[5]研究发现,亚临床甲减患者内皮依赖性血管舒张功能(EDV)较正常甲状腺功能者明显降低,Türemen等[6]和Kilic等[7]研究均显示,亚临床甲减患者FMD及非内皮依赖性血管舒张(NTG)降低,内皮功能损伤。本研究结果与以上研究结果一致。
亚临床甲减可通过多种途径加重2型糖尿病患者的内皮功能损伤。本研究研究结果显示,观察组患者TG、TC、LDL-C水平明显升高,Pearson相关分析结果显示,TG、TC与FMD呈负相关,提示合并亚临床甲减的2型糖尿病患者血脂水平明显升高,内皮功能损伤更为严重。血脂水平升高可增加一氧化氮合酶(eNOS)内源性抑制剂——非对称性二甲基精氨酸水平,进而减少eNOS的表达,导致内皮功能损伤。Taddei等[8]研究发现,亚临床甲减患者经甲状腺素替代治疗后,甲状腺功能、血脂水平恢复正常,部分患者损伤的EDV得以改善。
本研究结果显示,观察组hs-CRP、IL-6水平明显升高,且Pearson相关分析结果显示,hs-CRP、IL-6与FMD呈负相关,在校正TC、TG、LDL-C、HDL-C后进行的多因素Logistic回归分析结果显示,hs-CRP、IL-6与FMD仍呈负相关,提示2型糖尿病合并亚临床甲减患者慢性炎症反应加重,这可能也是造成血管内皮功能障碍的重要原因。
Kvetny等[9]对1 212例亚临床甲减患者进行观察发现,其hs-CRP水平升高,心血管事件发生率增加。Tuzcu等[10]研究发现,亚临床甲减患者胰岛素、hs-CRP水平升高,认为hs-CRP介导的低度慢性炎症反应与高胰岛素血症密切相关,慢性炎症反应是2型糖尿病患者胰岛素抵抗及动脉粥样硬化发生发展的重要因素。炎性因子hs-CRP和IL-6水平升高可预测2型糖尿病患者胰岛素抵抗程度。Maratou等[11]研究发现,亚临床甲减患者单核细胞膜表面的葡萄糖转运蛋白4(GLUT4)水平降低,葡萄糖向细胞膜表面的转运减少导致葡萄糖向细胞内的转运障碍,胰岛素抵抗程度更加严重,给予甲状腺素替代治疗后胰岛素敏感性得以改善。Türemen等[6]研究显示,亚临床甲减患者血管舒缩功能较甲状腺功能正常者明显降低,肿瘤坏死因子α(TNF-α)、IL-6、hs-CRP水平明显升高,且TNF-α、IL-6、hs-CRP与EDV呈负相关,本研究结果与以上研究结果一致。
综上所述,亚临床甲减加重了老年2型糖尿病患者血管内皮功能损伤,TSH、hs-CRP、IL-6水平升高是其危险因素,除与血脂水平升高相关外,体内慢性炎症反应也是血管内皮功能受损的重要原因。但本研究为单中心研究,反映的情况较为局限,所得结论仍需进行多中心联合的大规模临床试验进行验证,而给予甲状腺素替代治疗能否有效改善老年2型糖尿病合并亚临床甲减患者的血管内皮功能还有待于更深入的研究。
1 Rodondi N,den Elzen WP,Bauer DC,et al.Subclinical hypothyroidism and the risk of coronary heart disease and mortality[J].JAMA,2010,304(12):1365-1374.
2 Tseng FY,Lin WY,Lin CC,et al.Subclinical hypothyroidism is associated with increased risk for all-cause and cardiovascular mortality in adults[J].J Am Coll Cardiol,2012,60(8):730-737.
3 Chen HS,Wu TE,Jap TS,et al.Subclinical hypothyroidism is a risk factor for nephropathy and cardiovascular diseases in type 2 diabetic patients[J].Diabet Med,2007,24(12):1336-1344.
4 Yang JK,Liu W,Shi J,et al.An association between subclinical hypothyroidism and sight-threatening diabetic retinopathy in type 2 diabetic patients[J].Diabetes Care,2010,33(5):1018-1020.
5 Shavdatuashvili T.Lipoprotein profile and endothelial function in patients with subclinical and overt hypothyroidism[J].Georgian Med News,2005(129):57-60.
6 Türemen EE,Çetinarslan B,Sahin T,et al.Endothelial dysfunction and low grade chronic inflammation in subclinical hypothyroidism due to autoimmune thyroiditis[J].Endocr J,2011,58(5):349-354.
7 Kilic ID,Tanriverdi H,Fenkci S,et al.Noninvasive indicators of atherosclerosis in subclinical hypothyroidism[J].Indian J Endocrinol Metab,2013,17(2):271-275.
8 Taddei S,Caraccio N,Virdis A,et al.Impaired endothelium-dependent vasodilatation in subclinical hypothyroidism:beneficial effect of levothyroxine therapy[J].J Clin Endocrinol Metab,2003,88(8):3731-3737.
9 Kvetny J,Heldgaard PE,Bladbjerg EM,et al.Subclinical hypothyroidism is associated with a low-grade inflammation,increased triglyceride levels and predicts cardiovascular disease in males below 50 years[J].Clin Endocrinol(Oxf),2004,61(2):232-238.
10 Tuzcu A,Bahceci M,Gokalp D,et al.Subclinical hypothyroidism may be associated with elevated high-sensitive C-reactive protein(low grade inflammation)and fasting hyperinsulinemia[J].Endocr J,2005,52(1):89-94.
11 Maratou E,Hadjidakis DJ,Kollias A,et al.Studies of insulin resistance in patients with clinical and subclinical hypothyroidism[J].Eur J Endocrinol,2009,160(5):785-790.

