用数字化信息系统测定氢氧化钠与二氧化碳的反应
谭玲

《化学》(上教版9年级第2学期)第5章讲述碱的化学性质时,涉及到氢氧化钠与二氧化碳的反应,该反应的实验本身没有明显的现象,中学化学教材及相关资料中也仅仅利用了检验生成物,运用密闭容器中反应前后压强差等定性方法证明反应的发生。为此,我借助数字化信息系统(DIS)测定化学反应中二氧化碳浓度、pH值的变化,从定量的角度证明氢氧化钠能与二氧化碳反应。设计了如图1所示的装置。
实验用品
350mL定制反应容器(2个)、pH传感器(2个)、pH采集器(2个)、二氧化碳传感器(2个)、注射器(2个)、制取二氧化碳的实验装置和药品、DIS实验系统及设备。
实验步骤和现象
将二氧化碳传感器、pH传感器与采集器、电脑连接。
用2个注射器分别抽取40mL饱和氢氧化钠溶液和水。
分别将带有二氧化碳传感器、pH采集器、注射器的橡皮塞塞在盛有二氧化碳的反应容器上。
打开二氧化碳传感器、pH传感器开关,打开相应的实验模板,单击“脱机”,单击“开始”选项,采集二氧化碳浓度。
待二氧化碳浓度示数稳定后,将注射器中的氢氧化钠溶液和水迅速注入专用反应容器中,观察图像中显示的二氧化碳浓度、pH值随时间的变化。
待二氧化碳的浓度、pH值稳定后,单击“结束”并保存实验所得数据。
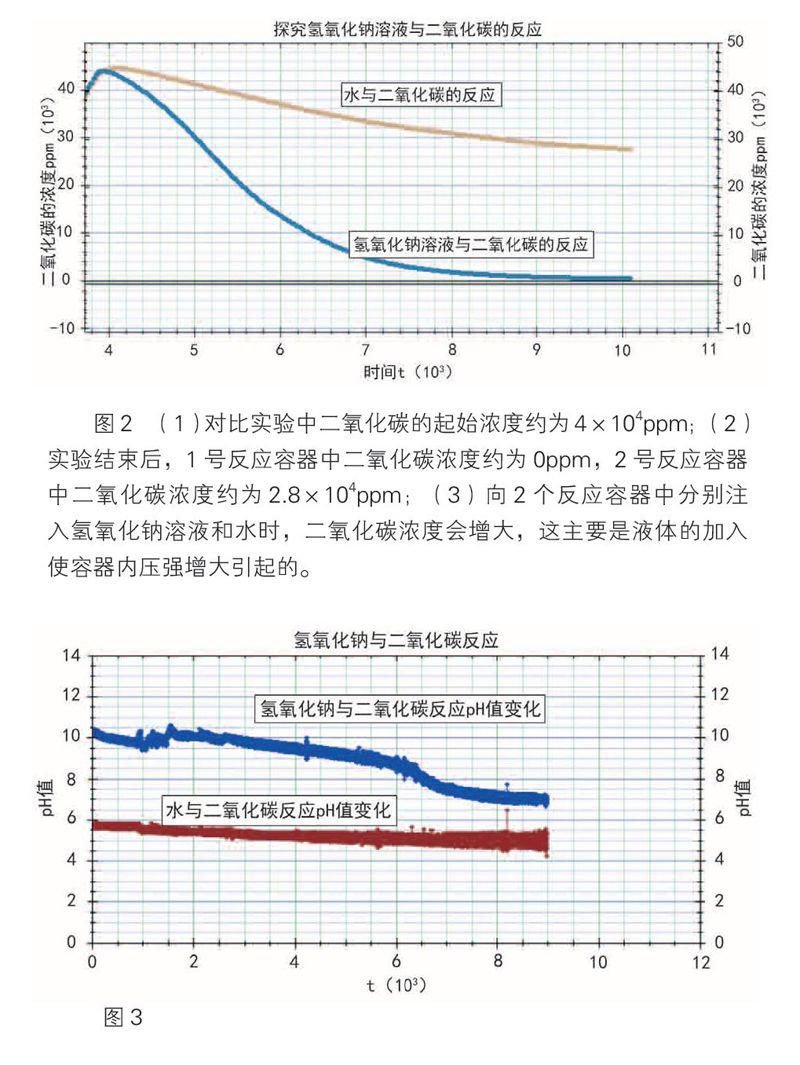
现象1(如图2所示):氢氧化钠溶液消耗二氧化碳的量远多于水。
现象2(如图3所示):氢氧化钠与二氧化碳反应后,pH值变化范围是11~7.14,水与二氧化碳反应后,pH值变化范围是6~5。实验创新之处
通过采集二氧化碳的浓度、pH值,可以及时、准确地通过图像显示化学反应中人体感官不能感知的现象,提供了一种新的实验探究方法。
本装置包含水与二氧化碳的反应,排除了氢氧化钠溶液中溶剂水对二氧化碳消耗量减少的影响。通过对比实验,使实验结果更加明显、准确。
装置简单,操作方便。明显、直观的现象使学生更易明白酸性气体的处理方法,即用氢氧化钠溶液吸收。
实验设计说明
本实验设计是关于等体积的氢氧化钠饱和溶液、水分别与等浓度的二氧化碳反应,消耗二氧化碳、pH值变化的对比实验。其中,二氧化碳与水反应的实验主要是排除氢氧化钠溶液中水对二氧化碳浓度减少的影响。在实验器材的选择上,制取二氧化碳的发生装置采用启普发生器,便于控制二氧化碳的收集2个反应容器采用体积相同的定制反应容器,便于用排水法收集较纯净的二氧化碳,并在安装传感器时应尽量减少瓶中二氧化碳的损失及空气的进入;氢氧化钠溶液和水的加入通过2个体积相同的注射器,能有效控制加入的速度,操作方便、简单。
该项目获得第27届全国青少年科技创新大赛科技辅导员创新成果科教制作类一等奖。
专家评语
该项目通过使用二氧化碳探测器和pH计,将中学化学中经典的氢氧化钠溶液与二氧化碳气体的反应作实时监控,为中学化学实验的定量测试提供了非常好的教具。该项目原理科学,概念清晰,构思巧妙,设计合理,作品教育性强。项目选题新颖,具有实质性创新,对传统方法有突破。

