六味地黄汤对5/6肾切除大鼠肾间质纤维化的影响
隆献 何泽云 周艳利 罗寅亮 李岩岩 徐文峰 李旭华
肾间质纤维化以细胞外基质在肾间质过量积聚、肾脏组织结构破坏及功能丧失为特征,是多种慢性肾脏疾病走向肾功能衰竭的主要病理改变。其发病机制通常认为与上皮细胞转分化、炎症反应、细胞凋亡及多种细胞因子的共同作用等有关。近年来HGF作为一种具有负性调控肾纤维化效应的肾脏保护因子得到了广泛关注[1]。
以往研究显示,六味地黄丸能促进5/6肾切除大鼠残肾肾小球化生、延缓肾切除大鼠肾组织纤维化[2-3],但其具体作用机制尚未得到完全阐明。本实验拟通过研究HGF及其特异性受体c-Met在5/6肾切除大鼠模型残肾的表达及六味地黄汤对其表达的影响,探讨六味地黄汤抗肾纤维化的可能作用机制,为中医药防治肾间质纤维化提供思路和实验基础。
1 材料与方法
1.1实验材料
1.1.1实验动物SD大鼠40只,6~8周龄,重量180~220 g,由湖南斯莱克景达实验动物有限公司提供,批号:SCXK(湘)2009-0004。大鼠饲养环境保持通风、恒温,每日更换垫料,定期消毒笼具;每天给予12小时灯光照射。
1.1.2主要试剂兔抗大鼠HGF多克隆抗体(BAO911),购自武汉博士德生物工程有限公司;兔抗大鼠c-Met多克隆抗体(BS-0668R),购自北京博奥森生物技术有限公司;HRP标记山羊抗兔IgG多聚体(PV-9001)、DAB显色剂试剂盒(AR1022),均购自北京中杉金桥生物技术有限公司。
1.1.3实验药物六味地黄汤(熟地黄24 g、山茱萸12 g、山药12 g、泽泻9 g、茯苓9 g、牡丹皮9 g)购自湖南中医药大学第一附属医院药剂科,由课题组自行制备药液。制备方法:先将药材用相当于药材2倍的自来水浸泡2小时,武火煮沸后再文火煎熬30分钟,过滤后收集煎液,原药渣再加少量水煎煮,取二煎液。将两煎液混合,于水浴恒温器上浓缩。浓缩药液每毫升含生药1 g。
1.2实验方法实验动物按体重从轻到重编号,按随机数字表分为假手术组(n=10)、模型组(n=15)和六味地黄汤组(n=15)。动物适用性喂养一周后,模型组、六味地黄汤组均按照文献[4]在无菌条件下行5/6肾切除手术。用10%水合氯醛麻醉(0.3 ml/100 g)腹腔注射麻醉大鼠,分离左肾,行上下极切除,1周后再次麻醉大鼠,切除右肾。假手术组同期行两次手术,每次仅打开腹腔,暴露肾脏后关腹。第二次手术后7天,开始进行干预。六味地黄汤组每天上午予六位地黄汤灌胃(大鼠用药剂量=成人剂量mg/d×0.018/体重)计算[5]。假手术组、模型组均予等体积蒸馏水灌胃。共给药8周。在造模过程及造模后一周内,模型组3只大鼠、六味地黄汤组2只大鼠死亡。死亡原因有麻醉意外、术中大出血及术后感染等。予以剔除。模型组剩余大鼠12只,六味地黄汤组剩余大鼠13只。
实验结束后处死大鼠,取出大鼠残肾组织,4%多聚甲醛固定,石蜡包埋,分别用于HE、Masson染色及免疫组化检测。
1.3检测项目和方法
1.3.1组织学观察取石蜡块,4 μm切片后分别进行HE及Masson染色。MOTIC光学显微镜下观察。
1.3.2免疫组织化学检测采用SP法。取石蜡块,4 μm切片,常规脱蜡至水。3% H2O2室温孵化10分钟,蒸馏水漂洗后,热修复抗原,冷却后用PBS液漂洗两次。将切片放入湿盒中,每张切片分别滴加兔抗大鼠HGF多克隆抗体50 μl(1∶100稀释),37℃孵育2小时。以PBS代替一抗作为空白对照。PBS漂洗滴后滴加HRP标记羊抗兔IgG多聚体50 μl,室温孵育20分钟。DAB显色,苏木素轻度复染,脱水,透明,中性树胶封片。c-Met染色步骤同HGF。用MOTIC多媒体彩色病理图像分析系统软件进行分析。每例切片随机选取10个200倍不重叠视野,计算阳性染色面积与视野内肾间质总面积(去除肾小球)的比值并取平均值。
1.4统计学处理
2 结果
2.1肾组织光镜检查
2.1.1HE染色5/6肾切除大鼠残肾组织HE染色显示,假手术组大鼠肾小球、肾小管和间质形态正常,结构清晰;模型组肾小球系膜细胞增生,部分肾小球形成局灶性或迷漫性硬化,毛细血管绊扩张,肾小囊扩张,肾小囊壁层上皮细胞增生,肾小管发生代偿性扩张,可见蛋白管型,肾间质可见大量炎症细胞浸润及纤维组织增生。与模型组相比,六味地黄汤组病理变化较轻,肾小球硬化、肾小管扩张及间质纤维化程度减轻。见图1。

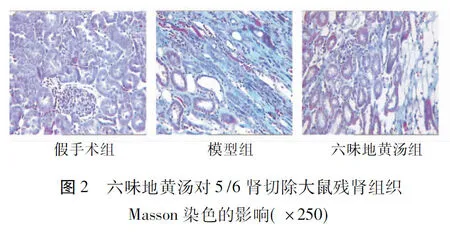
2.1.2Masson染色5/6肾切除大鼠残肾组织Masson染色结果显示,假手术组肾脏形态正常,肾间质无明显胶原纤维;模型组肾间质及肾小球内均可见大量染成蓝色的胶原纤维;六味地黄丸组胶原纤维也明显增生,但较模型组减轻。见图2。
2.2六味地黄汤对5/6肾切除大鼠残肾组织HGF蛋白和c-Met蛋白的影响
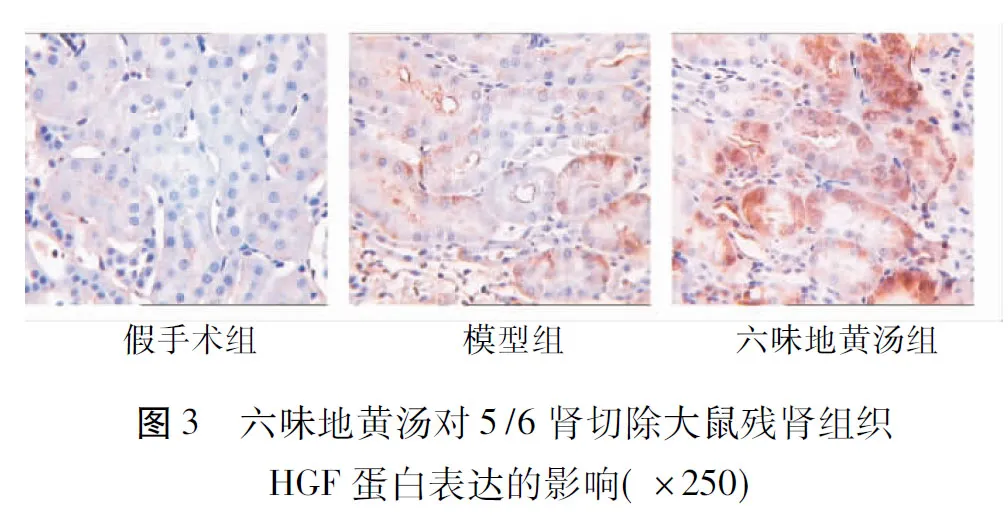
2.2.1HGF蛋白表达免疫组化HGF阳性表达为棕黄色显色,主要表达于肾小球系膜、基底膜及肾小管上皮细胞的胞浆。假手术组可见有微量阳性表达,模型组、六味地黄汤组呈强阳性表达。计算各组阳性染色面积比,模型组明显高于假手术组,经Dunnett T3法分析,P=0.013,即P<0.05,两组比较差异有统计学意义。六味地黄汤组阳性表达强于假手术组,经Dunnett T3法分析,P=0.000,即P<0.01,两组比较有显著性差异。六味地黄汤组阳性表达强于模型组,经单因素方差分析Dunnett T3法分析,P=0.014,即P<0.05,两组比较差异有统计学意义。见表1和图3。
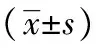
表1 六味地黄汤对5/6肾切除大鼠残肾组织 HGF/C-met蛋白表达的影响
注:与假手术组相比,aP<0.05;与假手术组相比,bP<0.01;与模型组相比,cP<0.05;与模型组相比,dP<0.01。
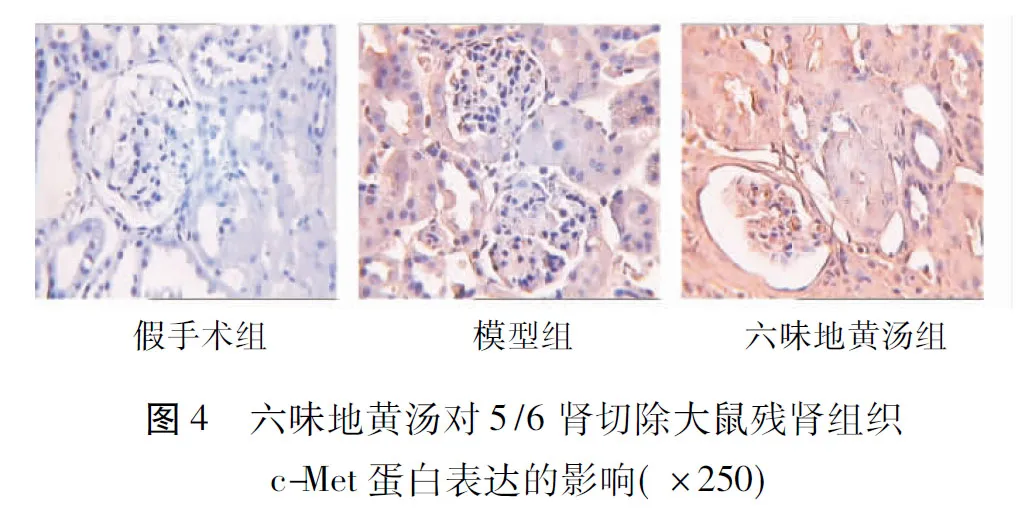
2.2.2c-Met蛋白表达免疫组化c-Met阳性表达为棕黄色显色,主要表达于细胞胞膜。假手术组未见明显阳性表达,模型组和六味地黄汤组在肾小管上皮细胞胞膜上和肾间质上有阳性表达,部分肾小球系膜细胞胞膜亦有表达。计算各组阳性表达面积,模型组、六味地黄汤组表达明显强于假手术组,经Dunnett T3法分析,P=0.000,即P<0.01,差异有显著性差异。六味地黄汤组表达强于模型组,经Dunnett T3法分析,得出P=0.000,即P<0.01,两组比较有显著性差异。见表1和图4。
3 讨论
目前对于肾间质纤维化形成的病理生理机制及其对应的干预手段研究颇多。HGF作为一种对多种器官具有多效性的多肽细胞因子,是目前公认的最重要的抗纤维化因子之一。王昆等[7]研究表明,用HGF干预,可以减轻结缔组织生长因子刺激下的人肾小管上皮间质纤维化形成。外源性加入HGF后,对于高糖诱导引起肾间质成纤维细胞,可以通过促进细胞增殖,抑制高糖诱导的细胞肥大,从而减轻肾小管简直纤维化[8]。HGF抗纤维化作用机制可能包括:拮抗转化生长因子β1的致纤维化作用;维持细胞外基质的生成和降解平衡;抗炎作用;抑制肾小管上皮细胞间充质转变;抑制多种肾脏固有细胞的凋亡等[9]。c-Met是HGF的受体,其特点是高亲和力低能力,HGF的细胞内效应主要是通过与c-Met结合完成。HGF与c-Met特异结合后,诱导c-Met上的酪氨酸磷酸化。磷酸化后的酪氨酸残基与含SH2功能区的信号转导蛋白结合,聚集细胞内分子,激活细胞内多个信号传到级联从而产生生理效应[10]。HGF/c-Met系统的表达上调是机体的一种防御反应,对抑制肾间质纤维化,维持、重建小管结构和功能起重要作用。
本研究发现,5/6肾切除术后大鼠梗残存肾脏的HGF、c-Met表达明显升高。提示5/6肾切除术后,残存肾小球高滤过,残存肾小管高代谢,引起组织细胞损伤,从而诱发机体产生一系列防御反应,HGF/c-Met系统上调,促进细胞有丝分裂和损伤修复,从而有助于保护肾脏的结构和功能,抑制肾间质纤维化的产生。
本实验中,应用六味地黄汤对5/6肾切除术后大鼠干预后,HGF、c-Met表达明显比模型组升高,肾间质纤维化和肾小球等病理改变比模型组减轻,显示六味地黄汤能有效促进HGF、c-Met表达,从而延缓肾间质纤维化。
[1]梁明,陈卫东.肝细胞生长因子与肾脏纤维化的逆转[J].临床合理用药杂志,2009,2(14):121-123.
[2]何泽云,陈江华,李晓峰.六味地黄丸对5/6肾切除大鼠残肾肾小球化生的影响[J].湖南中医学院报,2004,24(2):1-3.
[3]李万斌,何泽云.六味地黄丸延缓5/6肾切除大鼠肾组织纤维化研究[J].中国药师,2009,12(4):411-413.
[4]Tomino Y, Suzuki S, Azushima C, et a1. Asian multicenter trials on urinary type IV collagen in patients with diabetic nephropathy[J]. J Clin Lab Anal, 2001, 15(4):188-192.
[5]徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2002:1833.
[6]沙朝晖,付平,周莉,等.大鼠5/6肾切除慢性肾功能衰竭动物模型的实验研究[J].四川动物,2006,25(3):632-634.
[7]王昆,吴阳,杨昱,等,肝细胞生长因子对结缔组织生长因子刺激下肾小管上皮间质纤维化的影响[J].中国实用医药,2011,6(3):50-51.
[8]牟姗,张庆怡,倪兆慧,等.HGF对高糖诱导肾间质成纤维细胞增殖的影响[J].上海第二医科大学学报,2004,24(8):641-644.
[9]丘余良,阮诗玮.肝细胞生长因子对肾纤维化保护作用研究进展[J].中国中西医结合肾病杂志,2008,9(7):653-655.
[10]Liu Y.Hepatocyte growth factor in kidney fibrosis:therapeutic potential and mechanisms of action[J].Am J Physiol Renal Physiol,2004,287(1):F7-F16.

