基质分散萃取——反相高效液相色谱法测定杨梅中氯吡脲
杨 柳,朱杰丽,吴翠蓉,陆 军,柴振林*,周利雄
(1.浙江省林产质量检测站,浙江 杭州 310023;2.江山市林业局,浙江 江山 323700)
氯吡脲是一种高活性的植物生长调节剂,主要成分为1-(2-氯-4-吡啶基)-3-苯基脲,具有促进细胞分裂、提高光合作用效率、增强抗逆性、保花保果、提高坐果率、果实膨大等作用,对作物采后生理也有积极作用[1-2]。目前,氯吡脲已应用于西瓜、葡萄、猕猴桃等多种农作物,在美国、欧盟、日本等国也都允许使用。因氯吡脲可能会对人体带来潜在的健康危害,欧盟、日本等对其残留量作出了严格限定,其中日本“肯定列表”对部分浆果限量为0.02 mg/kg,而美国早在1996年便规定氯吡脲在猕猴桃中的限量为0.04 mg/kg[3],我国在2009年也出台了相应的农业行业标准,对西瓜、黄瓜、猕猴桃和葡萄中氯吡脲作了限量规定[4],但在杨梅上还没有限量规定及成熟的测定方法。目前,有关氯吡脲检测方法的报道主要是液相色谱法[5-7]、液相色谱-飞行时间质谱(LC/TOF-MS)法[8],涉及的样品有猕猴桃、黄瓜、西瓜、葡萄、土壤等[9-10],杨梅中氯吡脲的测定未见报道。杨梅属杨梅科杨梅属的亚热带常绿果树,原产于中国东南部,是浙江省特色水果栽培面积最大,产量最高,品质最佳,然而杨梅成熟于高温多雨季节,又为浆果且无外果皮,外喷药剂极易侵入果实可食部分,产生安全隐患[11-12]。
本试验基于 NY/T 761 -2008[13]、NY/T 1680 -2009[14]用乙腈作为提取剂,高速分散器作为提取设备,氨基小柱为净化柱,甲醇为淋洗、乙腈定容,建立了杨梅中氯吡脲残留的基质分散萃取——反相高效液相色谱检测方法,可为杨梅中氯吡脲残留限量设定及标准检验方法的确定提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料、仪器设备与试剂 杨梅样品来源于浙江省临海市杨梅实验基地。
DIONX P680高效液相色谱仪(美国戴安),配ASI-100四元泵系统配置、UV170U四通道紫外检测器,Kromasil C18(250mm ×4.6mm,5μm)不锈钢柱,IKA T18 basic高速分散器,Autoscience AS3120A超声波清洗器,旋转蒸发仪(Buchi)等,氨基柱(500 mg/6mL),固相萃取、真空装置(Supelco),磨样机(Joyoung)。
甲醇、乙腈均为色谱纯(Tedia Company USA),氯化钠为分析纯。氯吡脲(98.7%)标准物质购于Sigma公司,用流动相配制成一定浓度的标准溶液。
1.1.2 色谱条件 色谱柱:Kromasil C18(250mm×4.6mm,5 μm)不锈钢柱;以流动相∶乙腈∶水(67/33,V/V)为流动相,经过0.45 μm的微孔滤膜过滤和超声波脱气处理;柱温40℃;流速1mL/min;检测波长265 nm;进样量10μL;外标法定量。
1.2 样品制备及提取、净化
磨样磨制杨梅样品1 kg,从中称取25.00 g于150mL高型烧杯中,加50mL乙腈,于高速分散器分散提取1min(15000 r/min)后过滤于预先装有5 g氯化钠的50mL长直试管中,盖上盖子剧烈振摇30 s以上,静置30min,待分层停止后净化。吸取上清乙腈提取液10mL于平底烧瓶中,40℃水浴旋转蒸发干,取下后用10mL甲醇分3次洗入甲醇预洗过的固相萃取小柱内,保持柱流速度为20 d/min,待前一次洗入液没于柱内时及时将下一次的注入。取出淋洗液再次旋干,5mL乙腈定容、超声溶解,经0.45 μm的微孔滤膜过滤于进样瓶中,待测。各处理均6次重复。
2 结果与分析
2.1 提取、净化方法的选择
本次试验分别采用乙腈、甲醇作为提取剂,经基质分散萃取、涡旋、振荡、超声等方法提取。本试验样品中含有丰富的糖份,采用甲醇提取时过滤较慢,以致难以进行,而乙腈提取则无此现象且后续的测定结果良好,本试验结合杨梅安全指标中有敌敌畏、氯氰菊酯、多菌灵等农药且均以乙腈作为提取剂[13-14],最终确定以乙腈作为提取液,同时对4种提取方法进行筛选。实验表明4种提取方法的样品添加回收率均能达85%以上,其中基质分散萃取法速度快、易操作,振荡和超声提取法较耗时,涡旋时低速振荡不充分、高速手势难控制。在选择净化小柱时,本试验同时采用了氨基柱、弗罗里硅土柱和碱性氧化铝柱等3种净化柱,结果表明,3种柱子对杨梅样品均有一定的净化作用,但经弗罗里硅土柱或氧化铝柱净化后的样品测定液成分相对较复杂,样品谱图中氯吡脲的干扰峰较多,难彻底分离。采用氨基柱净化后的测定谱图显示氯吡脲峰形较好,干扰峰较少,回收率佳。综合以上试验结果确定以乙腈作为提取剂、基质分散萃取法作为提取方法,氨基小柱作为净化柱[9-10]。经试验表明,该提取方法是切实可行的。
2.2 流动相的选择
分析氯吡脲的分子式与分子量,选择了C18反相键合相色谱柱。据文献[9-10]报道氯吡脲测定可采用乙腈/水或甲醇/水作为流动相,本试验比较标样与样品在不同比例的乙腈/水或甲醇/水流动相中的出峰情况,以甲醇/水作为流动相时氯吡脲出峰相对较慢,峰宽较宽且在氯吡脲周围的干扰峰较多;而采用乙腈/水不仅可以明显缩短氯吡脲的出峰时间且干扰峰少、峰形好,可明显降低氯吡脲的检出限。如图1、2所示,分别以乙腈/水、甲醇/水为流动相,浓度为26.6 μg/mL的氯吡脲的出峰图谱。

图1 以乙腈/水为流动相的氯吡脲26.6 μg/mL色谱图Fig.1 Chromatogram of standard sample of 26.6 μg/mL forchlorfenuron by Acetonitrile/water as mobile phase

图2 以甲醇/水为流动相的氯吡脲26.6 μg/mL色谱图Fig.2 Chromatogram of standard sample of 26.6 μg/mL forchlorfenuron by methanol/water as mobile phase
2.3 定性分析
对氯吡脲的定性,本试验采用对照标样与样品组份的保留时间及样品中加入标样峰叠加来确定,表1是添加浓度为25 mg/kg的样品和浓度为26.6 μg/mL标准溶液中氯吡脲6次出峰时间对比,变异系数分别为 0.094、0.150,平均出峰时间为 4.983、4.991。利用流动相配制标准溶液分别为 0.125、0.25、5.0、25、50和100 μg/mL系列浓度的氯吡脲标准溶液,进样10μL,其色谱峰面积与浓度呈极显著线性相关,其线性方程与线性范围分别为:

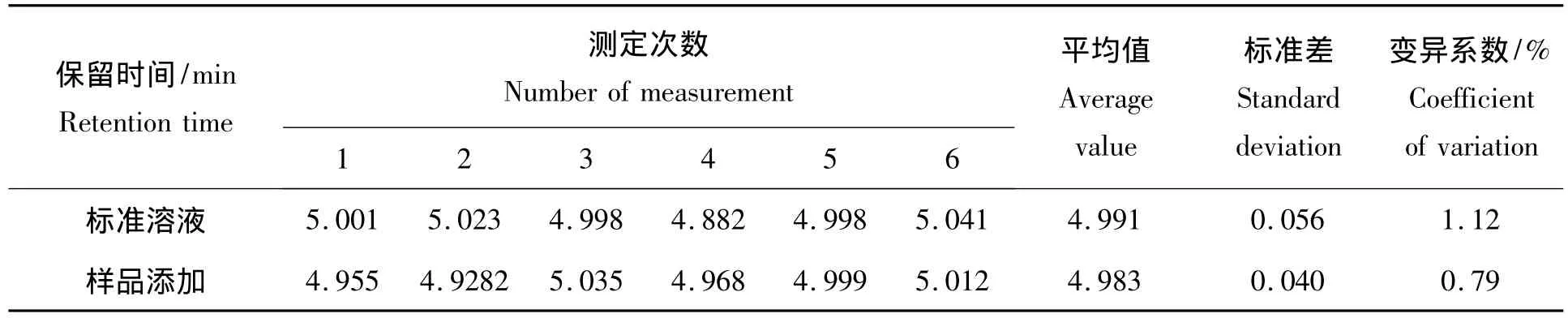
表1 标准溶液与样品添加保留时间的重现性Tab.1 Reproducibility of retention time of standard and sample
2.4 检测限的测定
3倍信噪比(S/N=3)时最低检出量为1.0×10-10g,按前述样品称量和定容条件,本方法样品中氯吡脲检测限为0.01 mg/kg。
2.5 加标回收及方法精密度
准确称取 25 g样品6×4份 ,加入氯吡脲标液,使其浓度分别为0.00、0.04、7.5、25 mg/kg的6 次重复,轻轻振摇,使其均匀分散开。按实验方法进行提取、净化、浓缩、定容、检测。空白样品、添加回收样品的色谱峰如图2、图3所示。杨梅空白样品中未检测到氯吡脲,添加样品回收率结果如表2所示。

表2 添加回收率及其相对标准偏差(n=6)Tab.2 Recoveries rate and relative standard deviations(n=6)
由表2可知,氯吡脲在样品不同浓度添加回收率在98.4% ~11%,相对标准偏差在0.97% ~2.6%,表明本方法的准确度和精密度均可满足痕量组分测定要求,可以对杨梅中氯吡脲含量进行测定。
3 讨论
杨梅果实中含有大量的水分,在选择提取剂时考虑到极性溶剂,它能与水互溶从而渗透到组织内部,改变溶液极性后又能与水分离。丙酮、甲醇是良好的提取剂,但不易与水分离;二氯甲烷、三氯甲烷对人体毒性较大,且对色素有较强的溶解性,故未选择。相比之下乙腈是较为理想的提取剂,它不但具备上述要求的溶剂性质,而且对试样中的糖、脂肪和蛋白质的溶解性较小,降低了基体中杂质的溶出;同时,它的低挥发性也减少了对人体健康和环境的危害。已有文献[6,15-17]报道,植物样品中氯吡脲可采用乙腈或甲醇作为提取剂。由于甲醇和乙腈二者极性差异明显,对不同的样品可选择采用,如一些含糖量较高或水溶性物质较多的样品宜采用乙腈,而脂溶性成分较多的样品宜采用甲醇。本实验所用的杨梅糖分含量较高,故采用的乙腈作为提取剂。氯吡脲测定可采用乙腈/水[16-17]或甲醇/水[6,15]作为流动相,本试验比较标样与样品在不同比例的乙腈/水或甲醇/水流动相中的出峰情况发现,以甲醇/水作为流动相时氯吡脲出峰相对较慢,且峰宽较宽且在氯吡脲周围的干扰峰较多;而采用乙腈/水不仅可以明显缩短氯吡脲的出峰时间且干扰峰少、峰形好,可明显降低氯吡脲的检出限,这与Antonio[8]在西红柿、南瓜、西瓜中的测定结果相似。在选择流动相流速时,0.5mL/min时峰分离明显优于1mL/min但出峰时间相对较长。在选择净化小柱时,本试验同时采用了弗罗里硅土柱和碱性氧化铝柱,三种柱子对杨梅样品均有一定的净化作用,但经弗罗里硅土柱或氧化铝柱净化后的样品测定液成分相对较复杂,样品谱图中氯吡脲的干扰峰较多,难彻底分离。采用氨基柱净化后的测定谱图显示氯吡脲峰形较好,干扰峰较少,与侯玉茹[18]在葡萄中的研究结果略有差异,这可能与杨梅样品水分含量较高,所含物质与各净化柱的亲和能力有关。本方法可结合杨梅中农药残留测定一起进行前处理[13],节省时间和有机试剂。

图3 杨梅添加0 mg/kg氯吡脲的色谱图Fig.3 Chromatogram of Myica rubra without forchlorfenuron as control
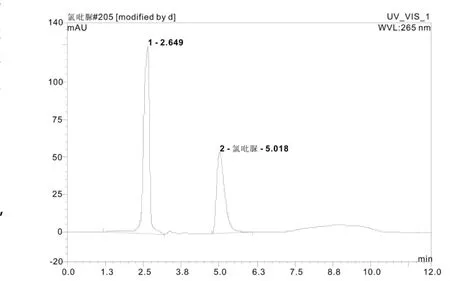
图4 杨梅添加7.5 mg/kg氯吡脲的色谱图Fig.4 Chromatogram of Myica rubra sample spiked with 7.5 mg/kg of forchlorfenuron
4 结论
通过对仪器条件和样品处理进行优化,建立基质分散萃取——反相高效液相色谱法测定杨梅中氯吡脲的方法,本方法测定氯吡脲线性范围广,样品中氯吡脲检测限可达0.01 mg/kg;不同浓度添加回收率在98.4% ~110%,相对标准偏差在0.97% ~2.6%;操作简便快捷、省时省力。
[1]Kassem H A,Al- Obeed R S,Ahmed M A.Extending harvest season,improving fruit quality and shelf life of‘Barhee’date palm by preharvest sprays[J].Acta Horticulturae,2010,882:147 -154.
[2]Ted E C,Bruce W W,Ni X Z.Application of plant growth regulators mitigates chlorotic foliar injury by the black pecan aphid(Hemiptera;Aphididae)[J].Pest Management Science,2010,66(11):1236 -1242.
[3]National registration authority for agricultural and veterinary chemicals.MRL Standard,maximum rcsidue limits in food and animal feedstufs[S].APVMA,Canberra,1996.
[4]NY 1500.75.3 -2009农药最大残留限量 氯吡脲[S].北京:中国标准出版社,2009.
[5]LIU Qiang,GONG Da-xin,PENG Xiao-chun,et al.Determination of forchlorfenuron dissipation and residue in cucumbers and red soil[J].Journal of Northeast Agricultural University(English Edition)2010,17(1):27-3.
[6]孙大利,郑尊涛,叶火春,等.氯吡脲在葡萄中的残留分析方法及消解动态[J].农药,2011,50(10):751-753.
[7]Maki K,Ichiro T,Yasuhiro T,et al.Clean-up method of forchlorfenuron in agricultural products for hplc analysi[J].Journal of Food Hygiene,2007,48(5):148 -152.
[8]Antonio V,Ana A,Carmen F.Analysis of forchlorfenuron in vegetables by LC/TOF-MS after extraction with the bufered QuEChERS method[J].Journal of Agricultural and Food Chemistry,2010,58(5):2818 -2823.
[9]Patil S B,Jadhav M R,Adsule,et al.Multiresidue analysis of multiclass plant growth regulators in grapes by liquid chromatography/tandem mass spectrometry[J].Journal of AOAC International,2011,943:1060 -3271.
[10]Valverde A,Piedra L,Aguilera A,et al.Analysis and residue levels of forchlorfenuron(CPPU)in watermelons[J].Journal of Environmental Science and Health.Part B,Pesticides,Food Contaminants and Agricultural Wastes,2007,42(7):801 -807.
[11]张洁,郭金星,张汝忠,等.东魁杨梅果实储藏期挥发性有机化合物成分的变化[J].浙江农林大学学报,2012,29:(1);143-150.
[12]颜晓捷,黄坚钦,邱智敏,等.生草栽培对杨梅果园土壤理化性质和果实品质的影响[J].浙江农林大学学报,2011,28:(6);850-854.
[13]NY/T 761-2008蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定[S].北京:中国农业出版社,2008.
[14]GB/T 23380-2009水果、蔬菜中多菌灵残留的测定:高效液相色谱法[S].北京:中国标准出版社,2009.
[15]齐明芳.3种常用坐果激素主要成分在番茄中的残留[J].农药,2010,49(7):512-514.
[16]郑玲,李丽华,黄大新,等.液相色谱-串联质谱法对水果中氯吡脲残留的测定[J].食品工业,2011(7):90-92.
[17]李瑞娟,于建垒,宋国春,等.氯吡脲在猕猴桃和土中的消解动态与残留测定[J].山东农业科学,2009(2):78-80,83.
[18]侯玉茹,杨媛,石磊,等.固相萃取:高效液相色谱法检测葡萄中氯吡脲的研究[J].食品科技,2011,36(1):255-258.

