柑橘可培养内生细菌与寄主品种抗溃疡病相关性的初步研究
刘 冰,李冬植,胡长志,查顺清
(江西农业大学 农学院,江西 南昌 330045)
植物内生菌是指在其生活史中的某一段时期生活在健康植物组织内部,不引起植物组织明显症状的一类菌,包括真菌、细菌、放线菌[1-2]。植物内生菌长期生活于植物体内,与宿主互相适应,形成了一系列有益于宿主植物的生物学机能[3]。其中某些内生菌可以抵抗病虫害的作用已经成为共识[4],但植物内生菌的存在对其寄主品种抗性是否有影响的直接研究却比较少。
被称为“柑橘癌症”的溃疡病是柑橘上的一种重要病害,其对柑橘品种的选择性非常强[5]。目前认为,这种选择性与柑橘表皮组织结构[6]、生理组分及含量[7]、氧化酶类[8]、植保素[9]及抗性基因[10]等关系密切。柑橘体内的内生菌是否与寄主品种抗病性之间有一定的关系呢?本试验以温州蜜柑(抗溃疡病品种)和赣南纽荷尔脐橙(感溃疡病品种)为材料,从中分离纯化出内生细菌并测定其抑菌防病活性,初步分析这些菌株与寄主品种抗溃疡病之间的关系。
1 材料与方法
1.1 样品与菌种
温州蜜柑的夏梢嫩叶和幼果采于江西农业大学生态园,赣南纽荷尔脐橙的夏梢嫩叶和幼果在赣南脐橙园中多点取样获得,柑橘溃疡病菌由江西农业大学植病实验室分离保存。
1.2 试验方法
1.2.1 内生细菌的分离 分别称取温州蜜柑和赣南纽荷尔脐橙的嫩叶和幼果用体积分数70%乙醇和1 g/L升汞进行表面消毒。为判断表面消毒是否完全,把最后一次漂洗灭菌材料的漂洗液吸取100μL涂布于NA培养基上,每个处理重复2次,培养48 h后观察有无菌落产生,若无则表明表面消毒完全。将表面消毒好的材料用无菌剪刀分别剪取适量于研钵中备用,剩余材料再次称量,计算所用材料重量。
采用稀释法分离内生细菌。每个研钵中加入5mL无菌水分别研磨至汁液,静置15min,移取1mL于离心杯中作为原液,进而稀释到10-1、10-2、10-3等不同浓度。共有温州蜜柑叶、果,赣南脐橙叶、果四组研磨液。每组研磨液每个稀释度均分别取100μL于NA培养基上涂布均匀,重复3次。将培养皿放于25℃恒温培养箱中培养,每天观察培养基上菌落生长情况,及时进行菌株纯化,记录各菌落的形态特征,进一步将菌种接种于试管进行斜面培养保存[11]。
1.2.2 内生细菌对柑橘溃疡病菌的抑制效果测定 对实验室保存的柑橘溃疡病菌活化后进行抑菌效果测定,采用抑菌圈法。用移液器吸取100μL溃疡病菌菌液于培养基上,用涂抹棒涂抹均匀,然后用打孔器(d=0.8 cm)于培养基中打4个对称的孔,将纯化后的内生菌接种于孔壁周围(对照接种无菌水),于30℃恒温箱中培养,每处理3个重复。以后每隔12 h观察1次,记录抑菌圈直径并拍照[11]。
1.2.3 内生细菌对赣南纽荷尔脐橙溃疡病离体叶片的防治效果测定 采用针刺法接种。取纽荷尔脐橙的新鲜叶片(颜色刚转绿),分别在叶脉的两侧用昆虫针刺孔。每叶刺18个孔,每3个孔为一组,共6组。用灭菌滤纸圆片(直径5mm)吸足供接种的溃疡病菌菌悬液,贴在3个针刺点上,每叶6个滤纸片。将待测内生细菌的菌悬液均匀喷于已接种病菌的叶片上,对照喷清水。处理后的叶片放置在倒有水琼脂的培养皿内,每皿内放置1叶,在27℃培养,每个处理3片叶片。24 h后除去滤纸片,3 d后开始观察叶片发病情况,7 d后进行记录和拍照,统计发病情况[12-13]。
2 结果与分析
2.1 内生细菌的分离
试验分离出的菌株根据分离植物器官和菌落特征进行初步分类。结果表明,从温州蜜柑上分离到的内生细菌菌落数为7.12×104cfu/g鲜组织,菌株共有10种(叶片上6种、果实上4种),其中的优势菌株为WZ132和WZ131(图1,表1);从赣南纽荷尔脐橙上分离到的内生细菌菌落数为1.27×104cfu/g鲜组织,菌株共有18种(叶片上11种、果实上7种),其中菌落数最多的菌株为GN231,其次为GN211和GN213,另外叶片中分离的菌株GN223、GN213分别与果实中分离到的菌株GN232、GN242菌落特征相似(图2,表2)。由此可见,温州蜜柑中可培养内生细菌的种类较赣南纽荷尔脐橙中的少、数量较脐橙中的多。
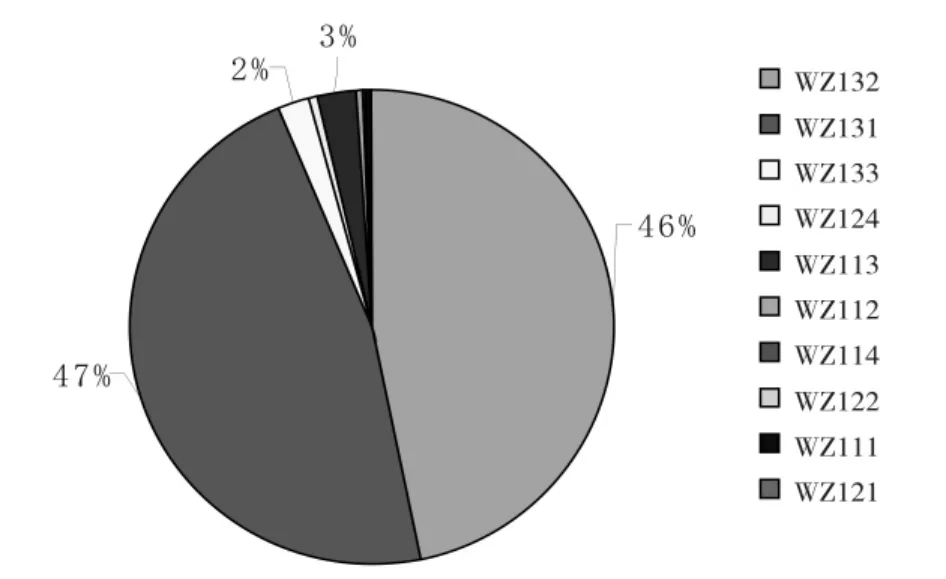
图1 温州蜜柑中主要可培养内生细菌种类及数量Fig.1 Variety and quantity of the major endophytic bacteriacultured from citrus unshiu Marc
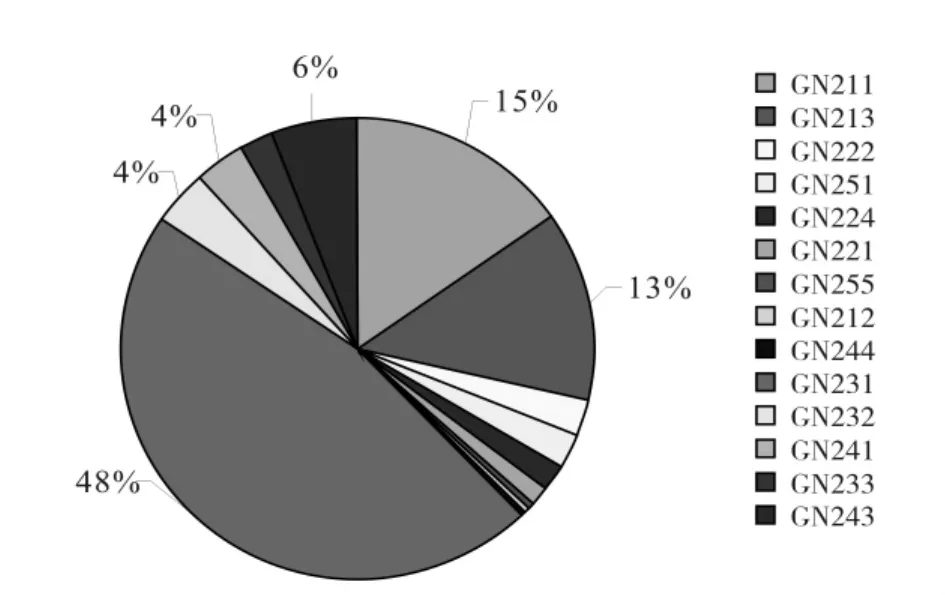
图2 赣南脐橙(纽荷尔)中主要可培养内生细菌种类及数量Fig.2 Variety and quantity of the major endophytic bacteria cultured from citrus sinensis Osbeck
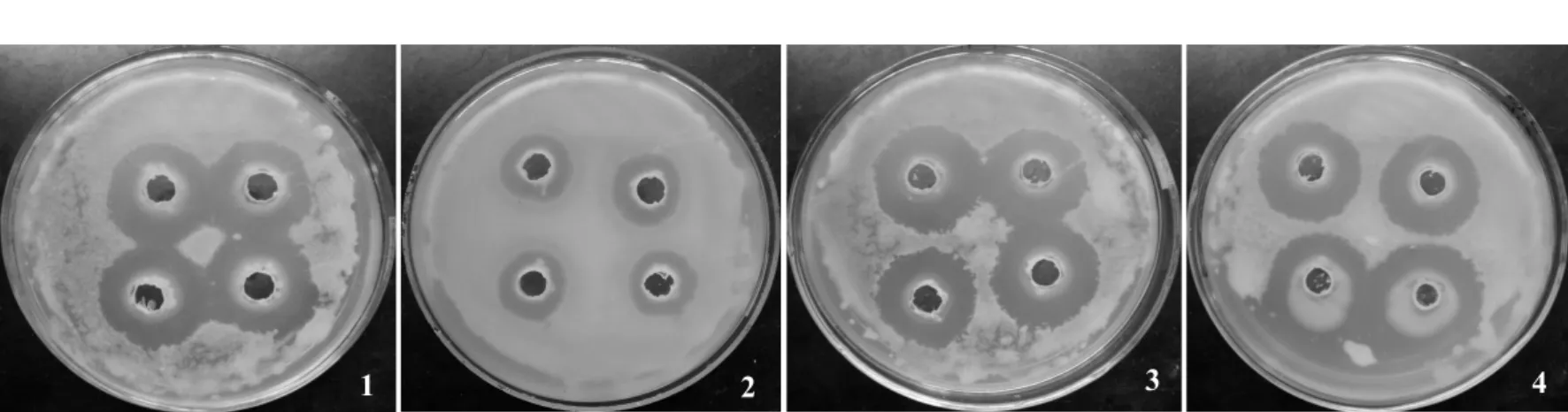
图3 拮抗内生细菌抑菌效果Fig.3 The antibacterial effect of endophytic bacteria from orange
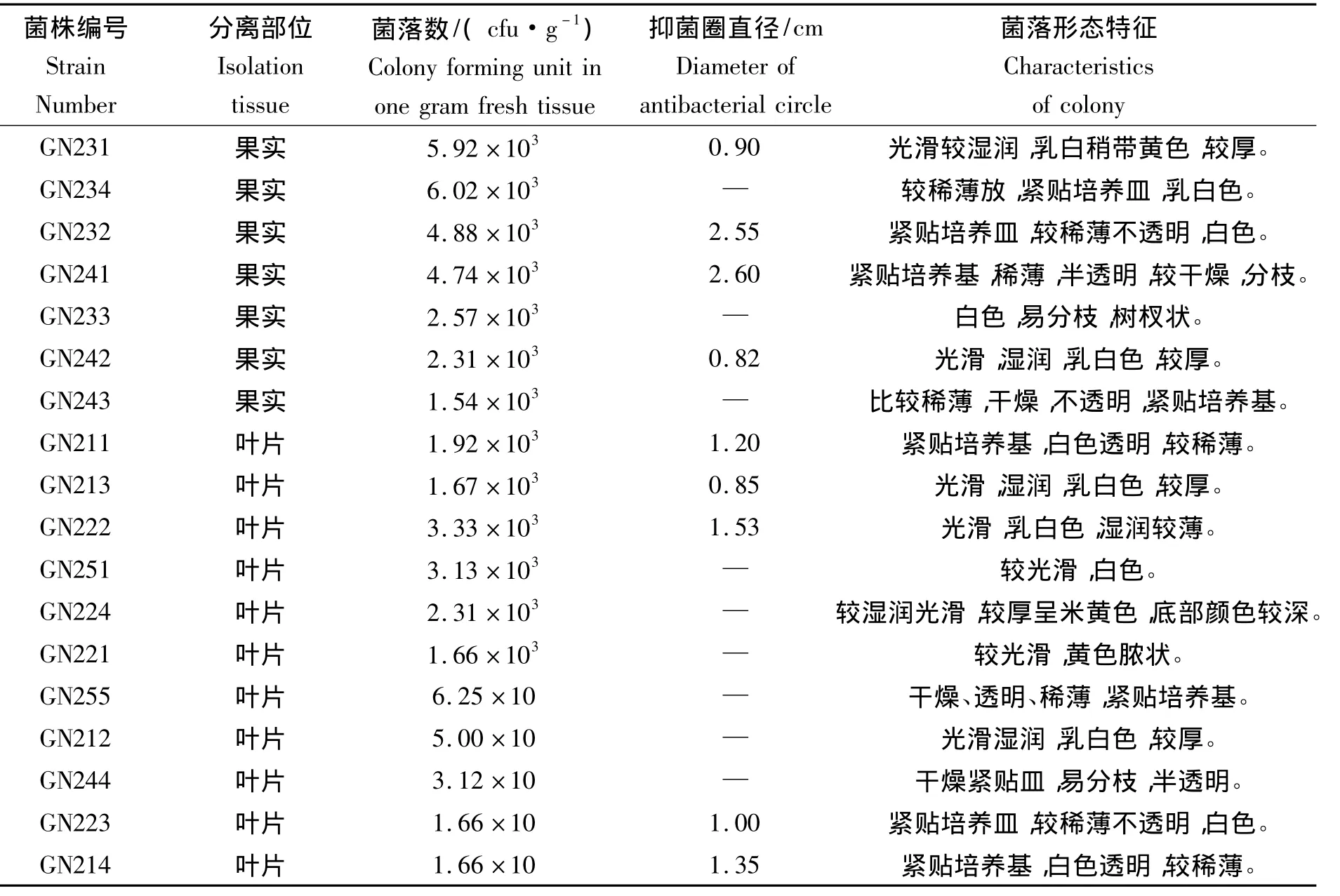
表2 赣南脐橙内生细菌对溃疡病菌的抑菌效果Tab.2 The inhibiting effect of endophytic bacteria from Citrus sinensis Osbeck in Jiangxi Gannan to Xanthomonas axonopodis pv.citri
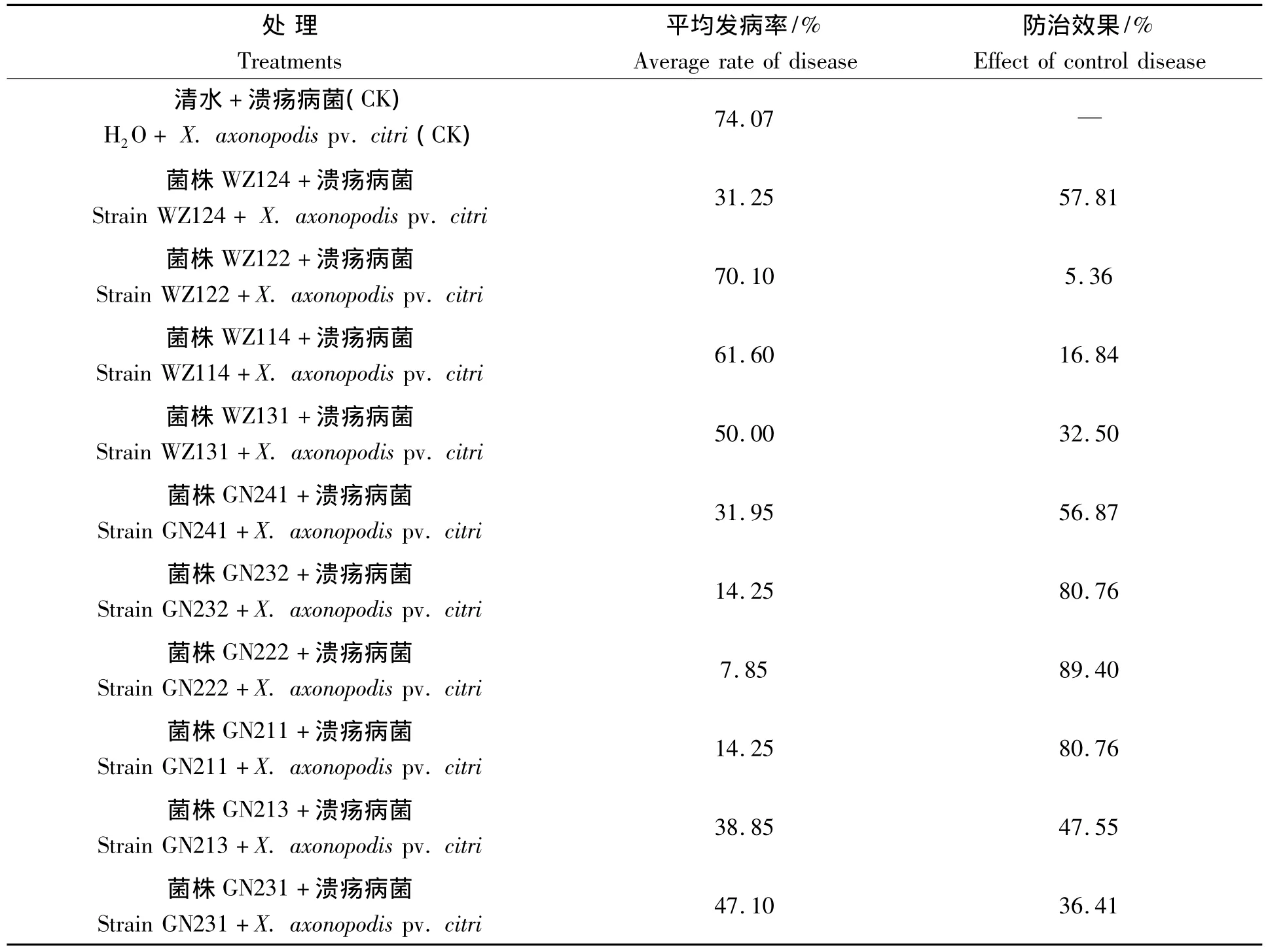
表3 拮抗内生细菌对赣南纽荷尔脐橙溃疡病的离体防治效果Tab.3 The control effect of antibacterial endophytic bacteria on citrus canker of Navel Orange in Jiangxi Gannan in vitro
2.2 内生细菌对柑橘溃疡病菌的抑菌效果
经计算可得,温州蜜柑中获得的有抑菌效果的内生细菌菌落数为8.47×103cfu/g鲜组织,其对溃疡病菌的抑菌圈平均直径为1.93 cm;其中优势菌株WZ131抑菌效果最好,抑菌圈直径为2.50 cm。其次为菌株WZ 122和WZ114(表1,图3)。赣南纽荷尔脐橙中有抑菌效果的内生细菌菌落数为1.23×103cfu/g鲜组织,其对溃疡病菌的抑菌圈平均直径为1.42 cm,效果比较好的有菌株 GN241、GN232、GN222和GN214等;其中抑菌最优的菌株GN241的抑菌圈直径可达2.60 cm,但其数量仅占菌落总数的4%,抑菌效果居于其后的GN232和GN222所占菌落总数的比例也很小(表2,图2,图3)。由此可见,温州蜜柑中拮抗内生细菌的数量比赣南脐橙中的多,而且整体抑菌能力更强。
2.3 内生细菌对赣南纽荷尔脐橙溃疡病离体叶片防治效果
从表3可以看出,分离自温州蜜柑的拮抗菌株对脐橙溃疡病的防治效果较差,菌株WZ124防效最好,为57.81%;脐橙叶片接种溃疡病菌和菌株GN222后发病很轻,在对照叶片发病已经腐烂后,处理仍然可以保持20多天不腐烂。此外,分离自赣南纽荷尔脐橙的拮抗菌株对脐橙溃疡病的整体防治效果较好,这可能是因为这些菌株分离自脐橙组织,因此可以更好地定殖在接种叶片体内。
3 讨论
目前,国内外对植物内生菌与寄主抗病性之间关系的研究较少,已有研究也主要是集中在内生菌种群数量与寄主品种抗病性的关系上,如在马铃薯与软腐病[14]、烟草与青枯病[15]、玉米与纹枯病[16]、桉树与青枯病[17]等关系中的内生菌研究。尽管如此,这些研究结果还是指出了植物内生菌与其寄主品种抗病之间可能存在着广泛的协同作用。笔者研究发现,柑橘溃疡病抗病品种中的细菌拮抗能力要远强于感病品种的;虽然感病品种中也有很多拮抗细菌,但是其数量太少且拮抗能力弱,不能影响到寄主品种的感病性。这初步阐明了柑橘内生细菌的特性与寄主品种抗溃疡病之间的协同关系。
长期以来,防治柑橘溃疡病主要依靠加强栽培管理、频繁使用化学农药等措施,尽管取得一定效果,但费时费力、易产生抗药性且不符合人们对绿色食品需求的趋势[18-19]。因此,寻求安全有效的防治方法对柑橘产业的可持续发展意义深远。生物防治是一种对环境友好的防治措施,目前在生产中已经有比较广泛的应用,但是在柑橘溃疡病的防治方面却仍处于摸索阶段。本研究从赣南纽荷尔脐橙中分离到的几株内生细菌对溃疡病的防治效果良好,尤其是菌株GN222的防效达到89.4%,可作为赣南脐橙溃疡病的一种优良生物防治资源。
接种试验表明,从赣南纽荷尔脐橙中分离到的内生拮抗细菌虽然拮抗能力不强,但是其对纽荷尔脐橙溃疡病的防效却较好,这可能是因为这些菌株来自于脐橙体内,能更好地适应寄主体内的环境,这也进一步表现了这些内生细菌作为脐橙溃疡病生物防治资源的优势。
本试验中,用于分离内生细菌的材料——感溃疡病品种温州蜜柑和抗病品种赣南纽荷尔脐橙的组织采自于不同地区,这可能对内生细菌种群会有一些影响,因此推测试验结论的精确性或有微小的误差,在今后的工作中对这个问题需要进行阐释。此外,本试验还只是初步探索,对于柑橘内生细菌与寄主品种抗病性之间的协同关系还需要更有力的证据和更深入的研究,比如柑橘体内难培养细菌的种类、数量和特性以及协同机理等,笔者将继续开展这方面的工作。
[1]马旭闽,萍茹.植物内生真菌一类生物活性物质的新的资源微生物[J].海峡药学,2004,16(4):11.
[2]官珊,钟国华,孙之潭,等.植物内生真菌的研究进展[J].仲恺农业技术学院学报,2005,18(1):61.
[3]Backman P A,Sikora R A.Endophytes:an emerging tool for biological control[J].Biological Control,2008,46(1):1 -3.
[4]韩继刚,宋未.植物内生细菌研究进展及其应用潜力[J].自然科学进展,2004,14(4):374-379.
[5]Das A K.Citrus canker- A review[J].Journal of Applied Horticulture,2003,5(1):52 -60.
[6]温寿星,黄镜浩,陈瑾,等.叶片结构与柑橘溃疡病抗性的初步研究[J].中国农学通报,2009,25(13):66-69.
[7]Gogo M,Takemura I,Yamanaka K.Leakage of electrolytes and amino acids from susceptible and resistant citrus leaf tissues infected by Xanthomonas citri[J].Annual Phytopathology Society of Japan,1979,95:625.
[8]王引.柑橘溃疡病不同抗性类型生理差异比较及SA诱导的抗性研究[D].武汉:华中农业大学,2010.
[9]胡洪涛,李翔.植保素对柑桔溃疡病抗性的研究[J].湖北农业科学,2004(6):51-52.
[10]Shiotani H,Yoshioka T,Yamamoto M,et al.Susceptibility to citrus canker caused by Xanthomonas axonopodis pv.citri depends on the nuclear genome of the host plant[J].Journal of General Plant Pathology,2008,74:133 -137.
[11]刘冰,黎园,丁莎,等.柑橘病害生防放线菌的分离筛选及抑菌作用研究[J].江西农业大学学报,2011,33(5):889-892.
[12]Francis M I,Redondo A,Burns J K,et al.Soil application of imidacloprid and related SAR-inducing compounds produces effective and persistent control of citrus canker[J].European Journal of Plant Pathology,2009,124:283 -292.
[13]罗赛男,邓子牛,钟晓红,等.TERF1基因增强糖橙抗病性的初步研究[J].中南林业科技大学学报,2008,28(5):71-76.
[14]Sturz A V,Matheson B G.Populations of endophytic bacteria which influence host-resistance to Erwinia- induced bacterial soft rot in potato tubers[J].Plant and Soil,1996,184(2):265 -271.
[15]黄晓辉,杨友才,谭周进,等.四个品种烟草内生微生物的分布特征[J].生态学报,2009(12):6827-6833.
[16]付东强,高增贵.根系内生细菌与玉米抗纹枯病关系研究[J].杂粮作物,2008,28(4):274-276.
[17]冉红妙.桉树内生细菌种群变化与抗青枯病的关系研究[D].保定:河北农业大学,2010.
[18]Zhang X D,Francis M I,Dawson W O,et al.Over- expression of the Arabidopsis NPR1 gene in citrus increases resistance to citrus canker[J].European Journal of Plant Pathology,2010,128:91 -100.
[19]陈力,王中康,黄冠军,等.柑橘溃疡病生防菌株CQBS03的鉴定及其培养特性研究[J].中国农业科学,2008,41(8):2537-2545.

