黑水虻抗菌肽诱导条件优化及粗提物活性研究
夏 嫱,赵启凤,廖 业,朱 伟,喻国辉,陈远凤,宋明英
(1.遵义医学院珠海校区/贵州省免疫学研究生教育创新基地,珠海 519041;2.珠海市农业科学研究中心,珠海 519075)
昆虫抗菌肽因具有分子量小、热稳定性好、水溶性强、无免疫原性、抗菌谱广、不易产生耐药性及毒副作用小,对寄主细胞无不良影响等优点 (Boman and Hultmark,1987),成为当今牧畜业及医学研究领域的热点 (国果等,2012;雷岷等,2012;金小宝等,2012)。
黑水虻Hermetia illucens L.是一种全世界广泛分布的重要资源昆虫 (喻国辉等,2009)。其幼虫生活环境与家蝇相似,以动物粪便、腐烂的有机物及植物性垃圾为食。研究表明,黑水虻幼虫取食粪便后不仅可以减少粪便臭气,还可使鸡粪中大肠杆菌和沙门氏菌的量显著降低 (Erickson et al.,2004),有效控制奶牛粪便中大肠杆菌ER2566的生长 (Myers et al.,2008)。另外,黑水虻幼虫还能在体内消化多种病原微生物,如霍乱、疟疾病原物等。黑水虻幼虫对鸡粪中家蝇Musa domestica控制率达到100%,对小家蝇 Fannia canicularis的控制率达到99.9% (Tomberlin and Sheppard,2002)。因而,我们初步推断黑水虻幼虫体内可能有比家蝇、黄粉虫等昆虫更强大的免疫系统才有如此功能。另外,与家蝇等昆虫相比黑水虻有诸多优点适于抗菌肽的研究,如黑水虻成虫不取食,交配产卵后即死亡 (王付彬等,2010)对环境无污染、不传播疾病;化蛹前有迁移特性 (安新城等,2010)可主动移出所饲养环境;各个发育阶段虫体均较大,有利于抗菌肽的大量提取。所以,黑水虻是研究抗菌肽的优良材料,是药物研发的良好素材,但目前国内外未见其抗菌肽方面的研究。
本文采用菌液注射诱导法、菌液针刺浸泡诱导法、超声波诱导法以不同诱导时间及诱导剂量诱导黑水虻幼虫产生抗菌肽,优化黑水虻幼虫抗菌肽诱导的最佳条件,探讨黑水虻抗菌肽提取的最佳方法,为黑水虻抗菌肽的进一步分离纯化及活性研究提供实验基础。
1 材料与方法
1.1 供试昆虫
利用珠海市本地黑水虻资源建立种群,在珠海市农业科学研究中心利用Tomberlin等筛选的紫花苜蓿人工饲料饲养。
1.2 供试用菌种及培养基
菌种:大肠杆菌ATCC8739、金黄色葡萄球菌ATCC6538,购自广东省微生物菌种保藏中心。
LB固体培养基:蛋白胨10 g,牛肉膏3 g,氯化钠10 g,琼脂15 g,PH=7.4,以蒸馏水定容至1000 mL,121℃灭菌20 min。
1.3 试剂
硫酸庆大霉素注射液 (80U/2mL)购自广州白云山天心制药股份有限公司;灭菌注射用水购自天津药业焦作有限公司。
1.4 诱导条件优化
1.4.1 诱导龄期优化
取2龄、3龄、4龄、5龄、6龄黑水虻幼虫各200头,用大肠杆菌菌液 (3×1012个/mL)分别对其进行针刺浸泡诱导,常规饲养24 h。提取各龄期幼虫抗菌肽,以大肠杆菌为指示菌测其抑菌活性。每个处理3个重复,以庆大霉素为阳性对照。
1.4.2 诱导条件优化
菌液注射诱导:设大肠杆菌、金黄色葡萄球菌2 个菌液注射组,每组设立 5 μL、10 μL、15 μL、20 μL 4个诱导剂量组;菌液针刺浸泡诱导:设大肠杆菌及金黄色葡萄球菌2个菌液针刺组,每组设立30 s、40 s、50 s、60 s、70 s、90 s 6个浸泡诱导时间组;超声波诱导:设40 W、100 W 2个功率诱导组,每组设立5 min、10 min、15 min、20 min、30 min 5个诱导时间组。
每个处理均选取长势均一黑水虻5龄幼虫200头,对其进行诱导,诱导后的幼虫常规饲养12 h、24 h、48 h、72 h。每个处理3个重复。以未诱导的黑水虻5龄幼虫为阴性对照,以庆大霉素为阳性对照。
1.5 抗菌肽粗提物提取
取不同诱导处理的黑水虻幼虫分别称重、沸水处死、剪碎。用组织研磨器在冰浴中捣碎、匀浆,将提取液与浆液以3∶1混合。将混合物4℃12000 r/min离心2次,每次30 min,取其上清冷冻干燥,配制2 μg/μL粗提物溶液待用。
1.6 抗菌肽粗提物活性测定
滴加20 μL培养24 h大肠杆菌菌液于LB平板,并将其均匀涂布,用灭菌打孔器以等边三角形打3孔,孔径均为6 mm。向孔中分别加入不同诱导幼虫抗菌肽溶液、未诱导幼虫抗菌肽溶液及庆大霉素溶液各30 μL,待溶液被培养基完全吸收后,将其放入37℃恒温培养箱倒置培养24 h,测量抑菌圈直径。每个处理3个重复。
1.7 数据处理及分析
利用 Excel2007、SPSS17.0进行数据分析处理;利用SPSS中One-Way ANOVA进行方差分析及多重比较。以平均数±标准差进行表示。
2 结果与分析
2.1 最佳诱导龄期测定
经方差分析及多重比较可知,黑水虻幼虫诱导后产生抗菌肽活性随龄期增加而增加,至5龄幼虫达到最佳抑菌活性,与其他龄期幼虫产生抗菌肽活性相比差异显著 (表1),发育至6龄时抗菌肽抑菌活性开始降低,但仍显著高于2龄及3龄幼虫所产生抗菌肽活性。
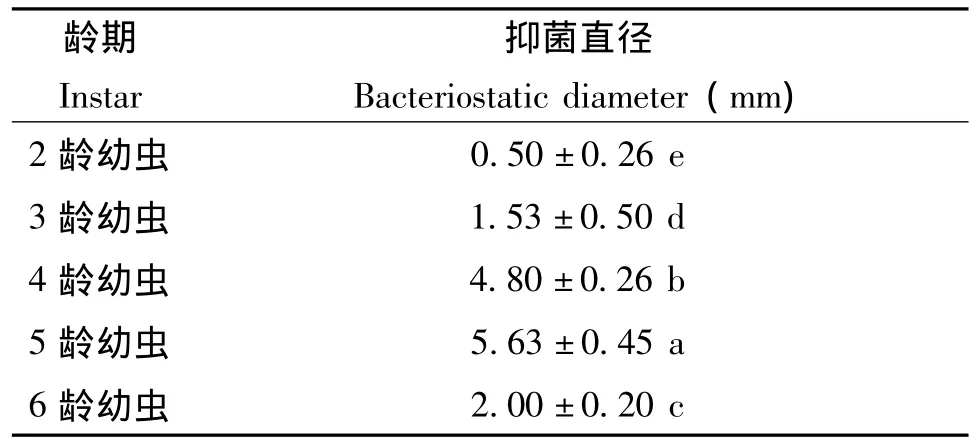
表1 不同龄期黑水虻幼虫所产生抗菌肽对大肠杆菌活性Table 1 Antimicrobial peptides antibacterial activity against E.coli in different instars
2.2 诱导条件优化及抑菌活性测定
2.2.1 菌液注射诱导产生抗菌肽粗提物抑菌活性
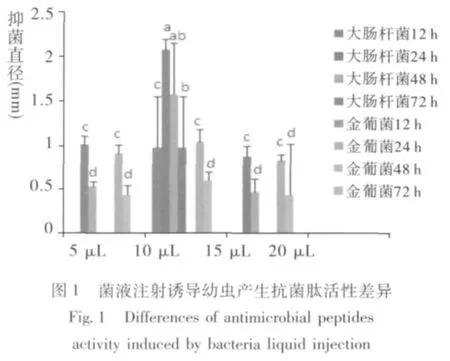
由图1、图2可知,注射10 μL大肠杆菌菌液饲养24 h后产生抗菌肽对大肠杆菌抑菌活性最强,与其他注射组相比有显著差异 (F:69.000,P<0.01),且随着饲养时间延长及诱导剂量增加抑菌效果呈下降趋势;金黄色葡萄球菌诱导剂量≤15 μL所产生抗菌肽对大肠杆菌有一定的抑菌活性,但各剂量组间无显著差异,但随饲养时间延长有活性降低趋势。诱导剂量增至20 μL时,大肠杆菌及金黄色葡萄球菌诱导产生的抗菌肽在各饲养时段对大肠杆菌均无抑菌活性。
2.2.2 菌液针刺浸泡诱导产生抗菌肽粗提物抑菌活性
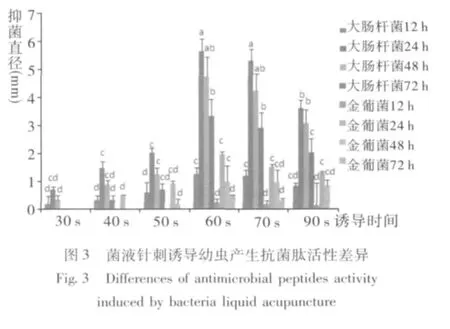
黑水虻5龄幼虫浸泡于不同菌液产生抗菌肽活性不同;不同浸泡时间,产生抗菌肽抑菌效果亦存在差异。由图3、图4可知,大肠杆菌菌液针刺浸泡60 s产生抗菌肽抑菌活性最高,与浸泡30 s、40 s、50 s、90 s及金黄色葡萄球菌所有处理组产生抗菌肽活性相比差异显著 (F:118.4,P<0.01);且饲养至24 h所提取的抗菌肽抑菌活性最佳。
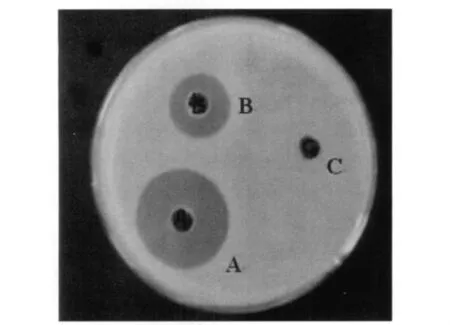
图4 大肠杆菌针刺浸泡诱导60 s饲养24 h抗菌肽活性Fig.4 Antimicrobial peptides activity induced by E.coliliquid acupuncture for 60 s,24 h later
2.2.3 超声波诱导黑水虻幼虫产生抗菌肽活性
不同功率、不同诱导时间、不同饲养时间黑水虻幼虫所产生抗菌肽抑菌效果存在明显差异(图5、图6)。100 W 超声波诱导黑水虻幼虫20 min,饲养24 h时产生抗菌肽抑菌活性最高与其他处理组及40 w超声波诱导组相比差异显著(F:480.033,P<0.01),但幼虫死亡率有所上升。
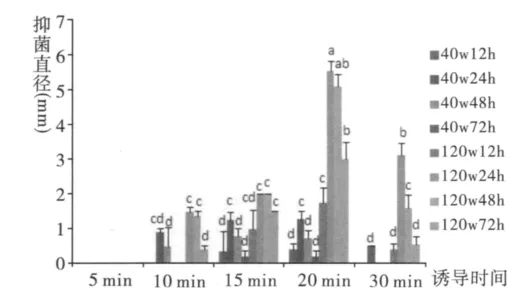
图5 超声波诱导幼虫产生抗菌肽活性差异Fig.5 Differences of antimicrobial peptides activity induced by ultrasonic
2.2.4 最佳方法筛选
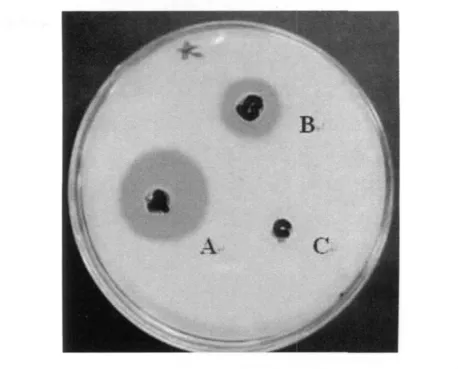
图6 100 W超声波诱导20 min饲养24 h幼虫抗菌肽活性Fig.6 Antimicrobial peptides activity induced by 100 W ultrasonic,24 h later
由表2可知,与其他处理组相比,大肠杆菌菌液针刺幼虫后浸泡60 s产生抗菌肽抑菌活性与100 W超声波诱导20 min所产生抗菌肽抑菌活性最好,经方差分析及多重比较二者间无显著性差异。但100 W超声波诱导处理黑水虻幼虫有死亡现象,因此,大肠杆菌菌液针刺浸泡60 s方法为黑水虻抗菌肽诱导最佳方法。
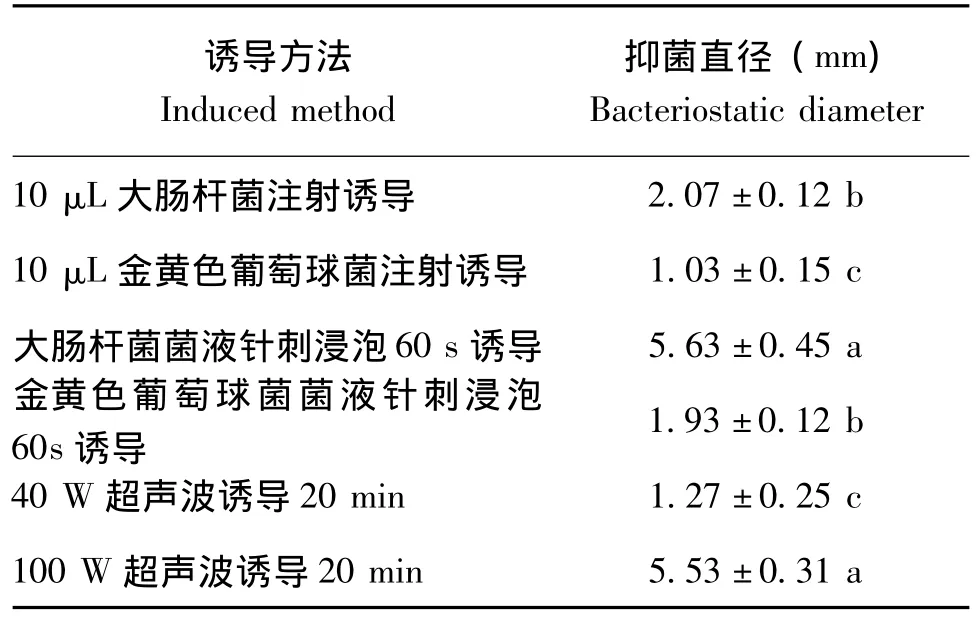
表2 不同诱导方法诱导黑水虻5龄幼虫产生抗菌肽活性比较Table 2 Differences of 5thinstar black soldier fly larvae antimicrobial peptides activity induced by different methods
3 结论与讨论
不同菌液诱导黑水虻后所产生抗菌肽对大肠杆菌抑菌活性不同,相同菌液不同诱导方法,不同诱导浓度,不同诱导时间所产生抗菌肽抑菌活性亦不同,诱导后幼虫饲养时间不同所产生抗菌肽活性也不同。本文中大肠杆菌菌液针刺浸泡诱导60 s及100 W超声波处理20 min,常规饲养24 h所产生抗菌肽抑菌活性最强。相同诱导方法及诱导条件下,大肠杆菌菌液诱导黑水虻幼虫产生抗菌肽抑菌效果均优于金黄色葡萄球菌菌液诱导产生抗菌肽抑菌效果。这可能是不同诱导源诱导昆虫所产生的免疫物质存在活性差异 (XE Xiansheng et al.,2010)。黑水虻抗菌肽的这一特点与已知昆虫抗菌肽中富含脯氨酸和富含甘氨酸昆虫抗菌肽有相似之处 (高琳琳和李卫东,2010),具体属于哪类抗菌肽还需进一步研究。
不同诱导方法均可使黑水虻幼虫产生一定的抗菌肽,可见其免疫应答为非专一性的,外界的各种病原体、异物、损伤等均可使其产生免疫应答,而不存在某一特定的抗原物质。
不同种类昆虫对不同诱导源有不同的免疫应答。本文中黑水虻抗菌肽的最佳诱导方法是大肠杆菌菌液针刺浸泡60 s,最佳饲养时间为24 h;黄粉虫抗菌肽的最佳诱导方法是大肠杆菌菌液注射诱导,最佳饲养时间是48 h(陶淑霞等,2010);斜纹夜蛾抗菌肽的最佳诱导源是大肠杆菌菌液注射诱导,最佳饲养时间是20 h(陈莫林,2006);家蚕抗菌肽的最佳诱导方法是饥饿法 (范涛等,2009)。
References)
An XC,Li J,Lv X,2010.Studies on antibacterial peptides induced from Silkworm and their bacteriostasis.Chinese Agricultural Science Bulletin.,33(3):113-116.[安新城,李军,吕欣,2010.黑水虻处理养殖废物的研究现状.环境科学与技术,33(3):113 -116]
Boman DG,Hultmark D,1987.Cell- free immunity insects.Annu.Rev.Microbiol.,41:103.
Chen ML,2006.The effect of different inducers on activity of polyphenol oxidase and antimicrobial peptide of Spodoptera litura and purified the antimicrobial peptide.Master degree paper.Guangzhou:Sun yat-sen University.[陈莫林,2006.不同诱导源对斜纹夜蛾多酚氧化酶、抗菌肽活性的影响及抗菌肽的分离纯化.硕士学位论文.广州:中山大学]
Erickson MC,Islam M,Sheppard C,2004.Reduction of Escherichia coli O157:H7 and Salmonella enterica serovar Enteritidis in chicken manure by larvae of the black soldier fly.J.Food Prot.,67(4):685-690.
Fan T,Dai JJ,Zhou YF,Wei GQ,Fan HW,Xiao LZ,Wu CH,Wang CY,Tian SF,2009.Studies on antibacterial peptides induced from Silkworm and their bacteriostasis.Chinese Agricultural Science Bulletin,25(21):30-32.[范涛,代君君,周业奉,魏国清,范后文,肖林珍,吴传华,王储炎,田善富,2009.家蚕抗菌肽的诱导及其抑菌作用研究.中国农学通报,25(21):30 -32]
Gao LL,Li WD,2010.Advances in research on the use of antibacterial peptides.Journal of Pathogen Biology,5(9):710-713.[高琳琳,李卫东,2010.昆虫抗菌肽及其应用研究进展.中国病原生物学杂志,5(9):710-713]
Guo G,Wu JW,Fu P,Zhang Y,2012.Effects of secreting type antibacterial peptides from musca domestica larvae on immune function in mice.Chin.J.Public Health,28(5):619 -620.[国果,吴建伟,付萍,张勇,2012.家蝇幼虫分泌型抗菌肽对小鼠免疫功能影响.中国公共卫生,28(5):619-620]
Jin XB,Gong SM,Pu QH,Zhu JY,Chu FJ,Mei HF,2012.Effect of antimicrobial peptide cecropin of Musca domestica on proliferation and apoptosis of human tumor cell.China Tropical Medicine,12(3):293-295.[金小宝,龚水明,蒲俏虹,朱家勇,褚夫江,梅寒芳,2012.家蝇抗菌肽Cecropin对人源性肿瘤细胞增殖与凋亡的影响.中国热带医学,12(3):293-295]
Lei M,Guo ZQ,Ren YJ,Li CY,Kuang LD,Zheng J,Yang C,Xie XH, Yang FZ, 2012. Cecropin antibacterial peptide of antibacterial peptides feeding meat rabbits growth performance and the immune organ index.China Feed,(9):25-27.[雷岷,郭志强,任永军,李丛艳,邝良德,郑洁,杨超,谢晓红,杨奉珠,2012.天蚕素抗菌肽对肉兔生产性能和免疫器官指数的影响.中国饲料,(9):25-27]
Myers HM,Tomberlin JK,Lambert BD,2008.DeveloPment of black Soldier fly(Diptera:Stratiomyidae)Larvae fed dairy manure.Environmental Entomology,37:11-15.
Tao SX,Han JF,Li Y,2010.Effect of induction sources and dosage on antibacterial activity of larvae haemolymph of tenebrio molitor.Journal of Jilin Agricultural University,32(2):145-148,153.[陶淑霞,韩静菲,李玉,2010.诱导源及其诱导剂量对黄粉虫幼虫血淋巴抗菌活性的影响.吉林农业大学学报,32(2):145 -148,153]
Tomberlin JK,Sheppard CD,2002.Factors influencing mating and oviposition of black soldier flies(Diptera:Strationmyidae)in a colony.Journal of Entomology Science,37(4):345 -352.
Wang FB,Liu YS,Zhang XB,2010.Hermetia illucens.Agricultural Knowledge,(3):44-45.[王付彬,刘玉升,张秀波,2010.黑水虻.农业知识 (科学养殖),(3):44-45]
Xie XS,Dong JZ,Li J,Li YL,Wang YY,Li XF,Zhang YN,2010.Analysis of the antimicrobial activity of antimicrobial peptides extracted from immunized Tenebrio molitor induced by different microbial treatments against 26 pathogens.Agricultural Science &Technology,11(9-10):1-4,9.
Yu GH,Chen YH,Yu ZN,Chen P,2009.Research progression on the larvae and prepupae of black soldier fly Hermetia illucens used as animal feedstuff.Chinese Bulletin of Entomology,46(1):41 -45.[喻国辉,陈燕红,喻子牛,程萍,2009.黑水虻幼虫和预蛹的饲料价值研究进展.昆虫知识,46(1):41-45]

