山核桃中类脂褐素提取方法的研究
翟纹静 郜海燕 陶 菲 穆宏磊 李文娟
(浙江省农业科学院食品科学研究所1,杭州 310021)
(南京农业大学食品科技学院2,南京 210095)
类脂褐素(Lipofuscin-like pigments,LFLP)是细胞胞浆内的一种棕黄色脂类颗粒,是由膜脂过氧化产物与细胞内的蛋白质、核酸和磷脂交联形成的一种带Schiff碱基的荧光性化合物[1]。早在1969年,Tappel等[2]提出了丙二醛与氨基酸反应形成脂褐素的荧光类似物。1975年,Maguire等[3]首次发现在香蕉和桃子果实成熟及衰老过程中有类脂褐素的产生,这是首次关于植物组织中存在类脂褐素的报道。此后又有一系列的研究探讨了荔枝、芒果以及玉米水稻等[4-6]农产品中类脂褐素随贮藏时间的不断积累,即类脂褐素与衰老有正相关性。
目前,有关植物中类脂褐素提取、纯化方法的报道不多,其提取和分析方法基本沿用动物和人体相关的一些方法[7]。关于山核桃类脂褐素的研究还鲜见报道,本试验以山核桃为试验材料,研究了这种含油量较高的坚果类的类脂褐素的提取及测定方法。
1 材料与方法
1.1 材料与仪器
山核桃:杭州创辉食品有限公司,选择大小基本相同,无病虫害,无裂缝的坚果,自然光下晒干(约3个完整日照),干燥处理至果仁含水量7%~8%;试剂均为分析纯。
电子天平:塞多利斯科学仪器有限公司;GBC Cintra 20紫外-可见分光光度计:澳大利亚GBC公司;KQ5200 DE型数控超声波清洗器:昆山市超声仪器有限公司;MR23i冷冻离心机:法国JOUAN公司;F-7000日立荧光光度计:日本日立公司。
1.2 试验方法
1.2.1 不同溶剂对类脂褐素的荧光光谱的影响
称取粉碎的生山核桃仁1 g,分别加入8 mL不同的溶剂:正己烷、氯仿、二氯甲烷、乙酸乙酯、正丁醇、异丙醇、丙酮、甲醇、乙醇、水,于40℃下振荡提取40 min后,离心收集溶剂层,经0.45μm滤膜过滤后,滤液用于荧光分光光度计分析。激发波长扫描范围300~390 nm,发射波长扫描范围400~490 nm。
1.2.2 不同提取方式对类脂褐素提取量的影响
称取粉碎的生山核桃仁1 g加入8 mL氯仿∶甲醇∶磷酸缓冲溶液(pH 6.0)(2∶1∶1),分别采用静置、震荡、超声以及搅拌不同的提取方式提取60 min,离心收集氯仿层,过滤后用于荧光分光光度计分析。激发波长360 nm,发射波长430 nm。
1.2.3 单因素试验
在提取试剂及提取方法确定的基础上,分别考察提取试剂pH、提取温度、提取时间3个因素对山核桃中类脂褐素提取量的影响。每个试验做3次平行试验。
1.2.4 正交试验
在单因素试验的基础上,综合考察提取液pH、提取温度、提取时间对类脂褐素提取量的影响,安排4因素3水平的L9(34)正交试验见表1,以确定最佳的提取条件参数。
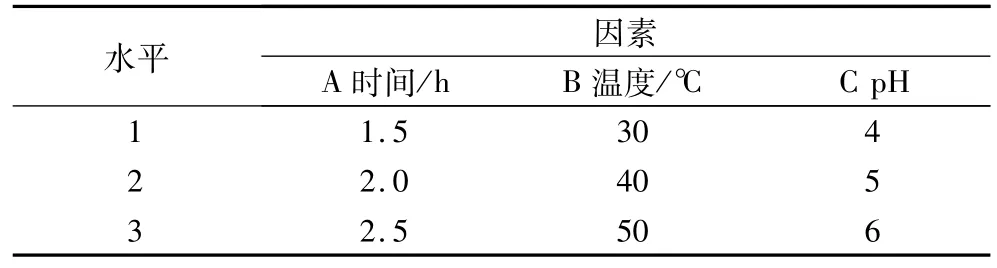
表1 因素与水平
1.3 数据统计
所有试验均重复3次,结果所列的数据是3次重复的平均值。采用SPSS 13.0对数据进行处理,试验数据采用ANOVA进行邓肯氏多重差异分析(P<0.05)。
2 结果与讨论
2.1 山核桃中类脂褐素的自发荧光特性
自发荧光是类脂褐素较为显著的特性[8],因此测定类脂褐素最常用的方法是利用荧光分光光度计或者荧光显微镜,参照其他植物中类脂褐素的测定[9-12],确定山核桃中类脂褐素的检测范围,激发波长范围是300~390 nm,发射波长范围是400~490 nm。根据试验结果采用360 nm为激发波长;固定激发波长,选用400~600 nm范围扫描发射光谱。结果如图1所示。在氯仿∶甲醇∶磷酸缓冲溶液(2∶1∶1)提取体系中,固定激发波长360 nm和发谢波长430 nm,测定提取液的荧光强度。用荧光强度表示类脂褐素的相对含量。
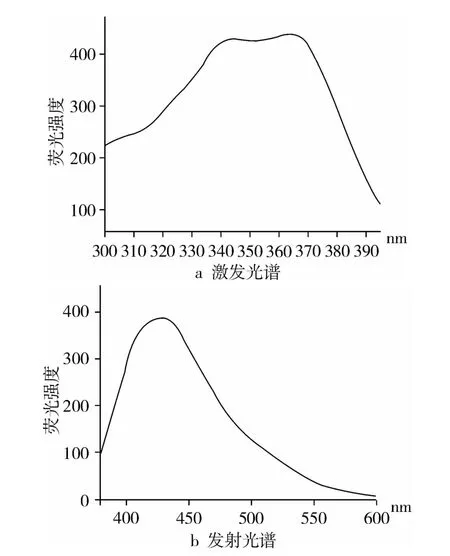
图1 山核桃中类脂褐素的激发光谱和发射光谱
2.2 山核桃前处理对类脂褐素测定的影响
山核桃中存在其他荧光物质,例如多酚类[5,13]、维生素类[14-15],对类脂褐素荧光测定可能会有干扰,必须在测定前排除这些荧光物质的干扰。试验结果发现,有些多酚物质如没食子酸、单宁酸有与类脂褐素有类似的荧光光谱,但大多为水溶性而不溶于氯仿;某些维生素类如维生素E、维生素B族有荧光光谱,但是基本不会对类脂褐素的测定造成干扰;脂肪酸类[16]对类脂褐素的荧光测定有较大的影响。
对于山核桃这种含油量较大的样品来说,脂肪酸等油溶性荧光物质对类脂褐素的测定影响较大,所以要对山核桃进行脱油前处理以排除油溶性荧光物质对类脂褐素测定的干扰。采用丙酮、乙酸乙酯、乙醚、石油醚对山核桃进行脱油,试验结果表明乙醚的除油效果最好。
山核桃中多酚类物质的含量很高,因此在山核桃类脂褐素的测定中多酚也会产生干扰,除去多酚类物质也是必要的。试验采用混合提取液氯仿∶甲醇∶水(2∶1∶1)提取类脂褐素,离心后对氯仿层进行三氯化铁反应试验[17]检测多酚类物质是否存在,结果为阴性表明氯仿层没有多酚类物质的存在。
采用以上方法可排除山核桃中其他物质对类脂褐素荧光测定的干扰。
2.3 不同溶剂对类脂褐素荧光光谱的影响
荧光的发射光谱与物质在有机溶剂中的结构密切相关。采用不同溶剂提取山核桃中的类脂褐素时,类脂褐素的自发荧光有所差异,结果如表2所示。在低极性的有机溶剂,如正已烷、二氯甲烷、正丁醇中自发荧光的荧光强度较高;而乙醇、异丙醇、甲醇、水作为溶剂时,山核桃类脂褐素的荧光强度较低,并且由于特殊溶剂效应的存在,随着溶剂极性的增强,荧光光谱的红移现象越明显。乙酸乙酯、丙酮作为提取溶剂时,在发射波长接近400 nm处有较强的脂肪酸荧光干扰,无法检测类脂褐素的荧光强度。
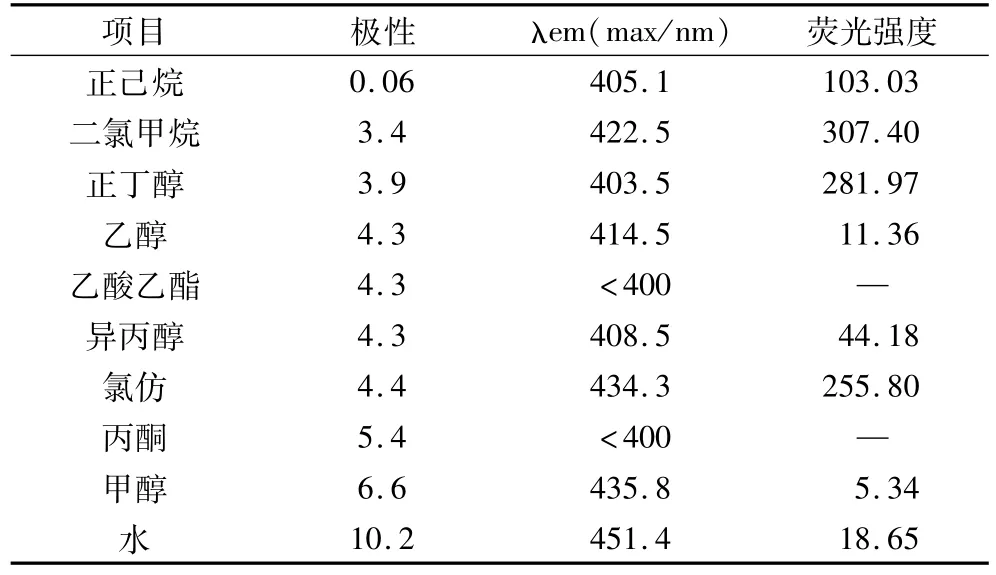
表2 不同有机溶剂对类脂褐素荧光光谱的影响
考虑提取液分层的优劣,并且可以尽可能去除其他杂质的干扰,氯仿是最适合的溶剂。
2.4 不同提取试剂pH对类脂褐素提取量的影响
图2为不同pH提取条件下山核桃中类脂褐素的荧光强度。pH 1时,山核桃中类脂褐素的荧光强度较小,随着pH的升高类脂褐素的荧光强度显著提高;当pH>5时,随着pH的增加类脂褐素的荧光强度有下降趋势。较低或较高的pH都不利于类脂褐素提取。这是因为pH的变化会影响有机物质荧光基团的酸碱性,在不同pH时,其结构可能发生变化,从而改变物质的荧光强度。因此,在荧光分析中要特别注意控制溶液的pH。上述试验结果表明,提取液的pH对类脂褐素的荧光强度有一定影响,因而试验时控制溶液在pH 5左右,能得到较高的提取率。
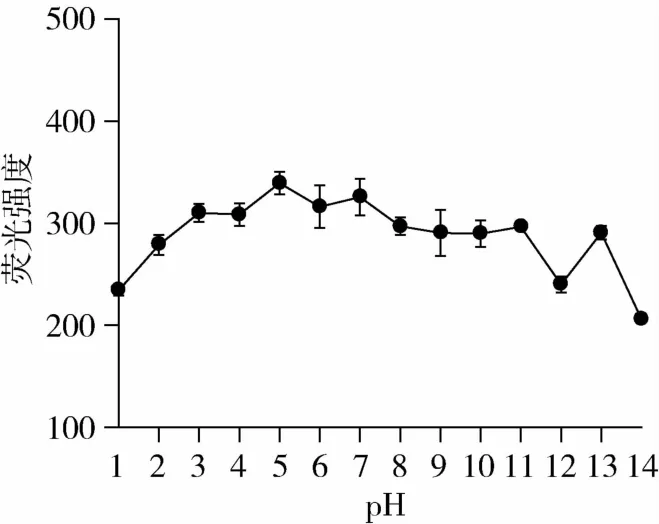
图2 不同pH提取液对类脂褐素荧光强度的影响
2.5 不同提取方式对类脂褐素提取量的影响
分别采用静置、震荡、超声波不同提取方式的测定结果如图3。

图3 不同提取方式对类脂褐素荧光强度的影响
由试验结果可知,搅拌、振荡、超声提取方式均好于静置提取,超声方式提取效率略低,可能是因为高强度超声可以降解聚合体,对某些物质的结构造成一定影响[18],但是除静置提取外各种提取方式间差异并不明显。
2.6 温度对类脂褐素提取量的影响
图4给出了不同提取温度下山核桃中类脂褐素的荧光强度变化。随着温度的升高类脂褐素的提取量也有所增加,但是在一定温度范围内类脂褐素的提取量无显著的变化。温度在10~40℃范围内时类脂褐素的提取量保持在一个较低的水平,随着温度的上升提取量变化并不明显;当温度大于40℃时,类脂褐素提取量有较为明显的增加。由于氯仿的沸点是63.3℃,温度过高会造成氯仿的挥发,所以提取温度不宜超过60℃。类脂褐素的提取温度应在40~60℃之间为宜。

图4 温度对类脂褐素提取量的影响
2.7 不同提取时间对类脂褐素提取量的影响
不同提取时间的结果如图5所示。随着提取时间的延长,类脂褐素的提取量呈现先上升后平缓的趋势;提取时间小于1.5 h时类脂褐素的提取量较低;之后随着提取时间的延长,类脂褐素的提取量有了明显的增加,此时的提取时间较短,类脂褐素还没有被完全提取出来,时间越充分类脂褐素的提取量越大。2.5 h后随着时间的进一步延长,类脂褐素的提取量趋于平稳略有下降。这是因为一段时间后,类脂褐素已经被充分提取出来,提取液与山核桃中的类脂褐素浓度达到了平衡,有效浓度不再随时间的延长而增加。
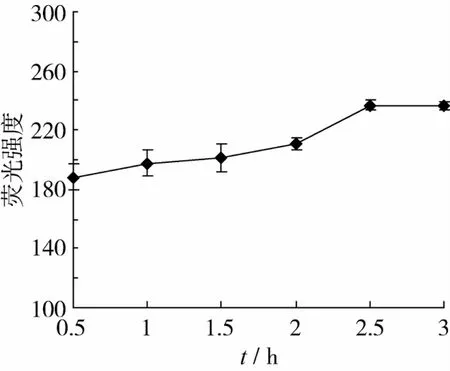
图5 提取时间对类脂褐素提取量的影响
2.8 正交试验
在单因素试验的基础上,安排4因素3水平的L9(34)正交试验,试验结果见表3,方差分析见表4。
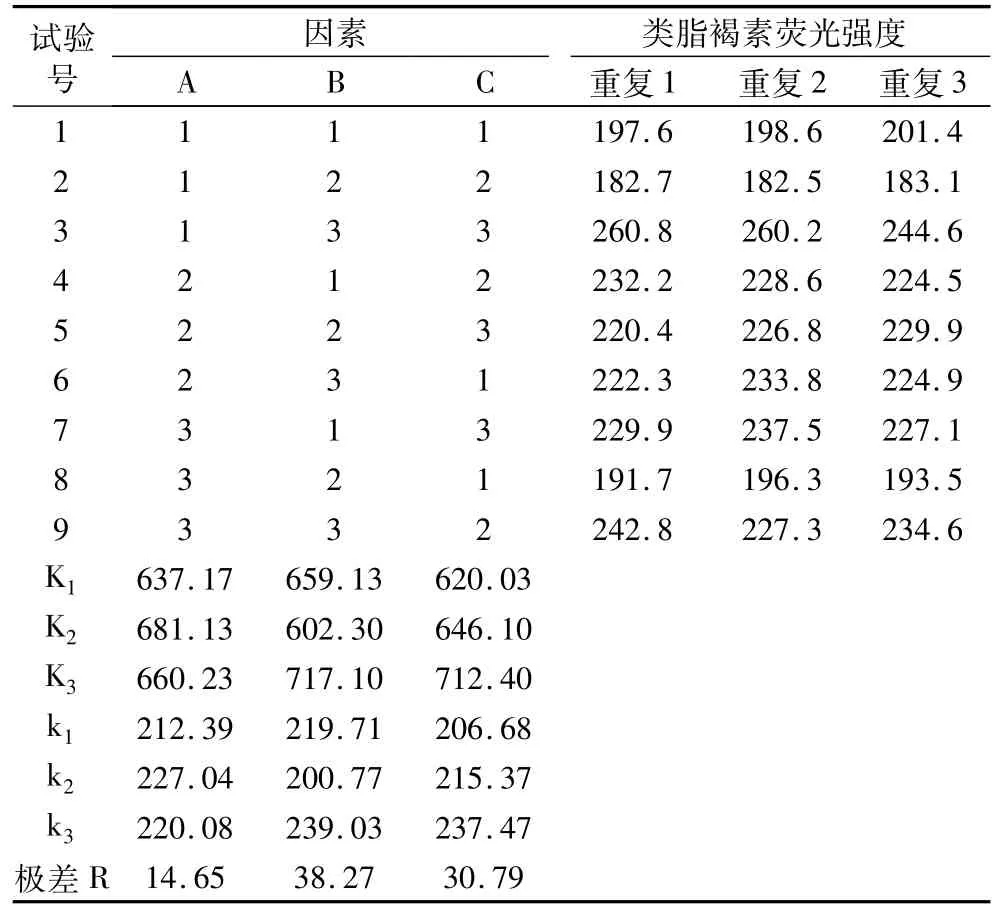
表3 正交试验结果
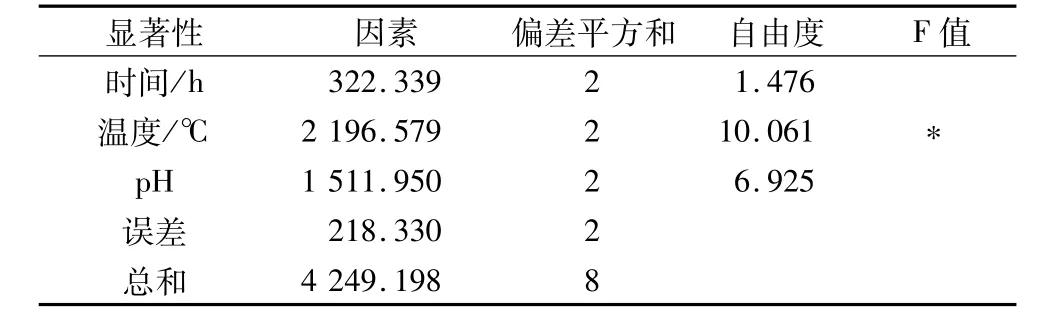
表4 方差分析
从正交试验直观分析推测,各因素对类脂褐素的荧光强度影响程度依次为:B>C>A,即影响类脂褐素提取量的因素依次是:提取温度>提取液pH>提取时间。影响山核桃类脂褐素提取量的主要因素为提取液的pH和提取温度,而提取时间对类脂褐素提取量的影响并不明显。进一步的方差分析说明提取温度是影响类脂褐素提取效率的显著因素,而提取时间和提取液pH是非显著因素,对类脂褐素的提取影响不大。因此,在优选山核桃类脂褐素提取工艺时,应当主要考虑提取温度。根据正交试验结果,山核桃类脂褐素的提取工艺中,最佳的因素组合为A2B3C3,即提取时间2.0 h,提取温度为50℃,提取液pH 6.0。
3 结论
自发荧光是类脂褐素最显著的特性,但是在不同溶剂中类脂褐素的荧光光谱有较大的差异,因此选择合适的溶剂,并采取适当的手段排除干扰物质,是类脂褐素荧光光谱法测定的必要条件。本试验采用氯仿:甲醇:缓冲溶液(2∶1∶1)混合提取试剂对类脂褐素进行提取,并确定山核桃中类脂褐素在该混合提取液中的特征荧光光谱:激发波长为360 nm、发射波长为430 nm。正交试验所得的山核桃类脂褐素最佳提取条件为提取时间2.0 h,提取温度为50℃,提取液pH 6.0。山核桃类脂褐素提取方法的确立对研究其在植物衰老过程中产生机理有重要作用。
[1]Tappel A L.Lipid peroxidation and fluorescent molecular damage to membranes[J].Pathobiology of Cell Membrane,1975,1:145-170
[2]Chio K S,Tappel A L.Synthesis and characterization of the fluorescent products derived from malondialdehyde and amino acids[J].Biochemistry,1969,8:2821-2827
[3]Maguire Y P,Harrd N F.Fluorescent productaccumulation in ripening fruit[J].Nature,1975,258:599-600
[4]林植芳,王伟,林桂珠,等.采后荔枝果实的类脂褐素和有机自由基水平的变化[J].生物化学与生物物理研究进展,1988,15(5):377-378
[5]Prabha T N,Patwardhan M V.Lipofuscin like compound in mango[J].Journal of Biosciences,1982,4(4):401-403
[6]王伟,孙谷畴,林植芳.类脂褐素及丙二醛与α-生育酚对它的影响[J].植物生理学通讯,1988,(3):32-34
[7]郜海燕,翟纹静,陶菲,等.植物类脂褐素的研究现状和展望[J].中国食品学报,2011,11(4):1-6
[8]Mohan K G N,Richard K N.Changes in lipid peroxidation and lipolytic and free radical scavenging enzyme activities during aging and sprouting of potato(Solanum Tuberosum)seed-tubers[J].Plant Physiology,1993,102:115-124
[9]Wilhelm J,Wilhelnova N.Accumulation of lipofuscin-like pigments in chloroplasts from senescent leaves of Phaseolus vulgaris[J].Photosynthetica,1981,15:55-60
[10]孙谷畴,林植芳.ABA诱致叶绿体膜变化和脂褐素类似物积累[J].植物生理学报,1988,14(4):395-397
[11]WilhelmováN,Domingues PM D N,SrbováM,et al.Changes in nonpolar aldehydes in bean cotyledons during ageing[J].Biologia plantarum,2006,50(4):559-564
[12]Meir S,Philosoph-Hadas S,Aharoul N.Ethylene-increased accumulation of fluorescent lipid peroxidation products detected during senescence of parsley by a newly developedmethod[J].Journal of the American Society for Horticultural Science,1992,117:128-132
[13]张丽霞,贾明,夏文娟,等.茶多酚绿色荧光特性研究[J].茶叶科学,2004,24(4):288-294
[14]阚健全.荧光法快速测定食品中的维生素E[J].分析测试学报,1993(3):51-54
[15]马明阳,屈颖娟,李晨露.荧光光谱法测定多种复杂样品中的维生素 B2[J].光谱实验室,2011,28(3):1138-1141
[16]赵文艳,杨成方,刘莹.饱和脂肪酸-乙醇溶液荧光光谱特征研究[J].徐州师范大学学报,2009,27(2):55-58
[17]俞彦波,江婷,周才琼.卡亚多酚定性定量分析及提取工艺优化[J].食品科学,2011,32(10):84-87
[18]张丽芬,朱婉萍,刘东红,等.食品功能组分超声辅助提取的研究进展[J].中国食品学报,2011,11(3):128-132.

