胃部肿瘤影像学进展
诗涔 张欢
(上海交通大学医学院附属瑞金 医院放射科 上海 200025)
胃部肿瘤是消化系统的常见病和多发病,新版WHO组织学分型将胃部肿瘤分为癌、上皮性肿瘤、神经内分泌肿瘤、间叶性肿瘤、淋巴瘤和继发性肿瘤。近年来随着医学和相关学科的发展,胃部肿瘤的影像诊断方面有了跨越式进步,本文将对胃部各类常见肿瘤的影像学研究进展进行逐一介绍。
1 胃癌
胃癌是消化道最常见的肿瘤,TNM分期系统可以有效的评估胃癌患者的预后。高质量的气钡双对比造影可显示黏膜面的微细结构而对胃癌尤其是早期胃癌的诊断具有重要价值,有报道认为其对黏膜和黏膜下病变的诊断准确率可达96%[1],但在中国,其对早期胃癌的诊断率仍较低。目前胃癌术前分期影像诊断常用方法为多排螺旋计算机体层成像(multidetector-row computed tomography,MDCT)、超声内镜检查(endoscopic ultrasonography,EUS)、和磁共振成像(magnetic resonance imaging,MRI)。
MDCT常规采用低张水充盈胃、静脉团高压注射造影剂后三期动态增强扫描技术。胃癌主要表现为胃壁的异常增厚和(或)异常强化(图1、2),并可根据增强的范围来推断肿瘤侵袭胃壁的深度、病变的大小、性质及周围侵犯状况。近年来多数报道MDCT对胃癌术前T分期的诊断准确率均可达60%以上。而MDCT对淋巴结转移的判断目前尚无较统一的标准,多数学者将淋巴结短径是否大于某个数值作为衡量其是否转移的标准,但此法特异度不高,据报道胃癌患者中出现良性淋巴结短径≥6 mm的频率要明显高于健康人群[2]。既往也有学者提出根据淋巴结增强程度、CT值或形态等来判定是否发生转移,但均未得到广泛认可。近来有研究发现使用双能量CT则可提高胃癌术前N分期的准确性[3]。MDCT对胃癌远处转移的灵敏度较高,尤其对肝转移及腹膜转移的诊断具有较大优势,其诊断远处转移的准确率可达100%。目前发展应用较快的3D重建功能,特别是MDCT结合多平面重建和虚拟内镜(virtual endoscopy, VE)不仅可从不同的切面观察病变与周围临近组织器官的位置关系,而且VE可直观显示肿瘤的隆起、溃疡、环堤、黏膜纠集及管腔狭窄和管壁僵硬等,因此均在一定程度上提高了胃癌术前分期的准确性。利用最大密度投影进行血管成像,可以比较清晰的显示胃周血管及胃肿瘤的血供,为腹腔镜下胃切除术提供重要信息[4]。此外,灌注CT等各项技术均为胃癌的诊断提供了更为全面的信息。目前临床上对MDCT的使用已不局限于术前诊断及分期,它还是评估胃癌化疗等治疗方法疗效和随访最常用的影像学方法。
EUS作为胃癌检测的另一种重要手段,由于其可显示胃壁的五层结构,因此对黏膜和黏膜下癌具有较高的诊断准确率,并且可以区分两者,从而为早期胃癌的内镜下黏膜切除术提供了较准确的依据[5]。虽然有其独特的优势,但不少研究均发现EUS存在较多过度分期的情况,这在一定程度上局限了其临床应用[6-7]。EUS对胃癌T分期的准确率为60%~90%,N分期的准确率为50%~78%,对远处转移的诊断较局限。由于EUS受到探头主体扫描范围的限制,对有溃疡形成或弥漫浸润的较大肿瘤的诊断准确率较低,并且无法明确胃周脏器的具体浸润情况及远处淋巴结转移情况。对于某些缩窄型胃癌患者,EUS更无法进行。以往认为EUS只适合在已明确无远处转移的患者中使用,但近年来超声内镜引导下细针穿刺活检术(EUS-guided fine-needle aspiration,EUSFNA)越来越多应用到临床中,由于其可提供较准确的组织学诊断,在一定程度上可提高远处淋巴结转移和肝转移的检出率[8]。此外,一些新技术如EUS弹性成像、双对比增强EUS等则可能在不久的将来进一步弥补EUS的不足,尤其在EUS-FNA阴性而临床仍怀疑有转移的人群中进一步检查,可提高诊断准确率,为患者最佳治疗方案的选择提供重要信息[9]。
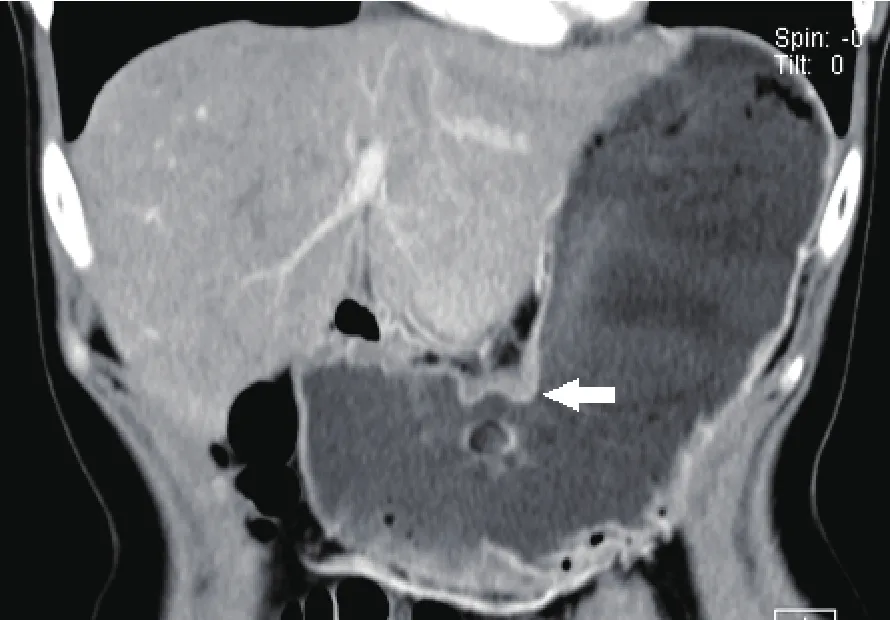
图1 增强CT冠状位重建示胃角小弯侧胃壁增厚,可见异常强化。病理证实为低分化腺癌,部分印戒细胞癌,侵及黏膜下层。
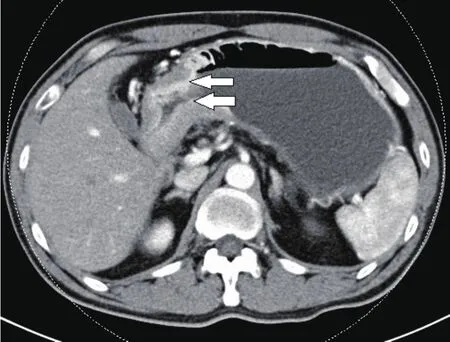
图2 增强CT示胃窦部胃壁局限性增厚,动脉期轻度强化。胃壁边缘毛糙,见纤维条索影,胃周脂肪间隙模糊。病理证实为进展期胃癌。
MRI具有多平面多参数成像能力,在胃癌的诊断中仍有重要地位。胃壁增厚是MRI诊断胃癌的重要依据之一,进展期胃癌常表现为胃壁不规则增厚或软组织肿块,伴或不伴溃疡,可有胃腔变形和狭窄。胃癌在MRI不同序列上的信号特征,在一定程度上可以反映其病理学构成,含纤维结缔组织较多者表现为T1WI、T2WI低信号,含黏液成分多者及肿瘤局部坏死时T2WI表现为高信号。以往的比较分析发现,MRI对胃癌术前分期的准确性并无明显差别[10],如今已较少单独使用MRI进行胃癌术前分期评估。目前对MRI研究较多的为弥散加权成像(diffusion-weighted imaging,DWI),胃癌一般呈中高信号,而胃周转移淋巴结在DWI上也和胃癌表现类似,呈中高信号,这对发现远处转移淋巴结,特别是较小的淋巴结有帮助;DWI联合弥散加权系数(apparent diffusion coefficients, ADC)值对胃良、恶性肿瘤的鉴别具有重要意义,同时还可帮助区分胃腺癌和淋巴瘤[11]。研究发现,Borrmann 4型胃癌在DWI上可呈现“三明治”征象,即内外层高信号、中层低信号,较具特征性,同时,肿瘤较低的ADC值可将其从充盈不良的胃壁中区分出来,从而提高诊断准确率,有助于鉴别区分Borrmann 4型肿瘤[12]。
2 胃淋巴瘤
胃淋巴瘤起自胃黏膜下的淋巴组织,占胃恶性肿瘤的3%~5%,仅次于胃癌。胃淋巴瘤以B细胞来源的非霍奇金淋巴瘤多见,其中又以黏膜相关淋巴样组织(mucosa-associated lymphoid tissue, MALT)和弥漫大B细胞淋巴瘤亚型多见。与胃癌常用的TNM分期不同,淋巴瘤的分期较多采用Ann Arbor系统、Lugano系统和Paris分期系统。临床分期和组织学分级是淋巴瘤最重要的两个独立预后因素。目前的研究均表明,淋巴瘤的发生是多因素共同作用的结果,幽门螺杆菌感染与淋巴瘤的发生有直接关系,t(11; 18)(q21; q21)、t(1; 14)(p22; q32)和t(14; 18)(q32; q21)基因异位同样也被证实与MALT的发生有关[13]。
MDCT可以直观显示胃壁受累的程度和范围,胃淋巴瘤主要表现为胃壁广泛性或节段性增厚,不常侵犯临近器官,或使胃周脂肪层消失,常伴腹腔内肿大淋巴结;增厚的胃壁密度均匀,增强时呈一致性轻中度持续强化(图3)。大部分研究均认为胃壁大范围受累,但能保持良好的柔软度及扩张度,同时较少侵犯胃周结构者,高度提示为胃淋巴瘤;胃周广泛淋巴结肿大(两个区以上),且肿大淋巴结相互融合,腹膜后肾门下淋巴结肿大也有利于胃淋巴瘤的诊断。但也有少数胃淋巴瘤可出现类似革囊胃的表现,狭窄可累及胃窦、胃体或胃底,可为局部狭窄,也可表现为整个胃腔的缩小。MDCT结合多平面重建和VE虽进一步提高了诊断准确率,但由于胃淋巴瘤的MDCT表现缺乏特异性,并且MDCT无法确定肿瘤侵犯胃壁的程度及其具体分型,对一些化疗后患者的诊断准确率不高,因此MDCT对淋巴瘤的诊断仍存在一定局限性[14]。MRI可在MDCT的基础上进一步判断肝、脾、腹膜后淋巴结、脊髓、肌肉等是否受累,由于其临床价值与MDCT相似,但受胃肠道蠕动影响较大,且花费高于MDCT,故一般不单独使用MRI诊断胃淋巴瘤。
EUS在胃淋巴瘤的诊断中占有重要地位。它可以较准确的进行局部淋巴瘤的分期,而且当胃镜与组织学检查无法明确诊断时,EUS仍可以提示肿瘤的发展及复发的可能性[15]。EUS结合高频迷你探头可更精确的诊断病变,弹性成像、EUS-FNA等新技术均可提高EUS的诊断准确率。但由于胃淋巴瘤主要采用非手术的治疗方式,这些方法对胃淋巴瘤的诊断价值仍缺乏明确有效的证据。有学者提出EUS结合多点活检及幽门螺杆菌检测应作为非霍奇金淋巴瘤的标准诊断方法[16]。但对淋巴瘤,尤其高分化淋巴瘤治疗后的患者,EUS常会出现一些与内镜活检不相符合的结果。EUS显示胃部正常的时间要晚于内镜和活检提示正常的时间,因此对许多治疗后随访的患者,EUS的使用价值有限[15,17]。正电子发射体层成像(positron emission tomography,PET)/CT主要用于显示肿瘤在放、化疗治疗前后的发展或消退程度,评价治疗的有效性,指导临床医生进一步的治疗[18],同时也可较准确的检出淋巴瘤治疗后的复发灶,对一些结构成像不能明确诊断的患者,PET的功能性成像或可提供一些诊断的重要信息[19]。总之,由于胃淋巴瘤的临床征象及各项影像学表现均缺乏特异性,其确诊主要依靠内镜活检;另一方面,淋巴瘤的治疗必须建立在确定的病理亚型基础上,因此,多次重复大量活检方案才是真正准确指导临床治疗方式选择的金标准,仅凭单纯的影像学检查是远远不够的[14]。
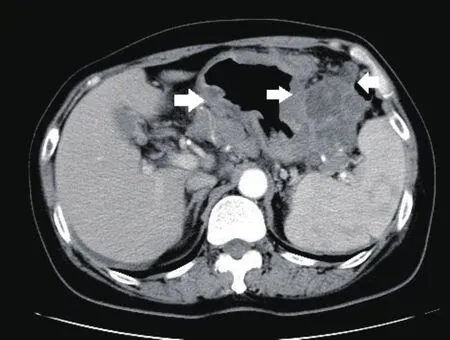
图3 增强CT示胃体胃壁广泛不规则明显增厚,浆膜层显示毛糙,动脉期明显强化,胃周可见多个软组致密度影,增强后不均匀强化,为肿大融合的淋巴结。病理示弥漫大B细胞淋巴瘤。
3 胃肠道间质瘤
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是一类独立的来源于胃肠道管壁间充质细胞的非定向分化肿瘤,是胃间叶性肿瘤中较常见的一种类型,好发于50~70岁中老年人。它可发生在胃肠道的任何部位,但近60%发生在胃部。相当一部分(约30%)GIST均无症状,部分患者可出现不明确的腹部疼痛、触及肿块和/或胃肠道出血等症状。MDCT是目前常用的检查手段,GIST在MDCT上的主要特征(图4)为:平扫为圆形、类圆形或分叶状软组织肿块;偶见斑点状钙化;增强时,肿块实性部分在动脉期中度或明显强化,静脉期强化更明显,部分病灶内或瘤旁可见线状、簇状排列的小血管影;肿瘤越大,形态越不规则,密度越不均匀,越易发生坏死、囊变及出血,当坏死部分与胃肠道相通时,可见气液平,形成"假肠腔"征;但较少发生邻近组织和血管的侵犯。MDCT虽可以清楚显示肿瘤的大小、形态及范围,对良、恶性的诊断也有一定的辅助意义,但却不能明确肿瘤来源,无法排除其他软组织肿瘤的诊断,如平滑肌瘤、平滑肌肉瘤等,常会漏诊一些小肿瘤。MRI主要用于肝功能不良或有CT禁忌症的患者;而PET主要用于评估GIST对早期治疗的反应[20]。
EUS可作为GIST最为准确的影像学诊断方法,它不仅可以显示肿瘤的大小、形态,而且可提供肿瘤来源信息,并可根据肿瘤回声判断其内部结构。GIST在EUS上的典型征象为,起源于固有肌层的边界光滑清晰低回声肿块;恶性GIST由于血供不足而出现坏死囊变区和高回声区。EUS可根据肿瘤的形态学特征如大小、边界是否清晰等推测肿瘤的良、恶性,但不少学者均表示,EUS对起源于固有肌层的小、低回声肿块的诊断价值有限,往往需要结合组织病理学检查。以往的众多研究均表明EUS-FNA对GIST具有较高的灵敏度,但有些研究也发现EUS-FNA的诊断准确性与肿瘤大小、位置及起源有关,如十二指肠处较难取材,因而诊断准确率较低,说明EUS-FNA在一定程度上依赖于操作者的取材位置及熟练程度。此外,单纯细胞学检查也无法确定GIST的良、恶性;而细胞有丝分裂指数,作为判断GIST恶性程度的一个重要指标,通过EUS-FNA的细胞学取样同样无法明确[21]。因此,近年来有学者提出使用内镜去顶技术可以弥补EUS-FNA的不足,获得足够的组织样本从而明确诊断,其并发症较EUS-FNA明显减少[22],但目前仍未得到广泛应用,其临床价值还需更大样本的研究评估。
免疫组化仍是目前确诊GIST最重要的手段。95%的GIST表现为CD117阳性,60%~70%的GIST表现为CD34阳性。近年来研究发展的DOG1与CD117具有相同的诊断灵敏度,并且可诊断CD117阴性和/或PDGFR-a阴性的GIST[23]。NCCN指出DOG1可用于单独依靠CD117不能明确诊断的GIST。
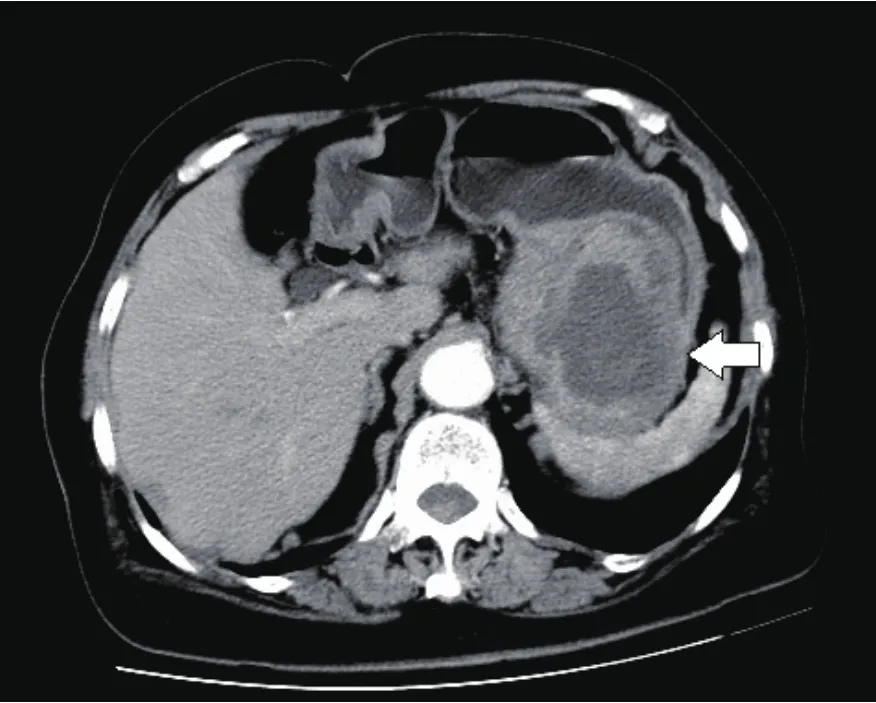
图4 增强CT示脾胃间巨大软组织占位,内可见低密度坏死灶,增强后病灶可见明显强化,胃底部黏膜未见明显增厚。术后病理证实为胃间质瘤,高度危险。
4 神经内分泌肿瘤
神经内分泌肿瘤(neuroendocrine neoplasm, NEN)在临床较少见,以胰腺最为高发,其次为阑尾、直肠、小肠、胃、食管和胆囊。胃肠道NEN的临床表现多种多样,主要与肿瘤分泌的激素及其活性有关,亦与肿瘤所在部位及累及的范围有关。如类癌多伴有5-羟色胺分泌过多的表现,如皮肤潮红、哮喘、腹泻、心内膜纤维化、三尖瓣病变等。而临床上有很大一部分肿瘤由于分泌的物质缺乏活性或者分泌量不足,这些肿瘤往往只表现为局部的肿块或(和)转移病灶,即无功能性肿瘤。2010年的WHO分类是基于所有胃肠道胰腺NEN都具有潜在恶性这一观点,不同的是其发生转移的概率。胃NEN虽然少见,但由于其潜在恶性倾向和较差的预后,在临床上需要特别警惕,同时应根据不同类型NEN及不同临床需求选择合适的检查手段。
直径大于1 cm的胃NEN在MDCT上常表现为胃壁的局部增厚、隆起、软组织块影(图5),体积大者常见坏死,中度强化,体积越大检出率越高。胃NEN的MDCT表现缺乏较特异的征象,临床上亦缺乏较特征的表现,MDCT检查的更大意义在于分期。MRI在显示胰腺、肝脏NEN或转移具有较大价值,尤其是一些MDCT难以定性的病变可行MRI检查,但对胃NEN的诊断价值不大。EUS主要对胰腺NEN具有明显优越性,但EUS-FNA对胃NEN术前分期也有重大意义。近年来国内逐渐开展的生长抑素受体闪烁成像(somatostatinreceptor scintigraphy, SRS)对胃NEN的灵敏度可超过75%,而融合了PET/CT的SRS具有更高的敏感性和特异性,在探测转移灶方面存在明显优势,在探测病灶、肿瘤分期、指导治疗方案等方面的应用存在肯定的临床价值[24]。
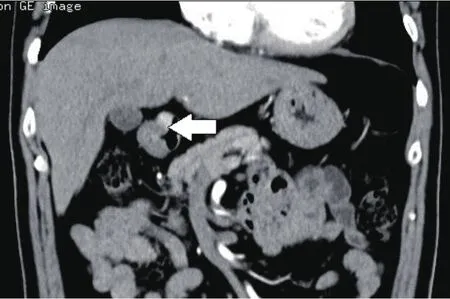
图5 增强CT冠状位重建显示胃壁稍厚,幽门管处可见一结节状影,沿管壁生长,明显强化。术后病理证实为胃NEN G2
5 结语
胃部的其他肿瘤如血管球瘤、神经鞘瘤、异位胰腺等在临床中所见不多,其有关的文献报道多是病例报道,目前尚无全面、大样本影像学特征的文献总结。虽然它们的影像学表现不尽相同,但在临床实际工作中大多都以MDCT和EUS作为胃肿瘤的重要影像检查手段,并结合其它方法如PET、内镜等做出较准确的诊断,从而指导临床治疗。相信随着各种影像学技术的飞速发展,胃部肿瘤的诊断也必将取得进一步的突破。
[1] Chen BB, Liang PC, Liu KL,et al.Preoperative diagnosis of gastric tumors by three-dimensional multidetector row CT and double contrast barium meal study: correlation with surgical and histologic results[J].J Formos Med Assoc, 2007, 106(11):943-952.
[2] Park HS, Kim YJ, Ko SY,et al.Benign regional lymph nodes in gastric cancer on multidetector row CT[J].Acta Radiol,2012, 53(5): 501-507.
[3] Pan Z, Pang L, Ding B,et al.Gastric cancer staging with dual energy spectral CT imaging[J].PLoS One, 2013, 8(2):e53651.
[4] Miyaki A, Imamura K, Kobayashi R,et al.Preoperative assessment of perigastric vascular anatomy by multidetector computed tomography angiogram for laparoscopy-assisted gastrectomy[J].Langenbecks Arch Surg, 2012, 397(6): 945-950.
[5] Hwang SW, Lee DH, Lee SH,et al.Preoperative staging of gastric cancer by endoscopic ultrasonography and multidetector-row computed tomography[J].J Gastroenterol Hepatol, 2010, 25(3): 512-518.
[6] Meyer L, Meyer F, Schmidt U,et al.Endoscopic ultrasonography (EUS) in preoperative staging of gastric cancer--demand and reality[J].Pol Przegl Chir, 2012, 84(3):152-157.
[7] Caletti G, Fusaroli P.The rediscovery of endoscopic ultrasound (EUS) in gastric cancer staging[J].Endoscopy,2012, 44(6): 553-555.
[8] Hassan H, Vilmann P, Sharma V.Impact of EUS-guided FNA on management of gastric carcinoma[J].Gastrointest Endosc,2010, 71(3): 500-504.
[9] Fusaroli P, Saftoiu A, Mancino MG,et al.Techniques of image enhancement in EUS (with videos)[J].Gastrointest Endosc, 2011, 74(3): 645-655.
[10] Anzidei M, Napoli A, Zaccagna F,et al.Diagnostic performance of 64-MDCT and 1.5-T MRI with highresolution sequences in the T staging of gastric cancer: a comparative analysis with histopathology[J].Radiol Med,2009, 114(7): 1065-1079.
[11] Avcu S, Arslan H, Unal O,et al.The role of diffusionweighted MR imaging and ADC values in the diagnosis of gastric tumors[J].JBR-BTR, 2012, 95(1): 1-5.
[12] Zhang XP, Tang L, Sun YS,et al.Sandwich sign of Borrmann type 4 gastric cancer on diffusion-weighted magnetic resonance imaging[J].Eur J Radiol, 2012, 81(10): 2481-2486.
[13] Isaacson PG, Du MQ.Gastric lymphomas: genetics and resistance toH.pylorieradication[J].Verh Dtsch Ges Pathol,2003, 87: 116-122.
[14] Boot H.Diagnosis and staging in gastrointestinal lymphoma[J].Best Pract Res Clin Gastroenterol, 2010, 24(1):3-12.
[15] Vetro C, Romano A, Chiarenza A,et al.Endoscopic ultrasonography in gastric lymphomas: appraisal on reliability in long-term follow-up[J].Hematol Oncol, 2012, 30(4): 180-185.
[16] Guzicka-Kazimierczak R, Zdziarska B, Kazimierczak A,et al.Gastric non-Hodgkin’s lymphoma--clinical symptoms and diagnostic problems[J].Wiad Lek, 2011, 64(1): 3-8.
[17] Janssen J.The impact of EUS in primary gastric lymphoma[J].Best Pract Res Clin Gastroenterol, 2009, 23(5): 671-678.
[18] 吴江, 朱虹.氟-18-脱氧葡萄糖PET/CT在胃淋巴瘤的诊断及疗效评价中的应用[J].中国医学影像学杂志, 2011,19(11): 825-829.
[19] Sharma P, Suman SK, Singh H,et al.Primary gastric lymphoma: utility of 18F-fluorodeoxyglucose positron emission tomography-computed tomography for detecting relapse after treatment[J].Leuk Lymphoma, 2013, 54(5): 957-958.
[20] Kalkmann J, Zeile M, Antoch G,et al.Consensus report on the radiological management of patients with gastrointestinal stromal tumours (GIST): recommendations of the German GIST Imaging Working Group[J].Cancer Imaging, 2012, 12:126-135.doi: 10.1102/1470-7330.2012.0013.
[21] Faigel DO, Abulhawa S.Gastrointestinal stromal tumors:the role of the gastroenterologist in diagnosis and risk stratification[J].J Clin Gastroenterol, 2012, 46(8): 629-636.
[22] Lee CK, Chung IK, Lee SH,et al.Endoscopic partial resection with the unroofing technique for reliable tissue diagnosis of upper GI subepithelial tumors originating from the muscularis propria on EUS (with video)[J].Gastrointest Endosc, 2010, 71(1): 188-194.
[23] Miettinen M, Wang ZF, Lasota J.DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors: a study of 1840 cases[J].Am J Surg Pathol, 2009, 33(9): 1401-1408.
[24] 何云飞, 冯仕庭, 李子平.胃肠胰神经内分泌肿瘤的影像诊断进展[J].国际医学放射学杂志, 2012, 35(1): 53-58.

