HGF及G-CSF诱导大鼠骨髓间充质干细胞分化为肝样细胞
高 勇,梅浙川*,蒋明德
(1.重庆医科大学附属第二医院消化内科,重庆400016;2.成都军区总医院消化内科,四川成都610083)
近年来,关于骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)的研究已经成为干细胞研究的热点,BM-MSCs 在不同条件的诱导下可以分化为成骨细胞、脂肪细胞、软骨细胞、肝细胞、神经元等[1-2]。肝细胞生长因子(hepatocyte growth factor,HGF)是现在已知的肝细胞最强的促有丝分裂剂,被大量用于肝相关干细胞体外诱导分化的实验,可调控BM-MSCs 分化为肝细胞[3]。粒细胞集落刺激因子(granlocyte-colony stimulating factor,G-CSF)是一个大小为20 ku的糖蛋白,G-CSF 被广泛的用作于化疗时的辅助药物以及干细胞移植前的动员,关于G-CSF 体外诱导的报道很少。研究显示,用0.1 μmol/L G-CSF 培养的BM-MSCs 表达的HGF水平最高[4];血清中添加了G-CSF 后可以促进BM-MSCs的增值,并且能提高BM-MSCs 的活性[5]。本实验的目的是探讨HGF 以及G-CSF 可否诱导大鼠BM-MSCs 分化为肝样细胞,为干细胞的研究提供更有效的诱导方案。
1 材料与方法
1.1 实验动物
清洁级雄性SD 大鼠,3 ~4 周,体质量80 ~100 g,[四川华西医科大学实验室(SCXK(111)2009-09)]。
1.2 主要试剂
胎牛血清和低糖培养基(Hyclone 公司),Trizol RNA(宝生物公司),反转录试剂盒(Fermentas 公司),引物由上海生工合成,肝细胞生长因子(Peprotech 公司),重组人粒细胞集落刺激因子注射液(山东齐鲁制药公司),小鼠抗大鼠甲胎蛋白单克隆抗体和小鼠抗大鼠白蛋白单克隆抗体(Orbigen 公司),羊抗小鼠(博士德公司)。GAPDH 内参(上海康城公司)。兔抗鼠CD45-FITC、CD34-PE、CD90-FITC 和CD105-PE 单抗(Santa 公司)。
1.3 大鼠BM-MSCs 的鉴定以及体外分组及诱导
取P3 代的大鼠BM-MSCs,胰蛋白酶消化后制备成单细胞悬液,取2 ×105个细胞,分别加入兔抗鼠CD45-FITC、CD34-PE、CD90-FITC 和CD105-PE 单抗,室温避光孵育20 min,上流式细胞仪进行检测。
取P3 代BM-MSCs 细胞,接种在6 孔板中,约1.2 ×104个/孔,待1 ~2 d后细胞生长状况良好,长满1/3 ~1/2个孔后,分别加入已配置好的培养液。实验分为:对照组:10% 胎牛血清培养基,0.1 μmol/L G-CSF 干预组,20 ng/mL HGF 干预组,HGF 联合G-CSF 共同干预组(0.1 μmol/L G-CSF +20 ng/mL HGF),分别将诱导后第7、14 和21 天提取细胞总RNA 以及总蛋白。
1.4 RT-PCR 检测白蛋白(ALB)和甲胎蛋白(AFP)基因mRNA 转录
分别用RNAiso Plus 提取诱导第7、14 和21 天细胞的总RNA,再用Fermentas 公司反转录试剂盒合成cDNA,以GAPDH 为内参,GAPDH 引物序列F5'-CAAGGTCATCCATGACAACTTTG,R5'-GTCCAC CACCCTGTTGCTGTAG,产物大小496 bp。引物为AFP:F5'-ACTCCGGTATCAACC ACTGC,R5'-GGTC TTTGCAGCACTTCTCC,扩增产物长500 bp。ALB:F5'-TCTATGCCCCAGAACTCCTTTA,R5'-CACTCCTT GTTGATTTTGGTGA,扩增产物长289 bp,所有的引物均由上海生工合成。按照以下条件进行扩增:94 ℃2 min;94 ℃30 s、55 ℃45 s、72 ℃1 min扩增30 个循环,72 ℃1 min。将扩增PCR 产物用1.5%琼脂糖凝胶电泳成像。
1.5 Western blot 检测白蛋白(ALB)和甲胎蛋白(AFP)表达水平
将诱导第7、14 和21 天的细胞提取总蛋白,10%分离胶液以及5%浓缩胶液SDS-PAGE 电泳,每组加入50 μg总蛋白,电泳后转移到PVDF 膜上,封闭,加入小鼠抗大鼠甲胎蛋白单克隆抗体(1∶500稀释)和小鼠抗大鼠白蛋白单克隆抗体(1∶800 稀释),4 ℃孵育过夜,洗膜后加入HRP 标记的山羊抗小鼠抗体(1∶10 000稀释),再孵育1 h,暗室和UVP曝光。用ALB/GAPDH、AFP/GAPDH 的吸光度比值作为ALB、AFP 的相对表达水平。
1.6 统计学分析
2 结果
2.1 大鼠BM-MSCs 分离培养及诱导结果
镜下所见,P0 代BM-MSCs 24 h贴壁,3 ~5 d后细胞呈梭状,形成小细胞集落,逐渐增大,呈漩涡状;20 ng/mL HGF 干预组,HGF 联合G-CSF 共同干预组诱导第7 天,部分梭状细胞变成圆形细胞,诱导14 d大多数细胞变圆,并形成集落,形似肝细胞(图1)。
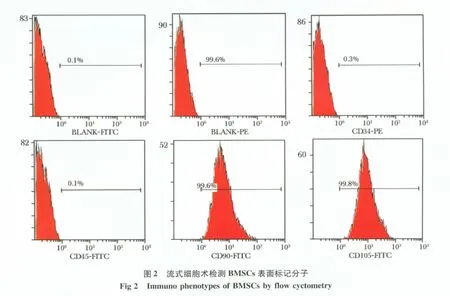
2.2 大鼠BM-MSCs 流式细胞表面标记结果
P3 代BM-MSCs 细胞表面标志物CD34、CD45、CD90 和CD105 表达量分别为:CD34-PE 0.3%、CD45-FITC 0.1%、CD90-FITC 99.6% 和CD105-PE 99.8%(图2)。
2.3 RT-PCR 检测肝细胞ALB、AFP mRNA 转录水平
对照组、0.1 μmol/L G-CSF 干预组均没有检测到ALB 和AFP mRNA 水平表达。20 ng/mL HGF 干预组和HGF 联合G-CSF 共同干预组在诱导后第7,14 和21 天均检测到ALB mRNA 水平表达,随时间递增,同一时间后者表达量高于前者(分别为P<0.05、P<0.01和P<0.05);在诱导后第7、14 天检测到AFP mRNA 水平表达,随时间递减,第21 天没有检测到AFP mRNA 水平表达,两组在同一时间比较(P<0.01)(图3,4)(表1)。
2.4 Western blot 检测肝样细胞ALB 和AFP 蛋白水平
对照组、0.1 μmol/L G-CSF 干预组均未检测到ALB 和AFP 蛋白水平表达。20 ng/mL HGF 干预组和HGF 联合G-CSF 共同干预组在诱导后第7、14 和21 天均检测到ALB 蛋白水平表达,随时间递增,后者表达量高于前者,同一时间差异相比(分别为P<0.05、P<0.05、P<0.01);在诱导后第7、14 天检测到AFP 蛋白水平表达,随时间递减,第21 天没有检测到AFP 蛋白水平表达,两组在同一时间差异相比(P<0.05)(图5,6)(表2)。
3 讨论
骨髓中BM-MSCs 含量很低,占所含细胞的0.01% ~0.001%,并随着动物年龄的增长会逐渐降低。本实验选取3 ~4 周的幼年SD 大鼠,用贴壁培养法获的原代BM-MSCs。迄今为止,对BM-MSCs表面标志物还不确定,本实验流式细胞术鉴定表面标志,CD34、CD45 阴性,高表达CD90、CD105,符合骨髓间充质干细胞的流式细胞表面标志[6-8]。
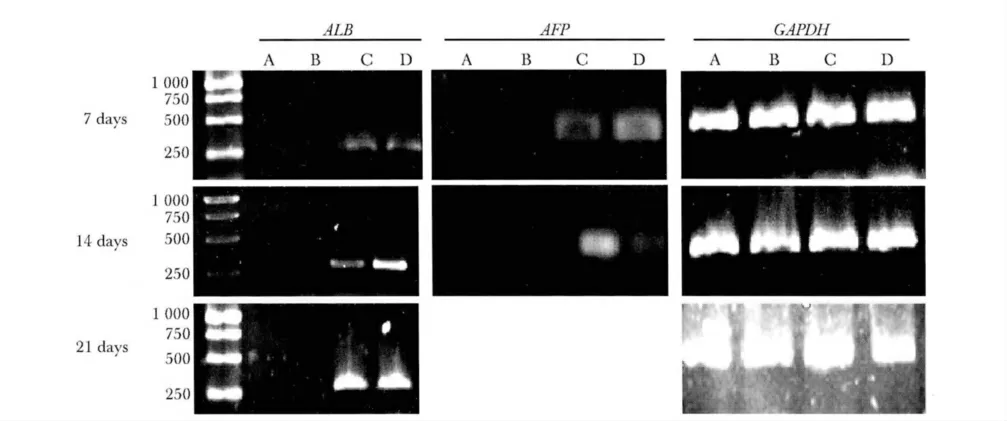
图3 诱导后各组细胞ALB 和AFP 基因水平表达Fig 3 ALB and AFP detected by RT-PCR after induction
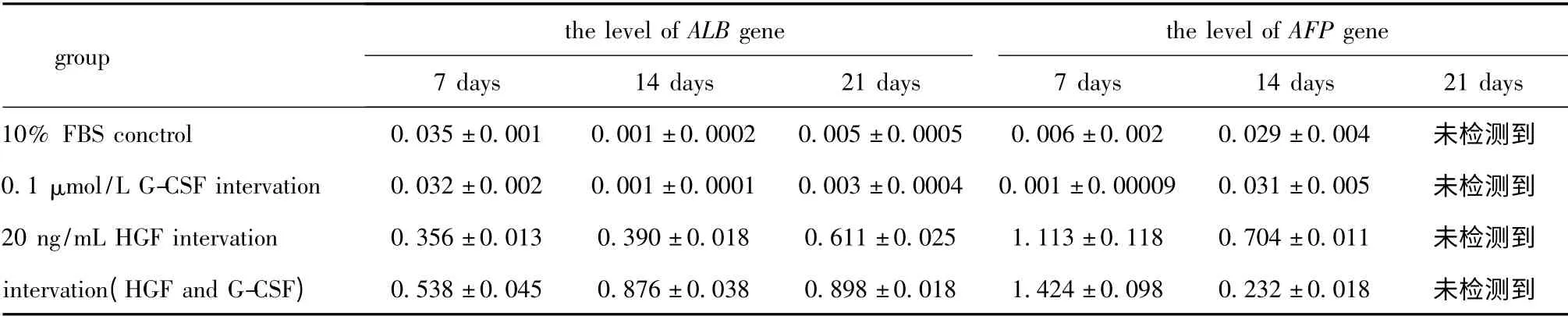
表1 各组不同时间ALB(AFP)mRNA/GAPDH 吸光度值Table 1 Absorbance ratio of mRNA of ALB or AFP to GAPDH on different days for every group
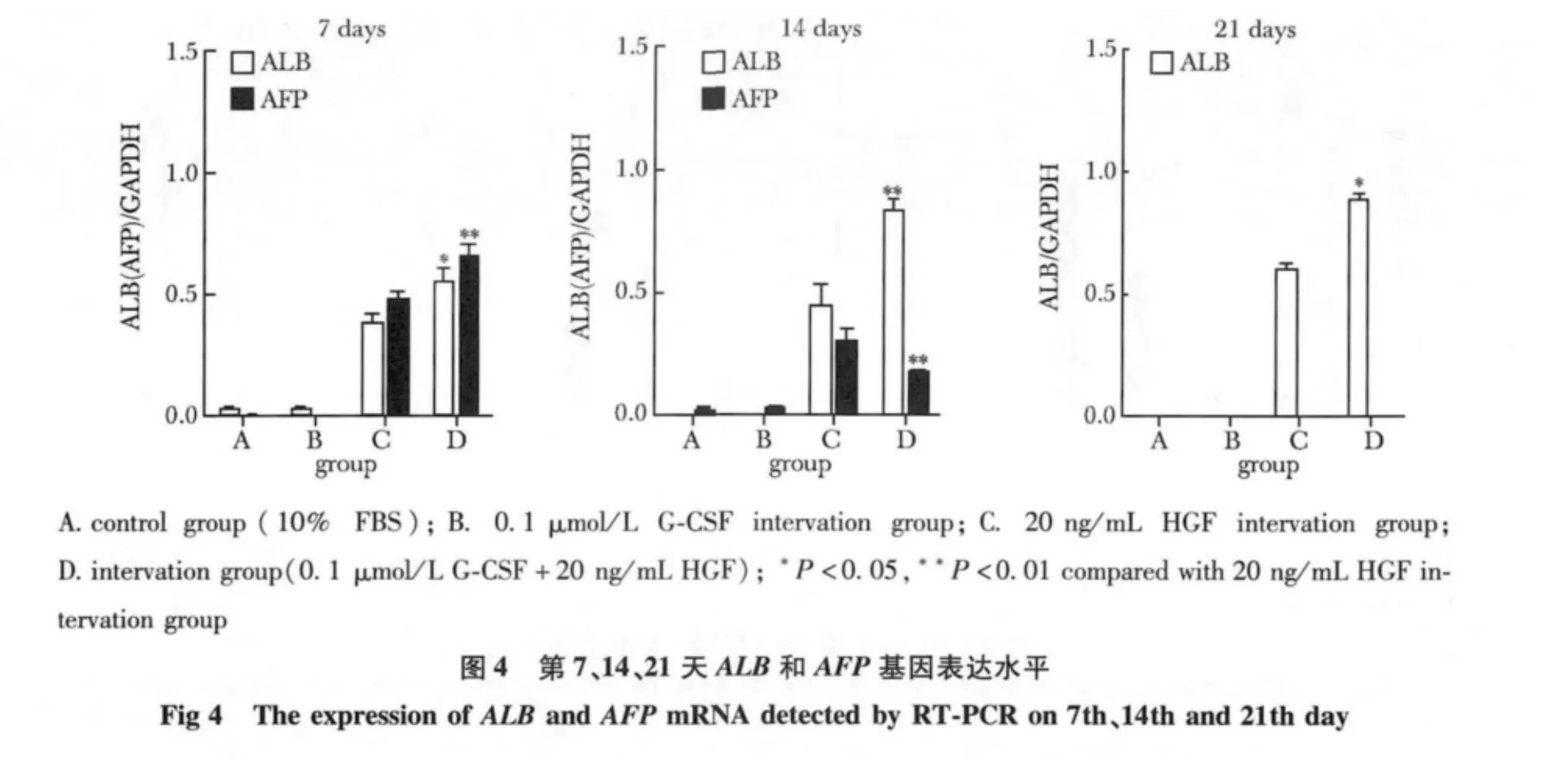
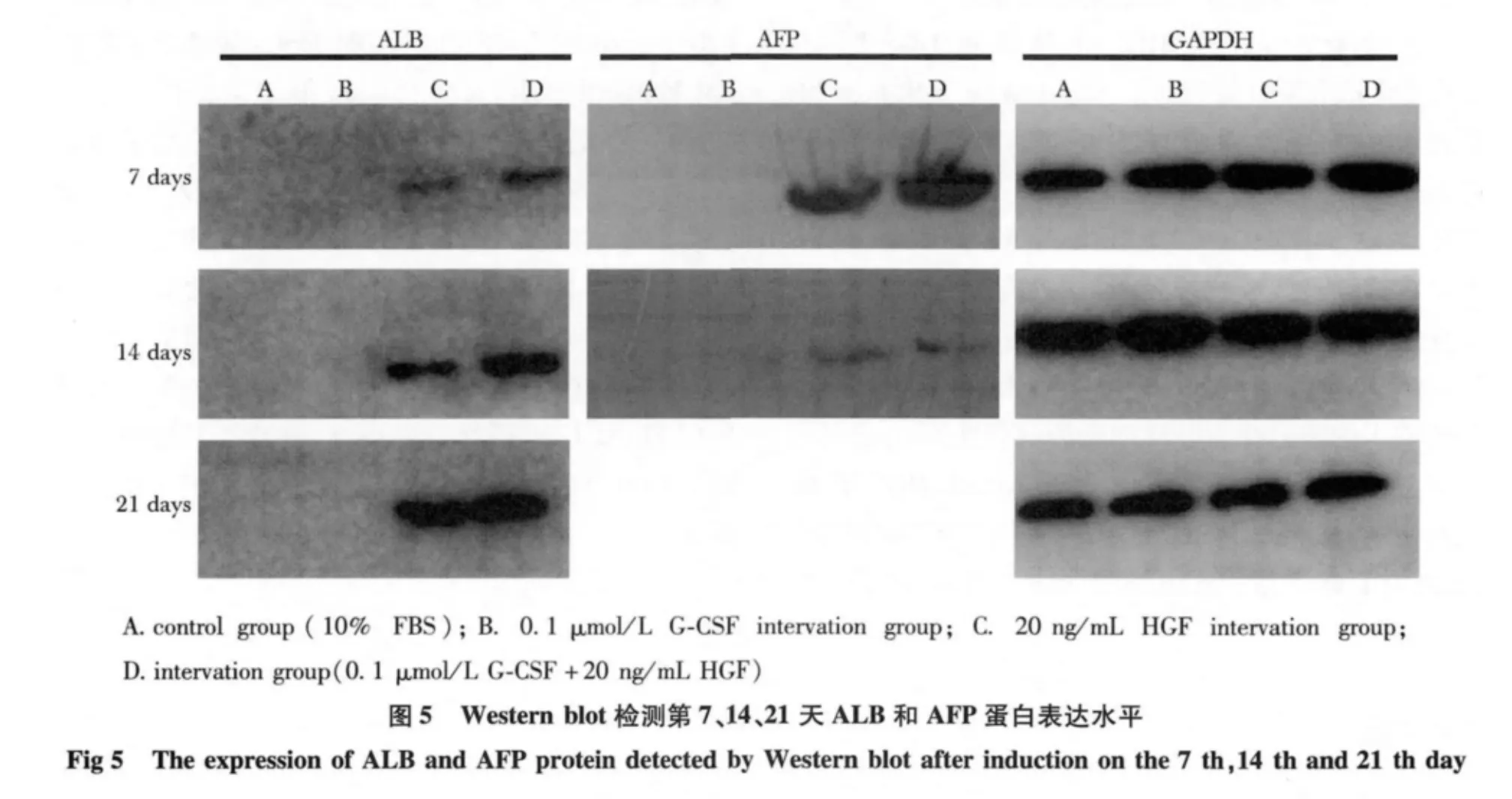
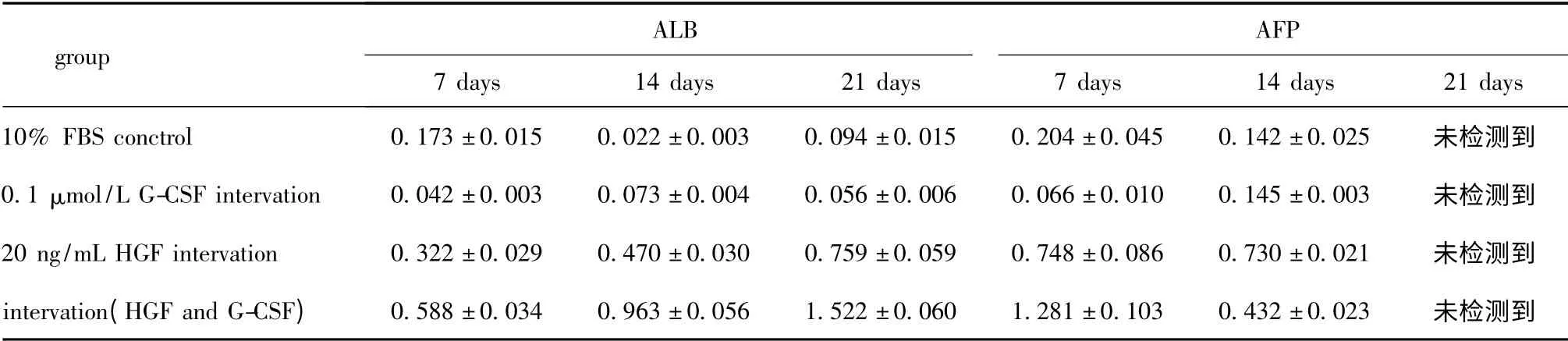
表2 各组不同时间ALB(AFP)蛋白/GAPDH 吸光度值Table 2 Absorbance ratio of protein of ALB or AFP to GAPDH on different days for every group
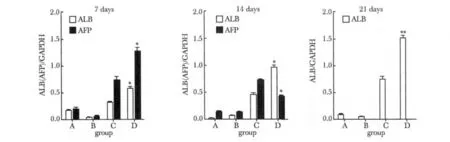
图6 第7、14、21 天ALB 和AFP 蛋白表达Fig 6 Tthe expression of ALB and AFP protien detected by Western blot on 7th、14th and 21th day
本实验20 ng/mL HGF 干预组和HGF 联合G-CSF共同干预组检测到了ALB 和AFP 基因水平和蛋白水平的表达,说明HGF 能够诱导BM-MSCs 分化为肝样细胞,这与既往研究一致,用50 ng/mL HGF 诱导BM-MSCs,RT-PCR 以及Western blot 检测AFP 和ALB 表达水平,表明HGF 能诱导BM-MSCs分化为肝样细胞[9];用HGF、aFGF 和OSM 诱导BM-MSCs,并证实HGF、aFGF 和OSM 诱导大鼠骨髓间充质干细胞分化为肝样细胞的可行性[10]。另外,HGF 联合G-CSF 共同干预组同20 ng/mL HGF 干预组相比,均检测到了ALB 和AFP 基因和蛋白水平的表达,并且趋势是一致的,每个指标并在同一时间比较有统计学意义,这与既往研究类似。研究发现添加0.1 μmol/L G-CSF 培养BM-MSCs 能够显著提高BM-MSCs 增殖能力,并且促进很多生长因子的产生[11]。由此得出,G-CSF 对HGF 的诱导起了协同作用,可能的机制是促进细胞的增殖,以及促进细胞产生HGF 有关系,还需要进一步的实验研究。
综上所述,本实验建立了一种有效的BM-MSCs分化为肝样细胞诱导方案,为干细胞的研究提供参考,但是肝内病理微环境复杂,究竟什么浓度的G-CSF以及HGF 诱导效果更好,是否有其他更强的诱导剂可以用于体外实验等问题,尚待进一步的实验研究。
[1]Alexaian AR.Epigenetic modifiers promote efficient generation of neural-like cells from bone marrow-derived mesenchymal cells grown in neural environment[J].J Cell Biochem,2007,100:362-371.
[2]Stock P,Bruckner S,Ebensing S,et al.The generation of hepatocytes from mesenchymal stem cells and engraftment into murine liver[J].Nat Protoc,2010,5:617-627.
[3]Dong XJ,Zhang H,PanRL,et al.Identif;% 96%94ication of cytokines involved in hepatic differentiation of mBM-MSCs under liver-injury conditions[J].World J Gastroenterol,2010,16:3267-3278.
[4]Masaaki H,Satoshi K,Yasuhiro C,et al.Synergistic effects of granulocyte-colony stimulating factor on bone marrow stromal cell transplantation for mice cerebral infarct[J].Cytokine,2009,46:260-266.
[5]Poloni A,Giarratana MC,Firat H,et al.The exvivo expansion capacity of normal human bone marrow cells is dependent on experimental conditions:role of the cell concentration,serum and CD34 + cell selection in stroma-free cultures[J].Hematol Cell Ther,1997,39:49-58.
[6]Yoshimura H,Muneta T,Nimura A,et al.Comparison of rat mesenchymal stem cells derived from bone marrow,synovium,periosteum,adipose tissue,and muscle[J].Cell Tissue Res,2007,327:449-62.
[7]Jun Z,Qi H,Wang H,et al.Engineering of Vascular GraftsWith Genetically Modified Bone Marrow Mesenchymal Stem Cells on Poly (Propylene Carbonate)Graft[J].Artif;%96%94 Organs,2006,30:898-905.
[8]Zhu H,Guo ZK,Jiang XX,et al.A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone[J].Nat Protoc,2010,5:550-560.
[9]Wang PP,Wang JH,Yan ZP,et al.Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction[J].Biochem Biophys Res Commun,2004,320:712-716.
[10]王忠琼,李昌平,夏世萍,等.大鼠骨髓间充质干细胞体外诱导分化为肝细胞[J].基础医学与临床,2009,29:388-392.
[11]Yasuhiro C,Satoshi K,Toshiya O,et al.Impact of ageing on biological features of bone marrow stromal cells (BMSC)in cell transplantation therapy for CNS disorders:Functional enhancement by granulocyte-colony stimulating factor (G-CSF)[J].Japanese Society of Neuropathology,2011:1-10.

